MRI多期动态对比增强灌注参数与原发性肝癌患者微血管密度、病理分级的关联*
于巍伟 于卫永 刘 坤 杨大为 李大胜 王娜娜
1.北京市海淀医院(北京大学第三医院海淀院区)放射科 (北京, 100080) 2.首都医科大学康复医学院 3.中国康复研究中心北京博爱医院 4.首都医科大学附属北京友谊医院
原发性肝癌(PLC)在我国的发病率较高,据统计,全球每年约1/2新增PLC患者在我国,每年约19%的恶性肿瘤死亡患者为PLC,严重影响患者的生存质量[1]。PLC为一种实体恶性肿瘤,肿瘤细胞的生长及浸润与血管的形成有关,血供不足的肿瘤组织生长缓慢、体积小,血供充足甚至肿瘤组织血管化则生长迅速[2,3]。PLC预后水平与微血管密度(MVD)等密切相关[4]。多期动态对比增强磁共振成像(DCE-MRI)技术以三维容积薄层扫描的梯度回拨T1W1序列为基础,将磁共振对比剂注入静脉团内,开展反复、多期、快速扫描,可检测出脏器组织内部的血流灌注情况,结合相关处理软件分析后可得到多种灌注参数信息[5,6]。DCE-MRI可定量评估组织内的血管性质,据报道,该技术可精确评估肿瘤组织内的微循环水平,能评估肝脏恶性肿瘤组织毛细血管的渗透性、肝动脉血供比例等[7]。本课题旨在分析MRI多期动态对比增强灌注参数与PLC患者MVD、病理分级的相关性,以期为PLC的诊断提供参考。
1 资料与方法
1.1 临床资料 纳入2017年1月至2019年10月我院收治的PLC患者进行回顾性分析,共纳入100例PLC患者作为观察组,男性62例,女性38例,年龄18~75岁,平均(56.25±5.34)岁;选择同时期我院收治的100例肝脏良性结节患者作为对照组,男性59例,女性41例,年龄18~75岁,平均(55.28±5.18)岁。研究已通过我院医学伦理委员会的审核,患者及家属均已签署本次研究的知情同意书。
1.2 纳入及排除标准 PLC患者纳入标准:①临床表现及组织病理学检测符合《PLC诊疗规范(2011版)》拟定的PLC诊断标准;②接受DCE-MRI检测;③均为首次发病。排除标准:①肿瘤组织转移或浸润至其他组织器官者;②合并心、肺、肾等其他重要脏器功能受损者;③伴有严重的传染性疾病、感染性疾病、免疫系统疾病者;③有DCE-MRI检测禁忌证。
对照组纳入标准:①临床表现及组织病理学检测符合肝脏良性结节的诊断标准者;②可接受DCE-MRI检测者;③均为首次发病。排除标准:①合并恶性肿瘤;合并心、肺、肾等其他重要脏器功能受损者;②伴有严重的传染性疾病、感染性疾病、免疫系统疾病者;③有DCE-MRI检测禁忌症者。
1.3 DCE-MRI检测方法 两组患者接受呼吸功能训练后,使用磁共振仪(西门子公司,3.0T型号)对进行DCE-MRI检查,腹部相控阵线圈设为6通道,采用腹带对患者的腹式呼吸进行调节,常规平扫后再行动态、快速、增强扫描,扫描参数设置视野FOV=(320×290)mm,TE为1.4 ms,TR为4.1 ms,0层间隔,3.6 mm层厚,矩阵为(290×185),激励次数为1,增强扫描时仅调节翻转角度(3°、9°、25°),共扫描50个动态周期,每周期持续约6 s、30层,全程约扫描5 min。从第2个扫描周期起自肘正中静脉注入对比剂钆双胺(GD-DTPA),GD-DTPA剂量为0.2 ml/kg,注入速率约4 ml/s,GD-DTPA注入完毕再按同样速率注入20 ml生理盐水进行冲洗。动态增强扫描全程需患者屏住呼吸,仅可进行轻微、快速换气。
1.4 病理学判断标准 观察组患者根据Edmondson-Steiner′s肿瘤病理分级法进行分级[8],根据患者肿瘤细胞的大小、形态、细胞核大小、细胞质中嗜碱着色情况、细胞核的着色深度、细胞质比例等进行病理分级,若肿瘤细胞呈细梁状排列、分化程度最好为Ⅰ级,若肿瘤细胞的细胞质丰富且嗜酸性、细胞核大且着色深为Ⅱ级,若肿瘤细胞的细胞核着色比Ⅱ级更深、见瘤巨细胞为Ⅲ级,若肿瘤细胞细胞质少、细胞核大且着色深、细胞间的连接缺失、分化程度较低为Ⅳ级。根据病理分级情况,Ⅰ级为轻度组,Ⅱ~Ⅲ级为中度组,Ⅳ级为重度组。
1.5 研究方法 观察组患者分为轻度组(29例)、中度组(37例)、重度组(34例)。DCE-MRI扫描完成,采用西门子Tissue-4D处理软件选取Tofts双室模型对测量结果进行分析,避开坏死组织、血管区域,低倍镜下选定微血管密度MVD最高处,调至高倍镜下对微血管数目进行计数,由2名经验丰富的影像医师双盲计数并取MVD平均值。选取3个感兴趣视野,测定血管容积积分(Vp),血管外细胞外间隙体积百分比(Ve),血管内至血管外细胞外间隙的转运系数Ktrans,血管外细胞外间隙转运至血管内的速率常数(Kep)、肝动脉灌注指数(HPI)、对比剂平均通过时间(MTT)、达峰时间(TTP)、血容量(BV)、肝脏总灌注量(FP)、肝动脉灌注量(HAP)、门静脉灌注量(PVP),测定3个视野的平均值。

2 结果
2.1 两组人群Ktrans、Kep、Ve、Vp、MVD值比较 见表1。
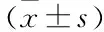
表1 两组人群Ktrans、Kep、Ve、Vp、MVD值比较
2.2 观察组患者各亚组Ktrans、Kep、Ve、Vp、MVD值比较 见表2。
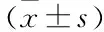
表2 各亚组患者Ktrans、Kep、Ve、Vp、MVD值比较
2.3 两组人群HPI、MTT、TTP、BV、FP、HAP、PVP值比较 见表3。
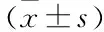
表3 两组人群HPI、MTT、TTP、BV、FP、HAP、PVP值比较
2.4 观察组各亚组患者HPI、MTT、TTP、BV、FP、HAP、PVP值比较 HPI、MTT、TTP、BV、HAP在观察组各亚组患者的水平为轻度组<中度组<重度组(P<0.05),FP、PVP水平为轻度组>中度组>重度组(P<0.05),见表4。
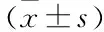
表4 观察组各亚组患者HPI、MTT、TTP、BV、FP、HAP、PVP值比较
2.5 观察组肝脏DCE-MRI灌注参数值与PLC患者MVD的相关性分析 肝脏DCE-MRI灌注参数Ktrans、Kep、Ve、Vp、HPI、MTT、TTP、BV、HAP与MVD呈正相关(P<0.05),FP、PVP与MVD呈负相关(P<0.05),见表5。

表5 观察组患者肝脏DCE-MRI灌注参数值与PLC患者MVD的相关性分析
3 讨论
DCE-MRI是一种无创成像技术,其原理是血管内注入顺磁性对比剂后发生组织T1缩短,若进行重复成像,可测得组织内的信号强度改变,随着时间的延长对比剂对周边组织的扩散得以监测,经专业软件对定量参数进行技术处理后,可测出病变血流的灌注情况,在对血管通透性的评价、肿瘤内微循环水平的判定等方面应用逐渐增多[9,10]。
肿瘤组织内新生血管的情况可反映为MVD水平,尚未发育成熟的肿瘤新生血管通透性高,且新生血管的通透性与DCE-MRI动态、增强检测的方式相关[11],有研究指出,随着原发性肝癌的肿瘤组织体积增大、分化加重,动脉血液的供应相应增多,肝窦可呈现毛细血管样态[12]。由于肿瘤组织生长浸润的形态基础是血管,新生的肿瘤组织血管可提供营养成分,若血管未分化成熟,则通透性较大,DCE-MRI检查中注入的对比剂分子量较小,易由血管内渗出至细胞外间隙[13,14]。血液流速、血管表面的通透性可反映为Ktrans,可提示肿瘤组织微血管的通透程度,对比剂由血管外渗入血管内的速度为Kep,对比剂渗出至血管外细胞外间隙内的体积对比整体血管外细胞外体积为Ve,若肿瘤组织周边血管对的渗透性增大,则Ktrans、Kep、Ve增大[15-17]。本研究发现,观察组Ktrans、Kep、Ve、Vp、MVD均明显高于对照组,Ktrans、Kep、Ve、Vp、MVD在观察组患者各亚组的水平为轻度组<中度组<重度组,可见,DCE-MRI检查原发性肝癌的灌注定量参数与患者的MVD、病变程度明显相关,随着原发性肝癌病变程度加重、MVD增大,Ktrans、Kep、Ve、Vp均增大。
PLC患者的肝小叶结构损坏,再生结节及纤维组织大量增生,甚则血液循环途径改变,门静脉回流不畅,肝动静脉间出现分流,肝血流的阻力增大,PVP可下降[18-20]。PLC患者的肝静脉、门静脉分支在纤维条索等作用下出现闭塞、狭窄,胶原纤维大量沉积于肝细胞间隙[21],流经肝脏的对比剂耗时延长,可见MTT、TTP增大[22]。随着血流阻力的增大,流经门静脉的血流减少,肝总循环中肝动脉的血流占比提高,出现FP下降、HPI增大[23-25]。本研究发现,观察组HPI、MTT、TTP、BV、HAP均明显高于对照组(P<0.05),FP、PVP明显低于对照组,HPI、MTT、TTP、BV、HAP在观察组患者各亚组的水平为轻度组<中度组<重度组,FP、PVP水平为轻度组>中度组>重度组,可见,DCE-MRI检查PLC的灌注定量参数与患者的门静脉血栓发生明显相关,随着PLC病变程度加重,门静脉血栓的风险增大,HPI、MTT、TTP、BV、HAP增大,FP、PVP降低。
综上,DCE-MRI可对PLC患者的微循环情况进行客观地量化评价,定量灌注参数的改变与MVD、病理分级明显相关,可通过DCE-MRI定量灌注参数的检测,评价MVD水平及病理分级,该技术值得进一步推广。

