基于毒痰瘀虚理论的抗癌中药对HepG2细胞Wnt/β-catenin信号通路的影响*
黄海堂 吴辉坤,2,3△ 皇甫炎林 潘 谊
1.湖北中医药大学中医临床学院 (湖北 武汉, 430061) 2.湖北省中医院 3.湖北省中医药研究院 4.宁波市奉化区中医医院
肝癌具有总生存期短、病死率高的特点,是目前世界上第二大癌症相关死亡原因,也是世界上第五大最常见的恶性肿瘤[1, 2]。肝癌是湖北省中医院肝病研究所的重点研究病种之一,对肝癌的辨证论治经历了从“毒”到“毒痰瘀”再到“毒痰瘀虚”的过程。我们对肝癌门诊1 242例原发性肝癌患者的处方药物进行数据挖掘,发现肝癌的临床治疗中,解毒常用茵陈蒿、黄连等,化痰常用薏苡仁、枳实等,祛瘀常用丹参、郁金,补虚常用茯苓、白术等[3],综合全国名老中医吴寿善医师治疗肝癌的用药特点,我们对治疗肝癌的31味高频中药进行了筛选,初步形成了针对“毒、痰、瘀、虚”证候要素的中复药方毒痰瘀脾肾虚方。为了进一步阐明肝癌“毒、痰、瘀、虚”四大证候要素的科学性及其本质,我们根据毒痰瘀脾肾虚方组方的证候要素特点进行拆方、组方,形成了全方、脾虚方、肾虚方、肾阳虚方、肾阴虚方、毒痰瘀方6大组方,通过体外细胞实验分析各组方含药血清对HepG2细胞凋亡、Wnt/β-catenin 信号通路的影响。
1 材料与方法
1.1 实验材料
1.1.1 实验动物和细胞 雄性Wistar大鼠(180~220 g)购自武汉大学实验动物中心;HepG2细胞由武汉巴菲尔生物技术服务公司提供,批号为CL-0341。
1.1.2 药物组成及制剂方法 毒痰瘀方:叶下珠、旋覆花、皂角刺各10 g,半枝莲、蛇舌草各15 g、天葵子、丹参、姜黄各20 g、党参30 g;肾虚方:毒痰瘀方加干地黄、续断、沙苑子各20 g;肾阳虚方:毒痰瘀方加续断、沙苑子各20 g;肾阴虚方:毒痰瘀方加干地黄20 g;脾虚方:毒痰瘀方加炙黄芪、白术各30 g;全方:毒痰瘀方加炙黄芪、白术各30 g,干地黄、续断、沙苑子各20 g。所用中药购自我院药剂科。计算药物总克数,加10倍蒸馏水,倒入锅中煎煮1 h后用纱布过滤出滤液待用;药渣加10倍蒸馏水再煎1次,过滤;把两次得到的滤液倒入锅内加热浓缩至2 g/ml(即每ml含有2 g生药),装瓶,放入冰箱备用。
1.1.3 实验器材 超净工作台购自苏州集团安泰空气技术有限公司,CO2恒温培养箱购自SANYO公司,倒置显微镜购自NIKON公司,低速离心机购自Eppendorf公司,电泳仪电源、垂直电泳槽、电转仪购自北京六一仪器厂,酶标仪购自Thermo公司。
1.1.4 主要试剂 RPMI-1640培养基购自Gibco公司,0.25% Trypsin血清购自GIBCO,FBS公司,青霉素-链霉素溶液(双抗,100×)购自Procell公司,细胞凋亡检测试剂盒购自南京凯基生物公司,细胞培养皿、细胞培养瓶购自Corning公司,细胞凋亡实验所需其他化学试剂购自国产分析纯,磷酸酶抑制剂、PMSF、RIPA裂解液、BCA蛋白浓度测定试剂盒购自碧云天公司,TEMED、丙烯酰胺、甲叉丙烯酰胺购自Amresco公司,Trise-Base、二硫叔糖醇、购自Biosharp公司、蛋白marker(10~250 kD)购自Fermentas公司,小鼠单抗β-actin 、HRP标记羊抗小鼠二抗、HRP标记羊抗兔二抗购自武汉博士德生物工程有限公司,兔多抗p-GSK3β(46 kD)购自Affinity公司,余检测抗体均购自武汉三鹰生物技术有限公司,X光胶片购自柯达公司,显影定影试剂盒购自天津市汉中摄影材料厂,Western Blot检测其他化学试剂购自国药集团化学试剂有限公司。
1.2 实验方法
1.2.1 制备含药血清 雄性Wistar大鼠27只随机分为9组,即空白组、阴性血清组、索拉菲尼组、全方组、脾虚组、肾虚组、肾阳虚组、肾阴虚组、毒痰瘀组,每组3只。中药组大鼠分别予以相应药物浓缩液灌胃,灌胃体积为10 ml/kg,阴性血清组以等体积生理盐水灌胃,空白组不予处理,索拉菲尼组予以50 mg/kg索拉菲尼灌胃,2次/d(每次间隔6 h),连续5 d,于末次给药后1 h乙醚麻醉,无菌条件下经腹主动脉采血,每只大鼠平均采血8 ml,冷置1 h后,放入离心机中离心(2 500 r/min,25 min)分离血清,最终每组平均分离出2.5 ml血清,将血清放置56℃水浴中灭活30 min,加入DMEM培养液中,制成10%含药血清培养液备用。
1.2.2 细胞复苏和培养 将HepG2细胞从液氮中取出,水浴锅中溶解后转移至含有5 ml培养基(1640+10%FBS+1%Penicillin-Streptomycin Solution)的离心管中,室温1 000 r/min离心5 min,收集细胞;用含10%胎牛血清的完全培养基悬浮细胞,接种到培养皿中,轻轻吹打混匀,置于37℃、5% CO2饱和湿温度条件下培养;细胞的密度达到80% 时,弃去培养基,用PBS洗一遍,加入胰蛋白酶消化后加入完全培养基,按1∶3的比例传代,37℃、5% CO2饱和湿温度条件下扩大培养;取处于对数生长期,生长状态良好的HepG2细胞,再次加入胰蛋白酶消化细胞,消化完成后快速弃去胰酶,加入完全培养基,制成单细胞悬液,1 000 r/min离心5 min,去上清,HepG2细胞分别和不同含药血清培养,每孔加2 ml,48 h后收集HepG2细胞进行以下检测。
1.2.3 细胞凋亡实验 用不含EDTA的0.25%胰酶消化细胞,终止消化后收集HepG2细胞,室温1 200 r/min离心3 min,去上清,加PBS重悬,用PBS将细胞润洗2次,1 200 r/min离心5 min,使用AnnexinV-aPC/7-aAD细胞凋亡检测试剂盒进行流式细胞术检测。
1.2.4 Western Blot检测 使用预冷后的PBS冲洗不同处理的HepG2细胞,加入裂解液后,于4℃下12 000 r/min离心5 min,收集上清溶液,蛋白样品进行适当稀释,将BSA标准品制成蛋白浓度为1、0.8、0.6、0.4、0.2标准蛋白后,分别加入96孔板内,使用BCA法测量溶液总蛋白浓度,根据标准蛋白浓度和相应的OD值计算出样品蛋白浓度。通过沸水浴10 min使样品蛋白变性,制备电泳胶,先先以恒压80、120 V进行电泳分离,利用转膜仪进行转膜, 使用5%的脱脂奶粉,室温摇床封闭2 h,加入相应的抗体,4℃孵育过夜,加入二抗,37℃摇床孵育2 h,使用PBST缓冲液清洗5~6次后,黑暗条件下曝光显色,拍照保存。

2 结果
2.1 全方及其拆方组方对HepG2细胞凋亡的影响 见图1、表1。
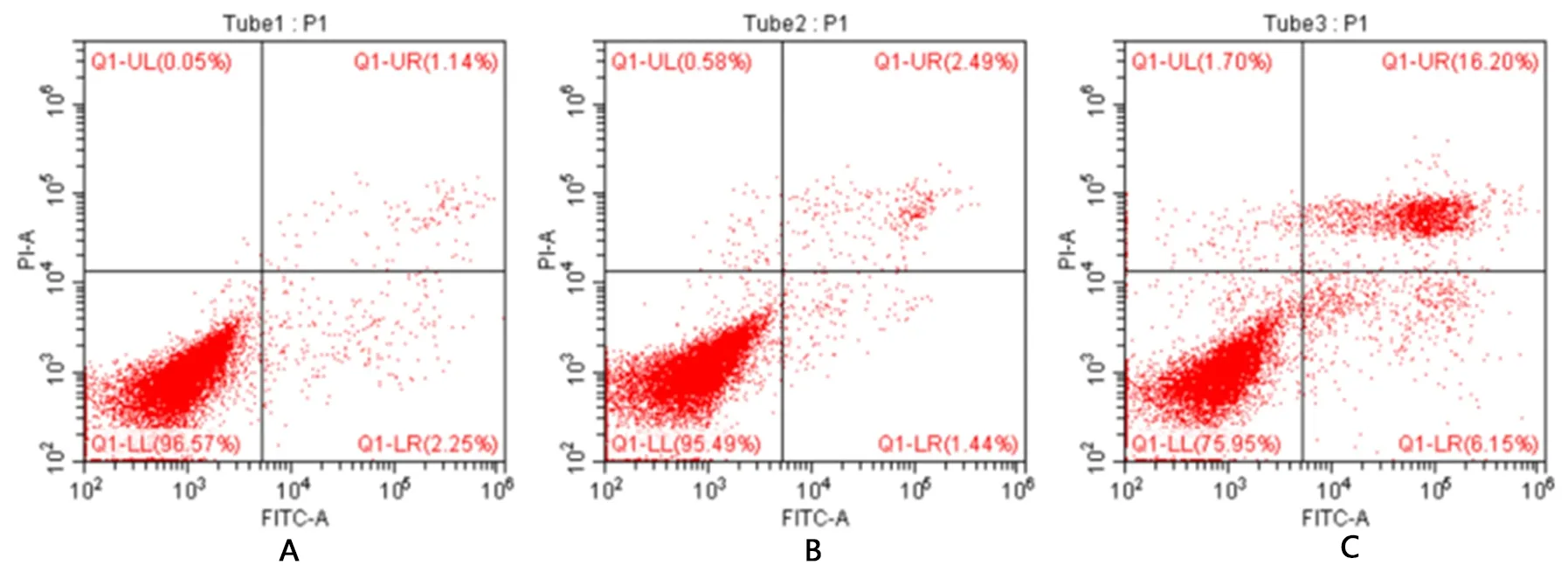

表1 不同含药血清对HepG2细胞凋亡的影响
2.2 全方及其拆方组方对Wnt/β-catenin信号通路相关蛋白表达的影响 全方及其拆方组方对Wnt/β-catenin信号通路相关蛋白GSK-3β、p-GSK-3β、c-myc、cyclinD1、β-catenin、MMP2表达的影响见图2,3、表2。
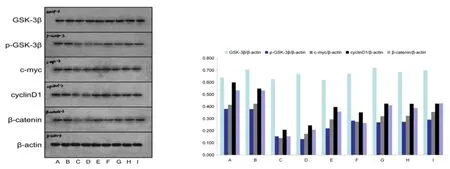
图2 不同含药血清对HepG2细胞Wnt/β-catenin信号通路相关蛋白表达的影响
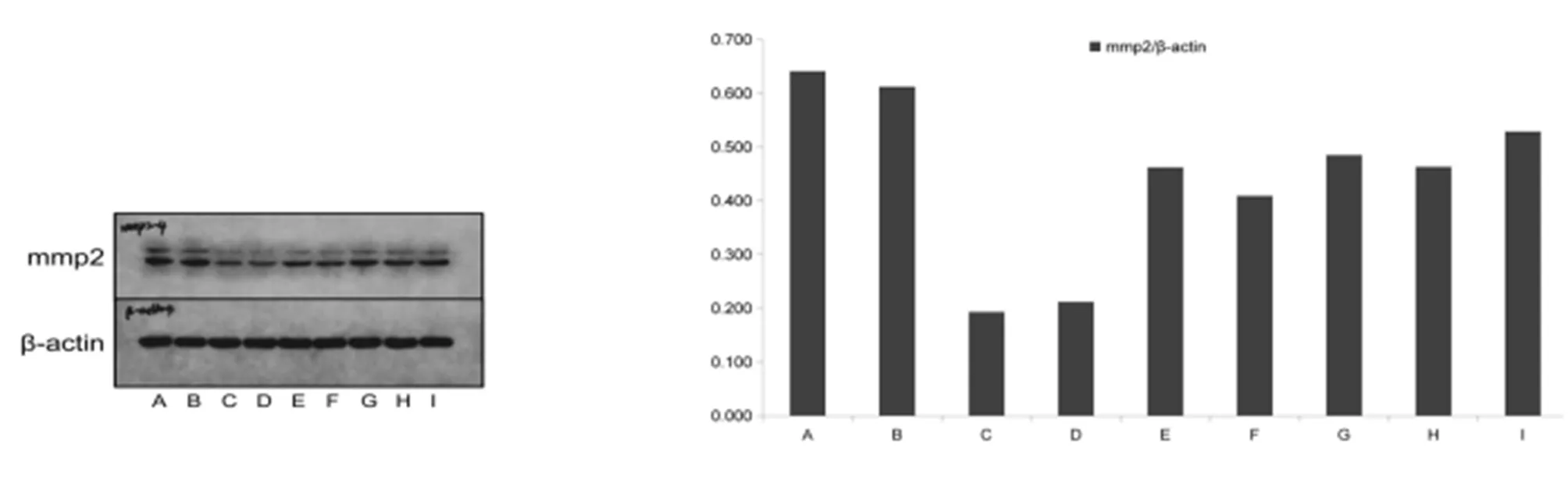
图3 不同组含药血清对MMP2蛋白表达的影响

3 讨论
经典Wnt信号通路与非小细胞性肺癌[4]、乳腺癌[5]、肝癌[6]等多种人类癌症的发生发展密切相关,在细胞增殖周期、免疫周期及细胞的昼夜节律三个循环过程中起着核心作用[7]。GSK-3β是一种高度保守的丝氨酸/苏氨酸蛋白激酶,在细胞的结构重塑、分裂、增殖、黏附、调控基因表达、血管生成及癌变等过程中发挥着重要作用[8]。Wnt 信号的激活可使GSK-3β磷酸化失活,进而抑制β-catenin磷酸化,使β-catenin在细胞内累积,高表达的β-catenin 进入细胞核内与转录因子TCF/LEF结合,促进靶基因转录。CyclinD1作为细胞增殖的一种正性调节因子,其过量表达可加速细胞分裂;c-myc是一个核内癌基因,具有使细胞获得无限增殖、促进细胞分裂的功能,在肿瘤进展中起着重要的调控作用。MMP2是Wnt/β-catenin信号通路下游靶基因,对肝癌的侵袭与转移有促进作用。
毒痰瘀脾肾虚方由叶下珠、天葵子、党参、白术等组成,具有解毒化痰祛瘀、补肾健脾扶正之功效。从“毒、痰、瘀、虚”四大证候要素出发,以扶正解毒、化痰祛瘀为主要治法,探究不同组方作用及影响环节的差异,对于揭示中医药治疗肝癌的机制,评价其疗效及优化组方具有一定的参考价值。此次研究结果表明,根据“毒痰瘀虚”理论形成的中药复方及其证候要素的拆方组方皆可明显促进HepG2细胞凋亡、抑制Wnt/β-catenin信号通路,全方效果优于拆方组方,且全方对Wnt/β-catenin 通路的抑制作用接近于索拉菲尼;全方、脾虚方、肾虚方、肾阳虚方对Wnt/β-catenin信号通路p-GSK-3β、c-myc、cyclinD1、β-catenin蛋白的表达抑制更为显著,提示相比于单用解毒化痰祛瘀药物,以此基础加入补虚类药物对HepG2细胞凋亡、Wnt/β-catenin信号通路抑制具有更明显的效果,其中健脾药、补肾药并用效果优于单用健脾药或补肾药,王宪波教授、李素领教授在肝癌治疗中皆强调了健脾补中、益气扶正的重要性[9,10];钱英教授强调五脏兼顾,以肝脾肾为主,临证多用疏肝健脾补肾类中药[11]。各医家对肝癌的辨证论治虽不尽相同,但总体都讲究辨病辨证相结合,驱邪兼顾扶正,驱邪治疗效果更强。
本研究基于毒痰瘀虚理论,从Wnt/β-catenin信号通路初步探讨中药复方对HepG2细胞的影响,为肝癌的中药治疗提供参考,但是中药复方抗肝癌的作用机制尚不明确,还需后续进一步的系统分析和研究。

