普鲁士蓝显色光度法测定牛奶中β-内酰胺酶的含量
戴兴德,郑小芳,火文琴,张小林
甘肃医学院药学系,甘肃 平凉 744000
青霉素残留是乳制品行业一个重要监控指标[1-2],为逃避打击,一些不法商贩在牛乳中添加抗生素分解剂(β-内酰胺酶)以分解牛乳中残留青霉素。β-内酰胺酶又称青霉素酶,可水解青霉素类物质而使其失效[3],常用于青霉素药品的无菌试验[4]。β-内酰胺酶会造成β-内酰胺类抗生素耐药性,危害消费者身体健康[5],因此,实施牛奶中β-内酰胺酶定量十分必要。目前,β-内酰胺酶的检测方法有碘量法[6-8]、pH 法[9-10]、微生物法[11-16]、高效液相色谱法[17]、紫外光度法[18]等,这些方法过程复杂,大多以定性为主,检出限偏高。
青霉素分子中的硫原子可将Fe3+还原为Fe2+(青霉素水解产物青霉噻唑酸与Fe3+不反应),Fe2+与[Fe(CN)6]3-反应生成可溶性普鲁士蓝 KFeⅢ[FeⅡ(CN)6],β-内酰胺酶阻止该显色反应,吸光度值(A)下降,可根据ΔA计算β-内酰胺酶的浓度。本研究根据该原理建立牛奶制品中β-内酰胺酶残留量的普鲁士蓝显色光度法,并进行优化及验证。
1 材料与方法
1.1 样品 脱脂奶粉及鲜牛奶均为市售产品。
1.2 主要试剂 β-内酰胺酶冻干粉(批号:B1728048,标示量为10 MU)购自上海一研生物科技有限公司;青霉素钠(标示量:400万单位,总质量:2.4 g)购自哈药集团有限公司;硫酸铁铵(分析纯)及硫氰酸钾(分析纯)购自天津市瑞金特化学品有限公司。
1.3 溶液的制备 β-内酰胺酶储备溶液:将β-内酰胺酶冻干粉用1 000 mL的PBS溶解,采用碘量法[6]标定;β-内酰胺酶标准溶液:临用前将储备溶液稀释为200 U/mL;800 U/mL青霉素溶液:称取0.12 g青霉素钠,用pH 7.0的PBS溶解,定容至250 mL(1 mg青霉素钠效价为 1 667 U);0.01 mol/L Fe3+硫酸溶液:精确称取2.66 g硫酸铁铵,用20 mL硫酸(1mol/L)溶解,定容至 1000mL;0.1mol/L[Fe(CN)6]3-溶液:取硫氰酸钾9.7 g,蒸馏水溶解,定容至1 000 mL;醋酸-醋酸钠缓冲溶液(pH 4.5):取醋酸钠 18 g,加冰醋酸9.8 mL,再加水稀释至1 000 mL;实验用水均为蒸馏水。
1.4 方法的建立 将5 mL的800 U/mL青霉素溶液与β-内酰胺酶标准溶液混合,于37℃水浴;加入0.01 mol/L Fe3+硫酸溶液,水浴;水流冲洗冷却,依次加入5 mL的醋酸-醋酸钠缓冲溶液(pH 4.5)和0.1 mol/L[Fe(CN)6]3-,蒸馏水定容至 50 mL,用1 cm比色皿,以蒸馏水作参比,经分光光度计测定吸光度值(A)。
1.5 方法的优化
1.5.1 吸收波长的确定 将青霉素溶液与4.00 mL β-内酰胺酶标准溶液混合,37℃水浴15 min,加入Fe3+硫酸溶液 5 mL,100 ℃水浴 20 min,加入醋酸-醋酸钠缓冲溶液 5 mL,[Fe(CN)6]3-溶液 1 mL,在波长500~900 nm范围内测定A,以检测波长为横坐标,A为纵坐标,绘制催化体系吸收光谱曲线。同时建立空白体系(不加青霉素和β-内酰胺酶)及非催化体系(不加β-内酰胺酶)。
1.5.2 Fe3+硫酸溶液体积的确定 将青霉素溶液与不同体积的 Fe3+硫酸溶液(0、1、2、3、4、5、6 mL)混合,100℃水浴20 min;水流冲洗冷却,加入醋酸-醋酸钠缓冲溶液 5 mL,[Fe(CN)6]3-溶液 1 mL,在波长680 nm处测定A。
1.5.3 [Fe(CN)6]3-体积的确定 将青霉素溶液与5 mL Fe3+硫酸溶液混合,100℃水浴20 min;水流冲洗冷却,加入醋酸-醋酸钠缓冲溶液5 mL及不同体积的[Fe(CN)6]3-溶液(0、0.2、0.4、0.6、0.8、1、1.2 mL),在波长680 nm处测定A。
1.5.4 显色反应温度及时间的确定 将青霉素溶液与5 mL Fe3+硫酸溶液混合,分别于不同温度(50、70、100 ℃)水浴不同时间(0~60 min);水流冲洗冷却,加入醋酸-醋酸钠缓冲溶液 5 mL,[Fe(CN)6]3-溶液1 mL,在波长680 nm处测定A。
1.5.5 显色反应pH的确定 将青霉素溶液与5 mL Fe3+硫酸溶液混合,用0.1 mol/L氢氧化钠和0.1 mol/L盐酸将混合液pH分别调节为0.3~9.0,100 ℃水浴 20 min;水流冲洗冷却,加入[Fe(CN)6]3-溶液1 mL,在波长680 nm处测定A。
1.5.6 酶促反应时间的确定 将青霉素溶液与4.00 mL β-内酰胺酶标准溶液混合,于37℃水浴不同时间(1、2、3、4、5、7、9、11、13、15、17 min),加入 5 mL Fe3+硫酸溶液,100℃水浴20 min;水流冲洗冷却,加入醋酸-醋酸钠缓冲溶液 5 mL,[Fe(CN)6]3-溶液 1 mL,在波长680 nm处测定A。同时建立非催化体系(不加β-内酰胺酶标准溶液)。
1.6 方法的验证
1.6.1 专属性 取800 U/mL青霉素溶液0.00、1.00、2.00、3.00、4.00、5.00 mL,分别加入 5 mL 的0.01 mol/L Fe3+硫酸溶液(青霉素体系),采用优化方法进行检测;另取相同体积的青霉素溶液,加入β-内酰胺酶标准液30.00 mL,30℃水浴30 min,其他步骤同上(青霉素酶催化水解体系);另取相同体积的青霉素溶液,加入2 mol/L的氢氧化钠溶10 mL,100℃水浴30 min;用2 mol/L盐酸调节pH至8.7,其他步骤同上(青霉素碱水解体系)。
1.6.2 线性范围 取5 mL的800 U/mL青霉素溶液,分别加入 β-内酰胺酶标准溶液 0.00、1.00、2.00、3.00、4.00、5.00、6.00 mL,即 β-内酰胺酶含量为 0、4、8、12、16、20、24 U/mL,采用优化条件测定 A。以 β-内酰胺酶含量为横坐标,ΔA为纵坐标,绘制标准曲线。
1.6.3 最低检出限 取5 mL的800 U/mL青霉素溶液,不加β-内酰胺酶标准溶液,平行测定非催化体系10次,计算标准偏差(s),结合标准曲线方程,计算检测限。
1.6.4 准确性 取1.00 g脱脂奶粉,加入5.0 mL水,混匀,超声振荡溶解10 min;加入丙酮定容10 mL,251.5×g离心5 min,取2.50 mL上清液,用蒸馏水定容至25 mL,备用。取脱脂奶粉样品3份,分别加入 300、400、500 U/mL 的 β-内酰胺酶,按优化方法检测酶含量,并按下式计算回收率。
回收率(%)=检出酶含量/(加标前酶浓度+加标量)×100%
1.7 方法的初步应用 取5.00 g鲜牛奶,加入丙酮,混匀,定容10 mL,于4℃,251.5×g离心5 min,取2.50 mL上清液,用蒸馏水定容25 mL。取鲜牛奶样品 3 份,分别加入 125、250、375 U/mL 的 β-内酰胺酶标准溶液,即终浓度为5、10、15 U/mL,取2.00 mL,采用优化方法进行测定。
2 结果
2.1 方法的优化
2.1.1 最适吸收波长 空白体系不显色,无特征吸收;非催化体系于680 nm波长处有强吸收;酶催化体系吸光度下降,见图1。因此确定以680 nm作为测定波长。
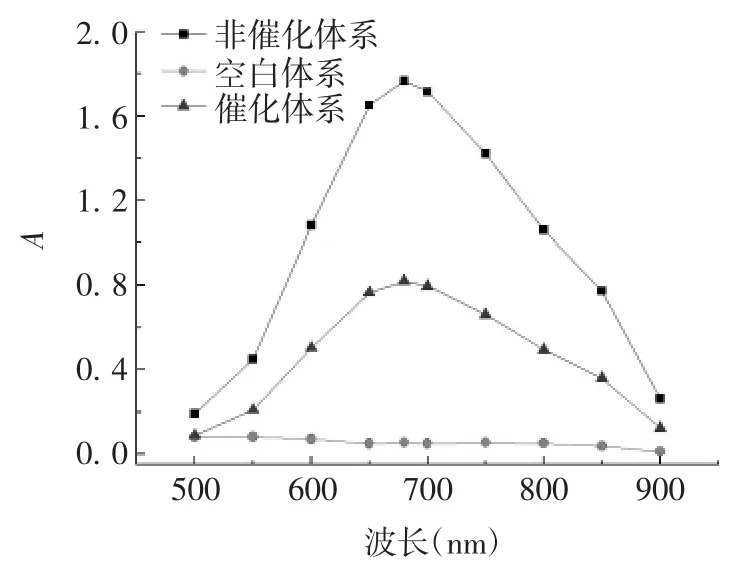
图1 吸收波长的确定Fig.1 Optimization of absorption wavelength
2.1.2 最适Fe3+硫酸溶液用量 Fe3+硫酸溶液在0~2 mL范围内与A680存在良好线性关系,>3 mL时,A680趋于恒定;>5 mL时,A680减小,这是由于大量过剩 Fe3+与普鲁士蓝 KFeⅢ[FeⅡ(CN)6]结构中[Fe(CN)6]4-发生了二次反应。见图2。为减少酶催化体系的测量误差,确保非催化体系青霉素的完全反应,确定Fe3+硫酸溶液用量为5 mL。

图2 Fe3+硫酸溶液用量对检测结果的影响Fig.2 Influence of volume of sulfuric acid solution containing trivalent ferric ion on determination result
2.1.3 最适[Fe(CN)6]3-溶液用量 [Fe(CN)6]3-溶液>0.8 mL时,体系A680达最大,且保持恒定不变,见图 3。为确保 Fe2-完全反应,确定最适[Fe(CN)6]3-溶液用量为1 mL。
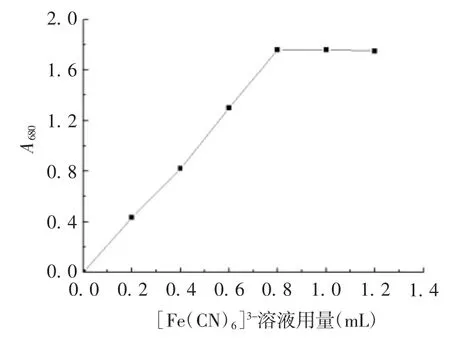
图3 [Fe(CN)6]3-溶液用量对检测结果的影响Fig.3 Influence of[Fe(CN)6]3-volume on determination result
2.1.4 显色反应温度及时间 100℃水浴20 min时,A680达最大,见图4。因此,确定最适水浴温度为100℃,加热时间为20 min。

图4 不同反应温度及时间对检测结果的影响Fig.4 Influence of temperature and time for reaction on determination result
2.1.5 最适显色反应pH pH为3~5时,A680达最大;pH<3 时,A680减小;pH>7.5 时,加热促使Fe3+水解,出现 Fe(OH)3褐色沉淀,A680减小。见图 5。因此选择pH 4.5为最适显色反应pH。

图5 显色反应pH对检测结果的影响Fig.5 Influence of pH value for color reaction on determination result
2.1.6 最适酶促反应时间 在0~13 min内,△A逐渐增大,13 min时ΔA达最大,随后趋于恒定,见图6。因此确定最适酶促反应时间为15 min。

图6 酶促反应时间对检测结果的影响Fig.6 Influence of time for enzymatic reaction on determination result
2.2 方法的验证
2.2.1 专属性 青霉素酶催化水解体系及青霉素碱水解体系均未与Fe3+发生反应,仅青霉素体系可与Fe3+发生反应,见图7。青霉素酶催化水解产物和青霉素碱水解产物同为青霉噻唑酸,与Fe3+均不发生反应,Fe3+与青霉素反应具有唯一性。

图7 青霉素及青霉素水解产物与Fe3+反应的对比Fig.7 Comparison of reaction of penicillin and penicillin hydrolysates with trivalent ferric ion
2.2.2 线性范围 β-内酰胺酶标准曲线见图8。β-内酰胺酶在4~24 U/mL范围内与△A呈良好的线性关系,回归方程为:y=0.091 7 E x-0.512 0,相关系数(r)=0.998 9,根据青霉素反应量和反应液吸光度求得表观摩尔吸光系数(ε)=5.46×104L/(mol·cm)。

图8 β-内酰胺酶的标准曲线Fig.8 Standard curve for β-lactamase
2.2.3最低检出限 平行测定非催化体系10次的s为0.012,最低检测限为0.32 U/mL。
2.2.4 准确性 加入300、400、500 U/mL的 β-内酰胺酶的3份脱脂奶粉样品的酶浓度分别为215、267、332 U/mL,RSD<1.50%,加标回收率在98.8%~101.2%范围内,见表1。表明该方法具有良好的准确性。
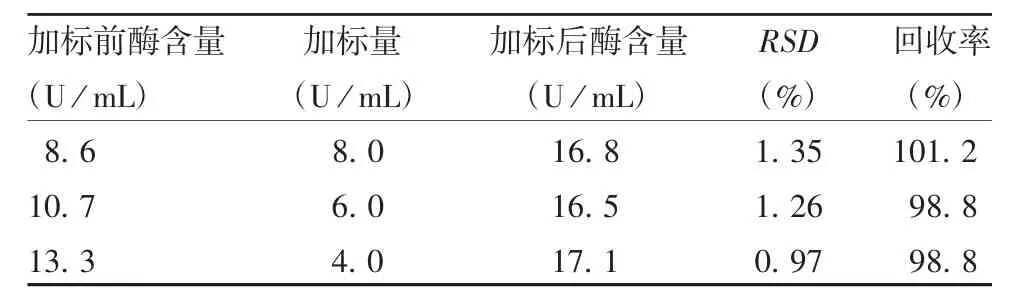
表1 准确性验证结果(x,n=6)Tab.1 Result of verification test for accuracy(x,n=6)
2.3 方法的初步应用 加入 5、10、15 U/mL β-内酰胺酶标准溶液样品的测定值分别为4.80、9.73、16.1 U/mL,与理论值较接近,相对误差分别为-4.0、-2.7、7.3。表明新鲜牛奶中不存在β-内酰胺酶,同时也表明牛奶中其他物质不影响β-内酰胺酶残留的测定。
3 讨论
目前,用于检测牛奶及奶制品中β-内酰胺酶含量较为成熟的方法有微生物培养法和碘量法。微生物培养法灵敏性高,但测定周期较长;碘量法方法简单,不适用于微量分析。本实验建立了牛奶中β-内酰胺酶含量的普鲁士蓝检测方法,经优化后,最适检测条件为:检测波长680 nm,Fe3+体积5 mL,[Fe(CN)6]3-体积 1 mL,显色反应水浴温度 100 ℃,加热时间20 min,显色反应pH 4.5,酶促反应时间15 min。
由于青霉素酶催化水解产物和青霉素碱水解产物同为青霉噻唑酸[7],青霉素水解产物青霉噻唑酸与Fe3+均不发生反应。本实验结果表明,青霉素酶催化水解体系及青霉素碱水解体系均未与Fe3+发生反应,仅青霉素体系可与Fe3+发生反应,表明Fe3+与青霉素反应具有唯一性。β-内酰胺酶在4~24 U/mL范围内与ΔA呈良好的线性关系,回归方程为:y=0.0917Ex-0.5120,r=0.9989,检出限为 0.32U/mL,明显优于前期报道的 pH 法(15和 8.29 U/mL)[9-10]。加标试验结果表明,加标回收率在98.8%~101.2%范围,表明本实验建立的方法准确性良好。
采用优化方法对新鲜牛奶样品进行检测,测定值与理论值较接近,相对误差在-4.0~7.3范围内,表明新鲜牛奶中不存在β-内酰胺酶,也表明牛奶中其他物质不影响β-内酰胺酶残留的测定。综上所述,本实验建立的方法具有良好的线性及准确性,且简便、省时,可用于牛奶及奶制品中β-内酰胺酶含量的检测。

