促红细胞生成素对慢性心力衰竭合并贫血患者相关指标的影响分析
伍继初,李雄志,王莎,罗参香
慢性心力衰竭(chronic heart failure,CHF)是多种心脏疾病的终末阶段的主要表现,也是由心脏结构和功能异常引起心室充盈和射血功能受损的一种临床综合征[1]。据报道,CHF患者在病情发展末期常合并不同程度缺铁性贫血,导致症状加重,病死率显著升高[2]。因此,纠正CHF患者的贫血状态至关重要。有文献报道称,促红细胞生成素(erythropoietin,EPO)可通过与红细胞生成素受体结合,促进红系祖细胞的分化与增殖,延缓其衰老程度,提升血红蛋白水平,从而改善贫血症状,可能一定程度上改善CHF患者临床症状及心功能,但也有研究认为对心功能改善不明显,对于EPO应用价值及安全性上存在一定争议[3-4]。基于此,本研究对CHF合并贫血患者进行外源性补充EPO治疗,并于治疗前后检测血液生化指标、心功能指标、炎性因子指标的变化,分析EPO对CHF合并贫血患者的影响,旨在为临床治疗提供参考依据。
1 资料与方法
1.1 临床资料 选取2017年3月-2019年3月邵阳市中心医院收治的CHF合并贫血患者140例,其中男89例,女51例,年龄50~79岁,病程1~9年。均符合中华医学会心血管病学分会心力衰竭的相关诊断标准[5],入院时心功能分级Ⅲ~Ⅳ级;符合中华医学会血液学分会贫血相关诊断标准[6]:成年男性血红蛋白(Hb)<120 g/L,红细胞计数(RBC)<4.5×1012/L],成年女性Hb<110 g/L,RBC<4.0×1012/L;患者及家属知情同意,愿意配合观察。排除近3个月内有不稳定型心绞痛及急性心肌梗死者,既往有原发性血液系统疾病、活动性消化道出血、继发性贫血及其他严重基础疾病者,既往有EPO治疗史者。根据随机数字表法将140例患者分为观察组和对照组,每组70例。2组患者年龄、性别、病程、心功能分级等一般资料比较,差异无统计学意义(P>0.05)。见表1。
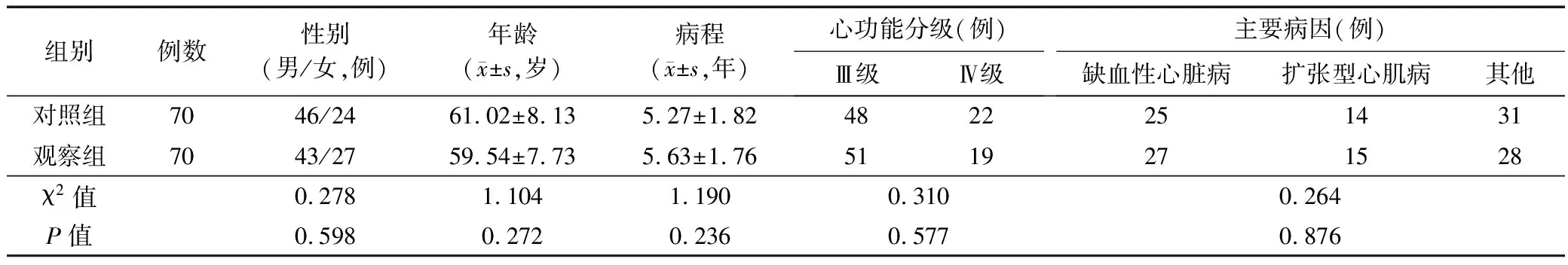
表1 2组患者一般资料比较
1.2 治疗方法 2组均接受心力衰竭常规治疗,给予利尿剂、血管紧张素转换酶抑制剂、血管紧张素受体拮抗剂、β受体阻滞剂、洋地黄类药物及硝酸酯类药物等。在此基础上,对照组加用琥珀酸亚铁片(南京金陵制药厂生产,国药准字H10930005,规格:0.1 g/片)每次1片口服,每天3次;观察组每天口服琥珀酸亚铁片(方法、剂量同对照组),同时给予皮下注射EPO制剂(山东科兴生物制品有限公司,国药准字S20000008,规格:3 000 IU/瓶)50 IU/kg,每周3次。2组疗程均为3个月,贫血相关指标恢复正常后,可根据临床实际情况略加调整剂量及用法。
1.3 观察指标 分别于治疗前、治疗3个月后比较2组患者血液生化指标、心功能指标和炎性因子指标。并于治疗3个月内进行随访,观察2组患者不良反应情况。(1)血液生化指标:取静脉血3 ml,采用美国雅培公司T300全自动血液分析仪进行Hb、红细胞压积(HCT)、RBC、血清铁蛋白(SF)指标测定;(2)心功能指标:采用德国西门子SC-2000彩色多普勒心脏超声检测仪进行检查,记录左心室射血分数(LVEF)、左室舒张末期内径(LVEDD),检测取3个心动周期的平均值,采用NYHA分级评估心功能,检测6 min步行最大距离值(6MWD),采用电化学发光法检测N端脑利钠肽原(NT-proBNP);(3)血清炎性因子指标:于清晨抽取空腹静脉血3 ml送检,采用电化学发光免疫技术测定超敏C反应蛋白(hs-CRP),采用荧光偏振免疫分析法检测同型半胱氨酸(Hcy),采用放射免疫法检测白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α),标本送金域医学检验中心完成。
2 结 果
2.1 血液生化指标比较 2组治疗3个月后Hb、HCT、RBC、SF水平均明显高于治疗前,组内比较差异有统计学意义(P<0.01);且观察组上述指标均高于对照组,组间比较差异有统计学意义(P<0.05或P<0.01)。见表2。

表2 2组患者治疗前后血液指标比较
2.2 心功能指标比较 2组治疗3个月后LVEF、6MWD水平较治疗前明显升高,LVEDD、NYHA分级、NT-proBNP水平较治疗前明显降低,组内比较差异有统计学意义(P<0.05或P<0.01);但治疗后,2组LVEF、6MWD、LVEDD、NYHA分级组间比较差异均无统计学意义(P>0.05),观察组NT-proBNP水平低于对照组,组间比较差异有统计学意义(P<0.01)。见表3。

表3 2组患者治疗前后心功能指标比较
2.3 炎性因子水平比较 2组治疗3个月后血清hs-CRP、Hcy、IL-6、TNF-α水平均明显低于治疗前,组内比较差异有统计学意义(P<0.01);治疗后,观察组血清hs-CRP、Hcy、IL-6、TNF-α水平均明显低于对照组,组间比较差异有统计学意义(P<0.01)。见表4。

表4 2组患者治疗前后炎性因子水平比较
2.4 不良反应比较 随访期间发现,观察组出现眩晕2例、腹胀4例、恶心2例、便秘1例、关节疼痛2例,不良反应总发生率为15.71%(11/70);对照组出现眩晕3例、腹胀2例、恶心2例、便秘1例,不良反应总发生率为15.71%(8/70),2组比较差异无统计学意义(χ2=0.499,P=0.480)。2组患者均未出现血栓形成,不良反应症状较轻,经相应治疗后均缓解。
3 讨 论
临床上,部分CHF患者常合并贫血,以轻中度贫血多见,具体原因尚未完全清楚,可能与以下因素相关:心力衰竭时心功能急性失代偿使肠胃消化吸收功能下降,导致铁元素和叶酸摄入量减少[7];长期服用血管紧张素转换酶抑制剂或血管紧张受体阻断剂抑制EPO的分泌;心力衰竭时,患者机体细胞因子如TNF-α、IL-6活性强,干扰肾EPO活性;醛固酮分泌增加引起水钠潴留等[8]。有观点认为贫血是心力衰竭患者死亡的重要危险因素,因贫血患者常伴有组织低氧血症,为增加局部组织氧供,血管会发生扩张,引起患者血压下降,激活交感神经系统,导致外周血管收缩和心率过速[9]。因此除常规抗心力衰竭治疗外,积极纠正贫血尤为重要。
本研究结果显示,EPO联合铁剂用于治疗CHF合并贫血患者后,Hb、HCT、RBC、SF水平均明显高于对照组,表明EPO辅助治疗有助于改善CHF合并贫血患者的贫血症状。同时本研究也发现,2组的心功能代表性指标LVEF、LVEDD、NT-proBNP、NYHA分级、6MWD和炎性因子hs-CRP、Hcy、IL-6、TNF-α均较治疗前有所改善,且观察组NT-proBNP显著低于对照组。这提示EPO联合铁剂治疗可降低炎性反应,也可能在一定程度上帮助改善心功能[10]。与周友根等[11]得出EPO辅助治疗可直接发挥心肌保护作用,降低全身炎性反应的研究结论相似。有研究认为EPO联合铁剂可明显改善患者LVEF、LVEDD、NYHA分级等心功能指标[12],本研究尚未发现2组患者在这些指标方面有明显差异,这可能与本研究纳入样本差异或观察时间短有关。
CHF被认为是一种全身性系统性炎性反应疾病,在炎性反应发生过程中,其炎性细胞因子及中间代谢产物可对心肌细胞造成损伤,并能间接或直接通过抑制骨髓造血及肾脏EPO的产生,使机体内铁的生物利用度水平减小,导致贫血症。于秀燕等[13]、Ranjbaran等[14]认为EPO可通过激活蛋白酪氨酸激酶2等途径上调凋亡基因起抗细胞凋亡作用,激活信号转导子或蛋白激酶B信号途径介导,抑制炎性反应氧化应激作用损伤心肌细胞,共同实现对心脏的组织保护作用,从而达到心功能改善的效果。随访期间,本研究发现2组患者出现了与铁剂或EPO相关的恶心、便秘、腹胀等轻微不良反应,但未见严重不良反应者。文献表明,慢性疾病伴有贫血患者皮下注射EPO虽有较好的安全性,但应用EPO剂量较大时会出现血压上升、血栓形成、头晕、癫痫、胃肠道反应等不良反应,严重甚至可能会增加患者心血管不良事件和死亡等风险[15]。而本研究采取了较小的EPO剂量,故2组不良反应差异不明显,安全性及耐受性良好。
综上所述,EPO可纠正CHF合并贫血患者贫血情况,并减轻炎性反应,改善患者心功能,具有一定的临床应用价值。但是,本研究由于样本量较小,亦可能存在一定统计学偏倚,循证医学证据强度仍有待大样本、多中心研究进一步验证。

