低氧对虾类影响的研究进展
王盼,史文军,万夕和,沈辉,黎慧,王李宝,杨泽禹,胡润豪,吴旭干
(1.江苏省海洋水产研究所,江苏 南通 226007;2.上海海洋大学水产科学国家级实验教学示范中心,上海 201306;3.中国科学院烟台海岸带研究所,山东 烟台 264003)
低氧通常指水中的溶解氧含量降低,当溶解氧水平低于2~3 mg/L 时,就会出现低氧,这种水体被称为低氧水体[1]。在定义低氧时考虑的生物对象不同,不同生物体获得氧气的能力和代谢需求也存在差异,因此一种较为合理的定义认为:在水体溶解氧含量高于一个临界值(critical oxygen level,COL)时,其耗氧率不受溶解氧降低的影响来界定水体是否低氧,而溶解氧含量低于这个临界值即为低氧[2]。水生环境中的溶解氧量极易受温度、盐度、水深和大气压等外界环境因素的影响[3]。近年来,工业废水排放增加引起的水体富营养化,温室效应引发的气候变暖以及突变天气或灾难性天气的发生,水体低氧现象日益频繁发生;此外,水生动物在长途运输过程中也常出现低氧现象[4]。低氧不仅引起虾类行为的改变,也引起其生理生化方面的变化,对虾类的生命活动产生重要影响。
1 低氧对虾类存活的影响
不同品种虾类对低氧的耐受能力不同,同一种类不同品系或不同规格的虾对低氧的耐受能力也存在差异(表1)。
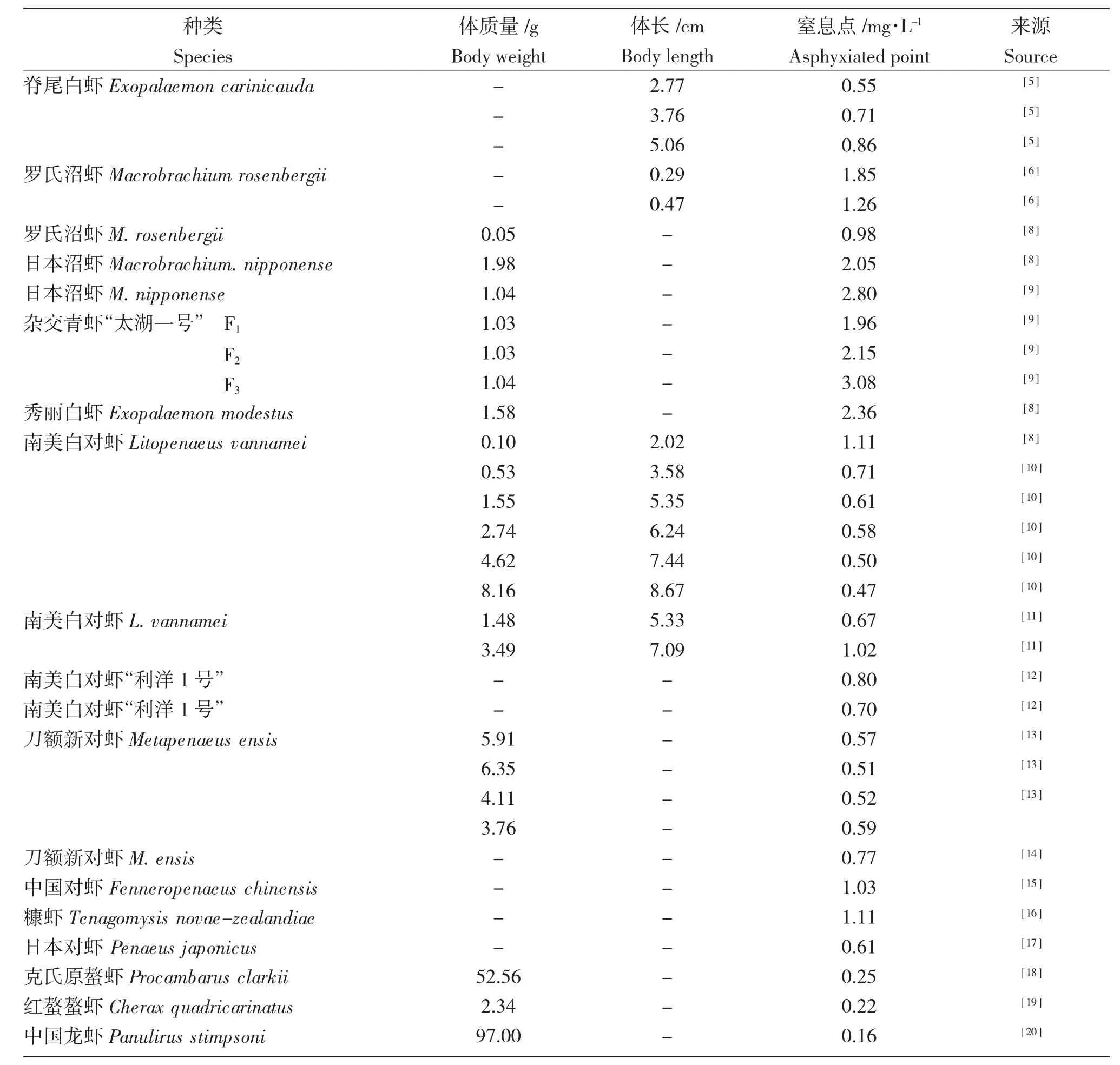
表1 虾类的窒息点Tab.1 Asphyxia points of shrimp
2 低氧对虾类行为的影响
不同虾类耐低氧能力不同在低氧环境下的行为也有所不同。低氧会引起虾类行为的改变,如跳跃、缓行或向常氧区迁移等。DO 小于2 mg/L,虾类活动增强,并出现眼柄快速运动及触角、鳞屑和腹部弯曲[21]。日本对虾(Penaeus japonicus)在低氧环境下首先出现短时间持续游动[22],然后静伏于底部,游泳足间隔性高频划水,幅度随着DO 的继续下降而减弱,当DO 低于1 mg/L,部分虾体开始侧偏。中国对虾(Fenneropenaeus chinensis)在DO 3 mg/L 时游泳速度开始下降[23],长期低氧对其临界游泳速度和甩尾速度的影响更明显。而一些虾类可避开低氧环境向常氧区域迁移,如褐美对虾(Penaeus aztecus)在DO 2 mg/L、白对虾(Penaeus setiferus)在DO 1.5 mg/L 时都会表现强烈的逃避反应[21];刀额新对虾[13](Metapenaeus ensis)、口虾蛄[24](Oratosquilla oratoria)、淡水小龙虾[25](Paranephrops zealandicus)等也被发现存在类似的低氧逃避行为。潜沙性虾类在低氧时则从沙中露出,如褐虾[26](Crangon crangon)在DO 降低后,体前端首先从沙中抬出,而后虾体逐渐露出,活动增强,当氧饱和度降至30%后,活动逐渐停止。
低氧环境下虾类可提高呼吸频率,增加流经鳃腔的水流以满足机体对氧的需求。研究发现:随着氧分压的下降,长臂虾[27](Palaemon adspersus)颚舟叶摆动频率不断增加,在40 mm Hg 附近时达到最大值,当氧分压降低到40 mm Hg 后,颚舟叶的摆动频率下降到原来的70%左右;凡纳滨对虾[28]在DO低于3 mg/L 时,颚舟叶的摆动频率随DO 下降而升高,但当DO 降到1.43 mg/L 以下时,颚舟叶的摆动频率明显下降,直至死亡才停止。部分穴居虾类在低氧时会把头胸部露出水面,鳃后部浸入水中,从鳃腔排水或通过腹肢拍打将更多的含氧水灌入洞穴,以补充氧气的供应[29,30]。
3 低氧对虾类的生长的影响
低氧影响虾类摄食、消化和蜕皮等正常生理活动,进而影响虾类的生长。韩丝银[31]发现,在循环重/中度低氧条件下,凡纳滨对虾的增重率和增长率降低,消化酶活性下降,其中胰蛋白酶下降最多。胡贤德[32]等研究发现,低氧环境下,斑节对虾(Penaeus monodon)和日本对虾的饲料利用率较低,生长受到抑制,而当水体DO 保持在3.5 mg/L 以上时,虾的饲料利用率高,生长正常。凡纳滨对虾幼体可以在较低的DO 水平下存活,但低于4 mg/L 时生长速度下降[33]。水体DO 低于4.13 mg/L 时,中国对虾的生长受到抑制,摄食量和饲料利用率也逐渐降低[2],DO低于3 mg/L 时其摄食量显著降低,低于2 mg/L 后摄食基本停止[34]。水体DO 低于2 mg/L 时,凡纳滨对虾仍可摄食,但摄食量明显减少,生长受到抑制[35]。水体氧饱和度低于50%时美洲螯龙虾(Homarus americanus)壳的硬度降低、蜕皮周期延长,体质量降低[36]。长期低氧抑制短沟对虾(Penaeus semisulcatus)蜕皮,影响其正常生长[37]。
4 低氧对虾类生理生化的影响
虾类可以不同生理方式来调节机体,以适应非致死性低氧环境,主要包括调节心率、呼吸代谢方式、血蓝蛋白含量、免疫能力、抗氧化能力以及渗透能力等。
4.1 呼吸
在低氧环境下,虾类可增加心搏量(stroke volume,Vs)维持心脏输出量(cardiac output,Vb),补偿低氧引起的心率(heart rate,fH)过缓,如克氏原螯虾[38]、美洲螯龙虾[38];刀额新对虾[13]的心率随着水体DO 浓度的降低而下降。而短刀小长臂虾Palaemonetes pugio[39]维持Vb 的机制却不相同,从常氧环境降到中度低氧13.3 KPa 环境中时,其通过fH 的增加来维持Vb,从而补偿VS 的减少。但Guadagnoli等[40]发现,短刀小长臂虾在13.7 KPa 和10.3 KPa 氧分压水体中,fH、Vs 和Vb 没有变化,氧分压降至6.8 KPa 以下时,fH 和Vb 显著下降,而Vs 下降不明显。
4.2 代谢
在低氧环境下,虾类可调节呼吸代谢方式,从有氧代谢转变为无氧代谢,以糖酵解方式获得部分能量,终产物乳酸积累增多。在低氧下凡纳滨对虾血液中乳酸和葡萄糖水平显著增加;而肌肉中乳酸和葡萄糖浓度却没有变化[41,42]。研究中发现,在临界氧阈值以下,北方长额虾(Pandalus borealis)参与无氧代谢的乳酸脱氢酶(LDH)、丙酮酸激酶(PK)和磷酸烯醇式丙酮酸激酶(PEPCK)的活性在雌虾中下降,而在雄虾中只有PEPCK 活性下降[43]。随着低氧暴露时间的延长,日本沼虾肝胰腺和肌肉组织细胞色素氧化酶(CCO)和琥珀酸脱氢酶(SDH)活力显著下降,延胡索酸还原酶(FRD)和LDH 活力显著上升[41]。低氧3 h 后,凡纳滨对虾果糖1,6-二磷酸酶(FBP)在肝胰腺的表达下降,24 h 后恢复,48 h 增加了40%;在鳃和肌肉中都明显减少;而低氧诱导肝胰腺磷酸果糖激酶(PFK)的表达量增加了90 倍,鳃中的PFK 在低氧24 h 内没有明显变化,48 h 增加了1.5 倍[42]。在低氧胁迫下甘油醛-3-磷酸脱氢酶(GAPDH)的表达也增加[44]。低氧环境下的糖酵解速率加快意味着低氧组织对葡萄糖的需求更高,葡萄糖在不同类型转运蛋白的帮助下促进转运进入细胞[45-47]。然而部分虾类如泥虾(Calocaris macandreae)无氧代谢只在严重低氧时才开始[45]。
4.3 血蓝蛋白
血蓝蛋白是虾类血淋巴中含铜的氧转运蛋白,占血淋巴总蛋白的90%以上,其合成代谢与水体DO 变化直接相关[46]。水体DO 变化时,虾类可启动血蓝蛋白的合成,保证正常的呼吸代谢。Hagerman[47]等研究发现,蜕皮间期,褐虾血蓝蛋白平均浓度为0.5~0.6 mmol/L,低氧7 d 和14 d 后分别上升至0.8 mmol/L和1.3 mmol/L。黄天鸽等[46]研究也发现,在低氧下凡纳滨对虾血蓝蛋白含量上升,复氧后恢复。
4.4 免疫
虾类的免疫防御主要依赖血细胞的凝血、吞噬、包裹和伤口愈合等功能[48]。低氧影响虾类的免疫系统,降低虾类对病原细菌如弧菌的定位与清除[49]。低氧下,细角对虾[50](Penaeus stylirostris)的大颗粒细胞、半颗粒细胞、透明细胞以及总血细胞数量都下降,酚氧化酶活性增加;感染弧菌后相对于实验组虾的死亡率提高,说明低氧降低了虾对弧菌的抵抗能力。罗氏沼虾[51]长时间暴露在低氧环境下总血细胞和透明细胞数量也显著减少。在低氧环境下凡纳滨对虾血淋巴的溶菌活性和抗菌活性也显著降低[52]。因此,低氧会引起虾的免疫能力下降,降低对病原菌的抵抗力[53,54]。
4.5 抗氧化能力
低氧可诱导虾类产生活性氧,破坏细胞内大分子,不利于维持细胞稳态。良好的抗氧化防御系统是应对氧化损伤的有效策略。这主要包含一些抗氧化酶系,如超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPx)、过氧化氢酶(CAT)、过氧化物酶(POD)和谷胱甘肽-S-转移酶(GST)等。研究发现,不同种虾、同种虾不同组织、低氧时间以及复氧前后,虾类抗氧化酶活性都存在显著差异。临界氧阈值以下北方长额虾肌肉中SOD 活性下降,雌虾下降33%,雄虾下降达70%;肝胰腺中SOD 活性,雌虾下降62%,雄虾下降52%;雌虾肝胰腺GPx 酶活性没有变化,而雄虾升高[43]。凡纳滨对虾[55]低氧下肌肉组织中SOD 活性显著升高,复氧1 h 后活性较低;在肝胰腺组织中,SOD、CAT 和GPx 酶在低氧下都表现出活性增加,复氧1 h 后SOD 和GPx 活性明显降低,3 h 后又显著升高,表明低氧-复氧对抗氧化酶活性有影响。另有研究发现,低氧6 h 和24 h 时,凡纳滨对虾鳃中CAT 活性分别增加3.2 和2.4 倍[56]。随着低氧时间的延长,日本沼虾肌肉中SOD、CAT和GPx 3 种酶活力均呈现先升高后降低的变化趋势;鳃组织中SOD 和CAT 酶呈现先升高后下降,GPx 酶在低氧期间一直呈升高趋势[57]。
4.6 渗透压
渗透调节能力是水生动物维持机体稳态的主要方式之一[58],虾类血淋巴渗透压的调节主要依赖于无机离子浓度。水体DO 低于3 mg/L 时,蜕皮期,细角滨对虾的渗透调节能力下降,6 h 达到最低[59]。褐虾随着氧张力的下降,血淋巴氯离子流失,钙离子浓度增加,总血淋巴渗透值保持相对恒定[60]。在循环重/中度低氧下,血淋巴离子调节基因的转录在短期内增加,之后恢复正常或下降,表明虾长期低氧环境下渗透调节机制可能被损坏[30]。罗氏沼虾[61]和凡纳滨对虾[62]渗透调节能力在低氧下也都呈下降趋势。
总的来说,虾类应对低氧应激的生理调节方式主要涉及3 种:首先提高呼吸频率,增加流经鳃上的水流,增加氧结合蛋白的含量来维持氧的输送。其次是减少机体耗能量,主要表现为以伏底等来减少运动,减缓消耗运动消耗,最后是转变代谢方式,以无氧代谢途径补充能量,缓解部分能量的消耗。
5 低氧对虾类组织结构的影响
组织学是病理检查的标准方法,可以用来评估生物体的健康情况[63]。甲壳动物的鳃是呼吸、排泄和渗透调节的重要器官,直接与水体接触,也极易受环境影响及病害损伤[64]。Sun 等[65]研究发现,低氧下日本沼虾鳃组织结构表现为血细胞浸润、鳃片肿胀坏死、排列紊乱。肝胰腺是消化、吸收、储存和代谢的主要器官,在虾的防御过程中也起重要作用[66]。杨明等[62]研究表明,低氧条件下日本沼虾肝胰腺组织分泌细胞运转泡体积减小,数量降低。韩丝银[30]研究发现:循环重/中度低氧下凡纳滨对虾肝胰腺组织小管管腔逐渐空泡化,最后破裂使上皮细胞层变薄。有关研究也表明,低氧还会损伤对虾的肌肉[67]、中肠[30]和线粒体超微结构[68]。
6 低氧对虾类相关基因的影响
6.1 低氧诱导因子(HIF)
低氧诱导因子(HIF)是氧稳态和低氧适应性反应的主要调控因子,可以调控许多基因的转录,参与控制细胞对低氧的系统反应。其中有的基因是通过增加葡萄糖摄取和糖酵解来促进细胞对低氧的适应,有的是控制促进红细胞成熟或者血管生成和血管舒缩来增加组织对氧气的转运能力[69,70]。HIF是异质二聚体,由α 和β 亚基组成;氧调控HIF介导的转录激活有多个步骤,主要通过HIF-1α 介导。HIF-1α 具有氧依赖降解区(ODD)和C 末端反式激活结构域(C-TAD),在常氧量条件下,这些区域内保守的脯氨酸和天冬酰胺残基被一系列羟基酶羟基化,HIF-1α 迅速被肿瘤抑制蛋白降解;在低氧条件下羟基化程度降低,导致HIF-1α 积累并与HIF-1β 相互作用,诱导靶基因的转录[71]。虾类以系列的分子机制适应低氧环境。
目前有关虾类HIF-1 的研究多在于序列的克隆以及低氧下的差异表达。Li 等[72]发现,短刀小长臂虾的HIF-1α 与脊椎动物相似,有一个螺旋-环-螺旋(bHLH)结构域、两个PAS 结构域、一个有两个脯氨酸羟基化修饰位点的氧依赖降解区(ODD)和一个有天冬酰胺羟基化修饰位点的C 端反式激活结构域(C-TAD);但是,短刀小长臂虾HIF-1α中一段长230 个氨基酸的独特序列,在其他任何脊椎动物中都没有发现。凡纳滨对虾[73]、日本沼虾[74]、日本对虾[75]的HIF-1α 也具有这些基本结构域。凡纳滨对虾不同组织在低氧状态与常氧状态下HIF-1α 与HIF-1β 转录水平差异显著,常氧状态下鳃的HIF-1α 转录水平比肌肉和肝胰腺高,低氧状态下(1.5 mg/L DO 胁迫24 h),鳃、肌肉和肝胰腺的HIF-1α 转录水平分别下降了35 倍、50 倍和18倍;而HIF-1β 的转录水平在鳃中下降了1.8 倍,在肌肉中却增加了4 倍,肝胰腺中却没有发生显著变化[77]。Sonanez-Organis[76]等也发现,在低氧状态下凡纳滨对虾鳃中和肌肉中HIF-1α 转录水平显著下降。而日本沼虾在低氧条件下(2.0 mg/L),鳃和肌肉中HIF-1α 的mRNA 表达量在低氧1 h、3 h 和24 h均显著增加,HIF-1β 的mRNA 表达量却无显著变化[78]。日本对虾内肠HIF-1α 和HIF-1β 的基因表达量在低氧24 h 也都显著增加[79]。Cota-Ruiz[77]等发现,低氧胁迫3 h 凡纳滨对虾肝胰腺中HIF-1α 的转录水平是低氧胁迫48 h 的6.4 倍,表明短期缺氧会导致HIF-1α 的转录水平显著增加,而在长期低氧下,HIF-1α 转录水平则倾向于减少。
6.2 线粒体基因
线粒体是动物进行有氧呼吸代谢的重要细胞器,受胞内氧浓度的影响线粒体相关基因的表达。研究表明,在中度低氧(2.5 mg/L)下短刀小长臂虾线粒体基因的表达不受影响,严重缺氧环境(1.5 mg/L)下发生显著改变,编码Ccox1、16S rRNA、血红素结合蛋白和铁蛋白的基因在暴露7 d 后显著上调;14 d 后表达模式发生逆转,Ccox1、Ccox3、cytb、16S rRNA、血红素结合蛋白和铁蛋白基因表达显著下调[78]。Romero 等[79]研究发现:凡纳滨对虾线粒体解耦联蛋白活性在缺氧和复氧过程中被激活,控制虾体内活性氧的产生和氧化损伤。
机体生命活动所需要的能量是线粒体通过ATP 酶合成产生,低氧环境下线粒体不能正常为细胞的生命活动提供能量,各器官不能发挥正常功能。无脊椎动物中,ATP 浓度可能会根据物种对环境氧浓度的变化作出适度或剧烈下降[80]。但研究发现,凡纳滨对虾[81]低氧时肌肉中ATP 的含量没有发生改变,复氧过程中,ATP 浓度较常氧和低氧时下降;表明凡纳滨对虾肌肉在低氧下能够保持足够的ATP 浓度,这可能是由使用其他能量源来实现的。
6.3 其他低氧相关基因
除了上述相关基因外,还有一些基因参与调控虾类适应低氧环境。进化上高度保守的热休克蛋白(HSP)是具有分子伴侣、抗氧化、协同免疫和抗细胞调亡作用的蛋白分子家族[82]。生物可通过提高热休克蛋白的表达量使机体适应环境变化。Li 等[83]研究发现,中国对虾热休克蛋白90(HSP90)对低氧非常敏感,低氧2 h 其血细胞和鳃中HSP90 的转录水平升高,低氧8 h 时,其转录水平被抑制;在经历5 d的低氧复氧变化后,150 h 低氧下血细胞和鳃中的转录水平均处于上调状态。虾的HSP90 转录水平因低氧而发生改变,在虾类应对环境协迫时发挥着重要作用。
P53 在低氧下也被激活,主要参与细胞周期调控、诱导凋亡、抑制肿瘤、调节代谢途径、细胞衰老和DNA 修复等。p53 的表达和反应在很大程度上取决于细胞类型。凡纳滨对虾低氧48 h 血细胞P53 转录水平显著降低[84],这与日本沼虾[85]肝胰腺相反。miRNA 是一组约长22 个核苷酸的非编码RNA,可以导致靶mRNA 的降解和翻译停滞[86]。有研究表明:其在生物体适应环境压力中发挥重要作用。低氧下凡纳滨对虾[86]大部分miRNA 的表达水平处于上调水平,日本沼虾[87]低氧下miRNA 的表达水平也有上调和下调的变化。
7 总结与展望
综上所述,水体DO 量下降影响对虾类的多方面,如引起虾类的行为、生长、生理生化、组织结构和基因方面的变化。低氧环境下,虾类通过调节心率、呼吸代谢方式、血蓝的蛋白含量、免疫能力、抗氧化能力以及渗透能力等来抵抗低氧。近些年来,低氧对虾类影响的研究越来越多,且已深入到细胞水平和分子水平,旨在揭示低氧对虾类的影响和虾类是如何通过自身的调节来抵抗并适应低氧环境,以期为防控因天气、温度以及其他生态环境因素造成的水体DO 下降而导致的虾类死亡提供资料。随着分子技术手段的进步,低氧对虾类影响的研究将进一步推进,相关机制也会被逐步解开。
自然环境条件下,水体DO 量逐步降低,低氧环境也是逐步形成。目前,已有的研究主要是将虾类直接从常氧水体转移至低氧水体中研究低氧胁迫。这种低氧处理方式可能不能够很好地反应在实际养殖生产中低氧环境的形成,因此,未来研究应更多地结合生产实际,通过模拟自然环境下水体低氧的形成来研究低氧对虾类的影响。

