木薯护色及贮藏性研究
黄和升,王海平,2
(1.江苏食品药品职业技术学院,江苏 淮安 223005;2.江苏食品加工工程技术研究开发中心,江苏 淮安 223005)
鲜切果蔬在切分过程中,汁液外渗、微生物污染、贮藏条件不当等均会引起果蔬品质劣变,尤其叶片的黄化、褐变会缩短果蔬的货架期,降低果蔬商品价值[7-12].同时,果蔬的色泽是决定消费者购买的主要因素之一[9],为延缓鲜切果蔬的腐败和色变,国内外常将鲜切果蔬在贮藏前进行护色处理,常用的护色剂为亚硫酸氢钠、亚硫酸钾等含硫护色剂[10-16].但有研究表明,含硫护色剂处理的果蔬,残留的二氧化硫会危害人体健康[12-13].本研究采用无硫复合护色剂处理鲜切木薯,试验不同的护色剂含量、温度、时间对木薯的护色作用,同时测定处理木薯贮藏过程中相关酶活性变化和质量损失率变化,以期得到一种木薯护色的环保健康方法,提高鲜切木薯商业价值.
1 材料和方法
1.1 材料与试剂
木薯购自于淮安市城南农贸市场,L-半胱氨酸(L-Cys)、柠檬酸和维生素C(VC)均为食品级分析纯.
1.2 仪器与设备
SC-80C全自动色差仪,北京京仪康光光学仪器有限公司;752紫外分光光度计,上海第三分析仪器厂;TD5Z台式低速离心机,盐城市凯特实验仪器有限公司;HH-M6六孔恒温水浴锅,江苏新春兰科学仪器有限公司.
1.3 试验方法
1.3.1 生产工艺 材料处理(去除病虫害和腐烂的木薯)→清洗(约30 ℃温水清洗2遍)→去皮、切块(约1.5 cm厚度)→护色(浸泡于护色液)→去除水分→贮藏→品质测定.
1.3.2 操作要点 挑选无病虫害的新鲜木薯用温水清洗2遍、去皮并切片(约1.5 cm厚),投入护色液中,常温浸泡10~25 min,取出后立即放入清水漂洗并沥干水分,放于保鲜盒冷藏,定期测定鲜切木薯色值(L*值)、酶活性(PPO、POD、PAL)和质量损失率.
1.3.3 试验设计 参考荸荠、姜脯护色方法[10,12],在L-Cys用量为0.6%,柠檬酸用量为0.6%,VC用量为0.6%,护色时间为20 min和护色温度为20 ℃的基础条件下,保持其他因素不变,只改变其中一个因素,设置L-Cys用量分别为0.2%、0.4%、0.6%、0.8%、1.0%、1.2%、1.4%,柠檬酸用量为0.3%、0.4%、0.5%、0.6%、0.7%、0.8%、0.9%,VC用量为0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%,护色温度为5、10、15、20、25、30、35 ℃,护色时间为5、10、15、20、25、30、35 min,护色后,贮藏于0~4 ℃冰箱,贮藏10 d,测定L*值,每组试验重复3次进行单因素试验.在单因素试验基础上进行L9(34)正交试验.
1.3.4 测定指标
分别统计两版教材“平方根”“无理数的引入”两块内容中的例习题数量,我们发现:美GMH版的例习题数量远多于浙教版,大约是浙教版的1.5倍.而且美GMH版在每一道例题后都会相应安排同一类型的习题,方便学生及时巩固.
1.3.4.1L*值测定 采用全自动色差仪测定木薯切面处的颜色,颜色变化通过测定L*、a*、b*值表示.其中L*代表木薯表面的白度,L*值(白度)越大,表示越白;a*(红度)、b*(黄度)越大,表示组织越灰暗.经过多次重复预试验测得a*值为负值,b*值也偏小,切面呈现白色,因而可将测定L*值作为鲜切木薯的色泽变化指标.
1.3.4.2 质量损失率测定 采用差量法测定.

1.3.4.3 酶活性测定[14]多酚氧化酶(PPO)和过氧化物酶(POD)酶液提取:取测定样2.0 g,加入pH 6.4的磷酸缓冲液5.0 mL,置于冰浴研磨,然后置于离心机,以10 000 r/min离心20 min,取上清液置于冰箱待测定.
苯丙氨酸解氨酶(PAL)酶液提取:取测定样3.0 g,加入pH 8.7的硼酸-硼砂缓冲液6.0 mL.置于冰浴研磨,然后置于离心机,以10 000 r/min离心20 min,取上清液置于冰箱待测定.
PPO活性测定: 采用消光值法;POD活性测定: 采用愈创木酚氧化法;PAL活性测定:取5支试管进行编号, 0号管调0,1号管作为对照,2、3、4号管为测定管,按表1加入硼酸缓冲液、酶液和苯丙氨酸溶液.摇匀后置于40 ℃恒温水浴锅,保温60 min,立即加入2 mol/L HCL 0.2 mL以终止反应,在波长为290 nm的条件下测定吸光度值(1 h内吸光度值增加0.001为一个酶活力单位).

表1 PAL活性测定溶液组成
1.4 数据处理
采用Microsoft Excel 2003进行数据统计和计算,采用SPSS 16.0软件对试验数据进行显著性检验.
2 结果与分析
2.1 鲜切木薯护色单因素试验结果
2.1.1L-Cys含量对鲜切木薯护色效果的影响L-Cys可抑制褐变,常用作果蔬护色剂[12].由图1可知,试验范围内,随着L-Cys含量的增大,鲜切木薯L*值增大,表明护色效果显著增强(P<0.05),当L-Cys含量超过0.8%时,L*值变化不显著,考虑试剂节约和木薯的口感,选用0.8%左右的L-Cys溶液对鲜切木薯进行护色处理.

不同小写字母表示差异显著(P<0.05). Different lowercase letters indicate significant differences(P<0.05).图1 不同L-Cys含量对鲜切木薯L*值的影响Figure 1 Effects of different L-Cys content on L*value of fresh-cut cassava
2.1.2 柠檬酸含量对鲜切木薯护色效果的影响 柠檬酸可降低多酚氧化酶活性,也可降低溶液pH值和氧的溶解度,因而柠檬酸溶液可用于果蔬护色处理[15].由图2可知,柠檬酸含量逐渐增加,鲜切木薯L*值逐渐增大,表明护色效果显著增强,当柠檬酸含量超过0.6%时,L*值稍有减小,可能是柠檬酸含量过高使溶液pH值过低,护色作用随之有所减弱,因而选用0.6%左右的柠檬酸溶液对鲜切木薯进行护色处理.

图2 不同柠檬酸含量对鲜切木薯L*值的影响Figure 2 Effects of different citric acid content on L*value of fresh-cut cassava
2.1.3 VC含量对鲜切木薯护色效果的影响 VC具有很强的还原能力,同时可降低体系pH值,常用于果蔬的护色处理[16-17].由图3可知,当VC含量增大时,鲜切木薯L*值也随着增大,表明护色效果增强,当VC含量超过0.5%时,L*值变化不显著,从节约成本考虑,选用0.5%左右的VC溶液对鲜切木薯进行护色处理.

图3 不同VC含量对鲜切木薯L*值的影响Figure 3 Effects of different VC content on L* value of fresh-cut cassava
2.1.4 护色时间对鲜切木薯护色效果的影响 由图4可知,柠檬酸、L-半胱氨酸、VC对木薯护色作用表现相似的趋势,护色时间延长,L*值增大,护色效果显著增强,但护色超过20 min,变化不显著,因而护色时间选用20 min.
2.1.5 护色温度对鲜切木薯护色效果的影响 由图5可知,柠檬酸、L-Cys、VC对木薯护色作用均随护色温度升高,L*值增大,护色效果显著增强,但超过20 ℃,变化不显著,从能耗及护色效果综合考虑,护色温度选择常温(20~30 ℃).

图4 不同护色时间对鲜切木薯L*值的影响Figure 4 Effects of different color protection time on L* value of fresh-cut cassava

图5 不同护色温度对鲜切木薯L*的影响Figure 5 Effect of different color protection temperature on L* value of fresh-cut cassava
2.2 木薯护色条件优化
为获得木薯常温最优护色条件,在单因素试验的基础上,以鲜切木薯的L*值为考察指标,以L-Cys含量、柠檬酸含量、VC含量,护色时间为变量进行正交试验.试验方案及结果如表2所示.

表2 正交试验方案及结果
由表2可知,4个变量对鲜切木薯L*值影响的主次顺序依次为D、A、C、B.鲜切木薯最佳护色条件为A1B2C2D1,即L-Cys 0.8%、柠檬酸 0.6%、VC 0.5%、护色时间15 min.在最佳护色条件下重复试验3次,测得鲜切木薯L*值平均值为75.75.
2.3 护色处理对鲜切木薯贮藏品质的影响
2.3.1 鲜切木薯酶活性变化 切割果蔬的褐变主要为酶促褐变,多与PPO、POD和PAL等酶活性变化相关[14,18-21].本研究为明确护色处理与酶活性的关系,测定了复合护色处理和对照组(未护色处理)鲜切木薯的PAL、PPO和POD的活性,结果如图6~8所示.
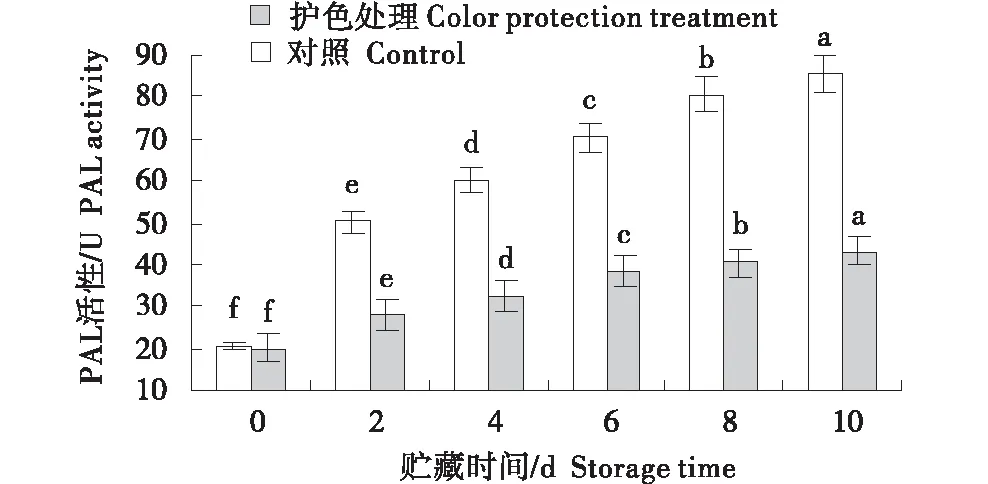
图6 鲜切木薯贮藏期PAL活性变化Figure 6 Changes of PAL activity of fresh-cut cassava during storage
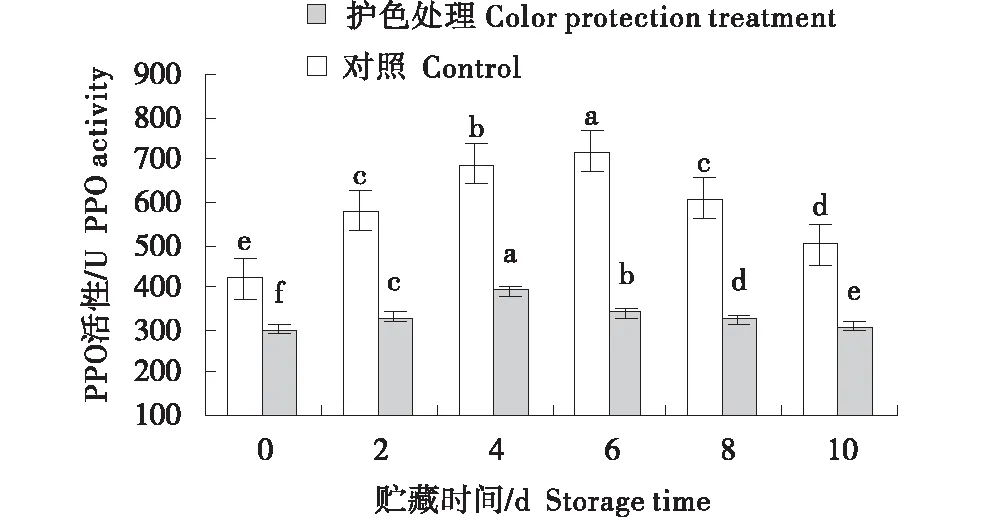
图7 鲜切木薯贮藏期PPO活性变化Figure 7 Changes of PPO activity of fresh-cut cassava during storage

图8 鲜切木薯贮藏期POD活性变化Figure 8 Changes of POD activity of fresh-cut cassava during storage
由图6~8可知,对照组木薯的PAL活性上升速度要高于护色处理组,到贮藏第10 天时,对照组的PAL活性约为护色处理的2倍;在贮藏第6天,对照组PPO活性达到最高,然后开始下降,护色组木薯整个贮藏过程PPO活性总体变化较对照组平缓,并且始终低于对照;在贮藏前6天,对照组和护色处理木薯POD活性变化均缓慢,然后对照组POD活性迅速上升,护色处理组木薯POD活性保持缓慢增加,到第10天,对照组木薯的POD活性为护色处理的3倍多.总体而言,整个贮藏期内,护色处理组鲜切木薯PAL、PPO和POD活性均低于同期的对照组,说明护色处理可降低鲜切木薯的 PAL、PPO和POD的活性,延缓木薯生理生化反应进程.
2.3.2 鲜切木薯质量损失率变化 切分处理会加速鲜切木薯的失水和生理生化变化,降低其食用品质和感官品质,质量损失率可反应这一变化情况.本研究测定了冷藏条件下护色处理组和对照组鲜切木薯的质量损失率,结果如图9所示.
由图9可知,在贮藏期内,对照组和护色处理的鲜切木薯的质量损失率变化趋势基本一致,前4 d,质量损失率呈直线式上升,变化趋势非常显著,后6 d,鲜切木薯的质量损失率仍然处于上升趋势,但护色处理组上升趋势有所缓和,整个贮藏期内,护色处理的质量损失率始终低于对照组,说明护色处理可以降低鲜切木薯的质量损失率,有效维持鲜切木薯的品质.

图9 鲜切木薯贮藏期失重率变化Figure 9 Changes of weight loss rate of fresh-cut cassava during storage
3 讨论
新鲜果蔬经切分后极易造成变色,严重影响产品感官品质,因此,对鲜切果蔬的护色及褐变指标的测定显得尤为重要.本研究采用国外较常采用的色差法,处理简单、操作方便、 系统误差小,是一种无损检测方法,结果可直接反映鲜切木薯的颜色变化.传统的果蔬生产中,主要采用熏硫或浸硫来达到护色的目的,摄入少量二氧化硫不会对健康造成伤害,但食用含二氧化硫超标的食物会引起过敏反应[10-11],本研究采用无二氧化硫残留的复合护色剂处理鲜切木薯.有研究表明,柠檬酸可通过降低pH值并在酶活性位点结合铜,而对PPO有双重抑制作用;VC能还原酮类物质为酚类化合物防止酶促褐变;L-Cys能将邻琨类化合物还原为多酚类化合物前体抑制褐变[15-16].本研究试验表明,L-Cys、柠檬酸、VC处理鲜切木薯均可起到护色作用,这与前人的研究结果一致.
褐变有酶促褐变和非酶促褐变,而果蔬的褐变主要是酶促褐变.其中PPO、POD 和PAL是影响果实褐变的关键酶[19-21].在正常的细胞内,PPO可与氧同时存在不发生褐变,果蔬切割过程使果蔬的细胞质膜遭到破坏,环境中氧的进入,酶与PPO接触, 使酚类物质发生氧化反应,最后形成黑褐色物质.POD 属于保护酶,它可以清除自由基、活性氧,防止其对细胞膜的攻击,但在H2O2存在时POD可迅速氧化多酚类物质,加速果蔬褐变.PAL可参与苯丙氨酸代谢生成羧酸,再经过一系列转变形成酶促反应底物酚,加速褐变[14,18].果蔬经机械切割后,酶和底物的部分结构被破坏,加速了酚类物质与酶的接触反应,致使PPO、POD 和 PAL 活性升高,促进反应底物酚类物质氧化,表现为果肉褐变程度加深,严重影响其感官质量及营养价值.本研究中,护色处理的鲜切木薯在0~4 ℃贮藏期间,与未护色的鲜切木薯比较,复合护色处理的鲜切木薯, 褐变减弱,PAL、PPO和POD活性降低,因此,推断木薯的褐变同其他果蔬类似也主要与酶类物质参与代谢活动有关,关于鲜切木薯褐变机理有待后续试验进一步研究.本研究仅对护色木薯贮藏中的几种酶活性变化进行了分析.今后可以对切分木薯酶活性变化过程中酚类物质组成和含量进行测定与分析,深入探讨酚类物质变化对色泽改变的影响,确定影响木薯褐变的关键因素及褐变的适宜抑制措施.
果蔬质量损失率可衡量果蔬的新鲜度,当质量损失率达4%~6%时,果蔬表皮起皱,表面失去光泽,同时产生一系列的不良生理生化反应,致使果蔬质量下降,食用价值和商品价值降低.果蔬切割处理会使其受到机械损伤,氧气进入会加速其呼吸作用和蒸腾作用,因而质量损失率会越来越高.有研究发现,贮藏过程中经复合护色液处理的荸荠质量损失率会降低[17],VC处理的莲藕质量损失率降低[21].本研究中,复合护色处理的鲜切木薯的质量损失率始终显著低于对照,说明护色处理液能够抑制鲜切木薯的生理生化反应的进程,减少各种营养物质的消耗,降低鲜切木薯的质量损失率.也有研究表明,降低酶活性,可降低果蔬的失重率[14,20],结合本研究中护色处理的木薯酶活性降低,可推断护色处理的鲜切木薯与对照组相比质量损失率降低,可能也与其酶活性降低,代谢减慢有关,后续可对切分木薯酶活性与具体的固形物进行测定与分析,以明确木薯酶活性对木薯质量损失率的影响.
4 结论
鲜切木薯常温复合护色最优条件为L-Cys含量 0.8%、柠檬酸含量0.6%、VC含量0.5%、复合护色15 min,该条件下测得鲜切木薯的L*值为75.75,效果较好.果蔬的护色剂,护色方法有多种[5-14],这些方法是否适用于鲜切木薯,还有待进一步研究.护色处理可降低鲜切木薯PPO、POD和PAL活性,延缓木薯的生理生化反应进程,减少木薯贮藏期的质量损失,鲜切木薯褐变机理仍待研究.

