中国结直肠肿瘤综合预防共识意见(2021年,上海)*
中华医学会消化病学分会 中华医学会消化病学分会消化系统肿瘤协作组
结直肠肿瘤即大肠肿瘤,主要系指结直肠癌(colorectal cancer)和结直肠腺瘤(colorectal adenoma)。结直肠癌从发生学角度大致分为家族遗传性和散发性。无论是遗传性(约5%)还是散发性结直肠癌,环境因素均是影响其发生和进展的重要因素。散发性结直肠癌发生的途径可分为腺瘤-腺癌途径(含锯齿状腺瘤等引起的锯齿状途径,serrated neoplasia pathway)、炎-癌途径和denovo(从无到有)途径。近年对锯齿状途径的临床研究成为热点,锯齿状病变包括广基无蒂锯齿状腺瘤/息肉(sessile serrated adenoma/polyp)、传统锯齿状腺瘤(traditional serrated adenoma)、大部分增生性息肉(hyperplastic polyp)、增生性息肉病(hyperplastic polyposis)等。锯齿状腺瘤与传统腺瘤(conventional adenoma,包括管状腺瘤、绒毛状腺瘤和混合性腺瘤)共同组成广义的腺瘤。
结直肠腺瘤(占全部结直肠癌癌前疾病的85%~90%甚至更高)和溃疡性结肠炎(ulcerative colitis, UC)等炎症性肠病(inflammatory bowel disease, IBD)是结直肠癌的主要癌前疾病。多数结直肠癌患者确诊时已属中晚期,治疗效果不佳,故结直肠癌的早期发现和及早预防至关重要。结直肠癌的管理应采取全程链条式管理。与其他肿瘤一样,结直肠癌也有三级预防:一级预防是病因预防,主要是针对腺瘤或炎症的治疗,阻断其发展为癌;二级预防是早诊断、早治疗,即早期发现结直肠癌并及时干预处理,以免进入进展期(中晚期);三级预防属于广义的预防范畴,主要是对于进展期结直肠癌,通过外科手术并在术后进行辅助化疗、放疗或靶向治疗、免疫治疗等以预防肿瘤再发或转移。
70%的散发性结直肠癌与生活习惯有关[1],且66%~78%的结直肠癌可通过健康的生活习惯加以预防[2]。内镜下摘除腺瘤可预防75%的结直肠癌[3],但摘除后的再发(或称复发,包括原处复发和他处再发即异时性腺瘤)率高[4-6],仍需予化学药物预防。通过改善饮食习惯、结构和生活方式以及应用药物预防腺瘤的初次发生或摘除后再发、预防IBD癌变、预防结直肠癌复发/转移均属于广义的针对结直肠癌的化学预防。上述广义化学预防以及内镜下早诊断、早治疗均属于本共识意见的内容范畴。本共识意见参考中华医学会消化内镜学分会消化系早癌内镜诊断与治疗协作组、中华医学会消化病学分会消化系统肿瘤协作组、中华医学会消化内镜学分会肠道学组和中华医学会消化病学分会消化病理协作组于2014年联合颁布的《中国早期结直肠癌及癌前病变筛查与诊治共识意见(2014年11月·重庆)》[7]、国家癌症中心制定的《中国结直肠癌筛查与早诊早治指南(2020,北京)》[8]和《中国转移性结直肠癌患者二线治疗的系统性回顾及专家共识》[9],在中华医学会消化病学分会《中国结直肠癌预防共识意见(2016年,上海)》[10]的基础上,综合近5年国际和国内相关研究的新进展而形成。由中华医学会消化病学分会及其消化系统肿瘤协作组主办、上海交通大学医学院附属仁济医院消化内科暨上海市消化疾病研究所承办共识意见研讨会,讨论并形成《中国结直肠肿瘤综合预防共识意见(2021年,上海)》。
本共识意见包含60项陈述条款,由中华医学会消化病学分会消化系统肿瘤协作组主要专家撰写草案;会前由来自全国各地的消化病学专家对共识意见草案进行反复讨论和修改,会议期间听取撰写小组专家针对每项陈述的说明,在充分讨论后以无记名投票形式通过本共识意见。陈述的循证医学等级、表决等级标准和依据见表1[11-12]。每项陈述的投票意见为A或B者超过80%视为通过;相反则全体成员再次讨论,第二次投票如仍未达到前述通过标准,则当场修改后进行第3次投票,确定接受或放弃该陈述。

表1 循证医学等级和表决等级标准
一、筛查高危人群
结直肠癌筛查可降低结直肠癌发病率和死亡率[13],有效识别结直肠癌高危人群对于提高人群筛查效果和效率具有重要意义。高危人群分为散发性结直肠癌高危人群和遗传性结直肠癌高危人群两类[14]。
【陈述1】散发性结直肠癌高危人群应综合年龄、性别、体质指数、结直肠癌家族史、吸烟和饮酒史等因素,并结合粪便隐血试验判定。
证据等级:Ⅱb;推荐等级:A;陈述同意率:96.3%
目前尚无单一指标区分结直肠癌风险等级,建议从40岁起接受结直肠癌风险评估,如评估结果为高危人群,建议从40岁起接受结直肠癌筛查。不具备以下危险因素者定义为“一般风险人群”[15]:①一级亲属有结直肠癌病史,包括非遗传性结直肠癌家族史和遗传性结直肠癌家族史;②本人有结直肠癌病史;③本人有肠道腺瘤病史;④本人患长期(8~10年)不愈的IBD;⑤本人粪便隐血试验(fecal occult blood test, FOBT)阳性。一级亲属有结直肠癌病史与更高的患癌风险相关[16]。Fuchs等[17]的研究显示,有结直肠癌家族史的40岁人群与无结直肠癌家族史的50岁人群的结直肠癌累积发病率相似。一项成本-效益分析显示,一级亲属患结直肠癌对个体患癌风险的影响随个体年龄增长而下降,30~44岁年龄段的患癌风险增加5倍,至≥70岁年龄段患癌风险不再增加[18]。建议一级亲属患结直肠癌的人群从40岁起进行结直肠癌筛查。国内外学者开发了多个基于个体发病风险的模型,主要基于年龄、性别、体质指数(BMI)、结直肠癌家族史、吸烟和饮酒史等临床因素划分风险等级,但各模型效能均有限,ROC曲线下面积(AUC)为0.61~0.70[19]。Park等[20]对基于可定量的粪便免疫化学试验(fecal immuno-chemical test, FIT)的风险分层模型的研究显示,结合FIT可提高模型效能。此外,个体化的风险分层可提高人群筛查的参与率[21]。目前仍缺乏结直肠癌风险评估模型的大样本前瞻性研究证据。通常建议IBD患者在诊断后8~10年开始行结肠镜筛查,合并硬化性胆管炎的患者应每年复查结肠镜,不合并硬化性胆管炎者可每1~3年检查1次。
【陈述2】遗传性结直肠癌高危人群包括林奇综合征、腺瘤性息肉综合征(包括家族性腺瘤性息肉病、MUTYH相关息肉病)、Peutz-Jeghers综合征、幼年性息肉病综合征、锯齿状息肉病综合征等。
证据等级:Ⅲ;推荐等级:A;陈述同意率:95.0%
林奇综合征(Lynch syndrome)患者中MLH1或MSH2基因突变携带者从20~25岁开始行结肠镜检查,MSH6或PMS2基因突变携带者从35岁开始行结肠镜检查,可每1~2年进行1次结肠镜筛查[22]。经典型家族性腺瘤性息肉病(familial adenomatous polyposis, FAP)家系中的高危人群从10岁开始接受结肠镜筛查,每1~2年检查1次。衰减型FAP家系的高危人群从18岁开始接受结肠镜筛查,每2年检查1次[23]。MUTYH相关息肉病(MUTYH-associated poly-posis)患者应密切随访结肠镜,从18~20岁开始,每1~2年进行1次结肠镜检查[24]。目前我国Peutz-Jeghers综合征[Peutz-Jeghers syndrome,又称黑斑息肉综合征或家族性黏膜皮肤色素沉着胃肠道息肉病(familial mucocutaneous pigmentation gastrointestinal polyposis)]、幼年性息肉病综合征(juvenile polyposis syndrome)和锯齿状息肉病综合征(serrated polyposis syndrome)的研究证据十分有限,多基于小样本单中心研究。根据国内外相关指南,Peutz-Jeghers 综合征推荐开始筛查的年龄为18岁,幼年性息肉病综合征为15岁,锯齿状息肉病综合征为40岁或45岁。遗传性结直肠肿瘤的预防见本共识意见其他章节。
【陈述3】结直肠癌筛查工具包括FIT、结肠镜、乙状结肠镜、结肠胶囊内镜、结肠影像学技术、粪便DNA检测等。
证据等级:Ⅲ;推荐等级:A;陈述同意率:92.6%
推荐结肠镜和FIT作为结直肠癌最主要的筛查手段[25]。目前结直肠癌的筛查有多种筛查工具和策略,可归纳为“一步法”和“两步法”。“一步法”指直接使用结肠镜进行筛查,诊断和治疗同步进行,筛查周期长,高质量的结肠镜检查是结直肠癌筛查的金标准[26]。“两步法”的目的在于减少侵入性结肠镜检查,先应用低侵入性的筛查工具,结果为阳性者需序贯结肠镜检查以明确诊断。如不愿行结肠镜检查和FIT,可考虑使用乙状结肠镜、CT结肠成像(CT colono-graphy, CTC)、结肠胶囊内镜、粪便多靶点DNA检测进行初筛。
根据2010年全国第六次人口普查数据,我国50~75岁年龄段人群已超过2.5亿人,而2012年我国仅完成583万人次的结肠镜检查[27],难以满足结直肠癌筛查的需求。“一步法”结肠镜筛查不适合我国国情,基于FIT-结肠镜检查的序贯筛查模式更为经济、有效[28]。考虑到现阶段我国人群筛查的依从性较低,推荐采用以医院为基础的机会性筛查与人群筛查相结合的筛查模式[29]。
【陈述4】结肠镜检查是结直肠癌筛查的重要手段。
证据等级:Ⅰ;推荐等级:A;陈述同意率:96.3%
结肠镜检查是诊断早期结直肠癌和癌前病变的重要手段,可使结直肠癌的发病率降低76%~90%,死亡率降低53%[3,30]。尽管结肠镜检查是结直肠癌筛查的金标准,但并不能完全预防间期结直肠癌(筛查后未发现而在下一次筛查前发现的结直肠癌)发生,其中最重要的原因是结直肠病变的漏诊。由于结肠镜检查具有侵入性且需行充分的肠道准备,国人对人群组织性筛查的参与率依然较低[31]。建议每5~10年进行1次高质量结肠镜检查[32]。
【陈述5】FIT适用于结直肠癌筛查,敏感性较高。
证据等级:Ⅱb;推荐等级:A;陈述同意率:90.1%
FOBT是简便易行的结直肠癌初筛方法[33]。传统的愈创木脂FOBT(guaiac-based FOBT, gFOBT)结果受饮食和药物影响,且敏感性低。FIT系应用免疫化学法检测粪便标本中的血红蛋白,推荐每年至少进行1次FIT筛查。目前在人群结直肠癌筛查中,FIT已基本取代gFOBT成为主要的粪便隐血检测技术。近期一项纳入31项研究的meta分析显示,FIT的粪便血红蛋白阈值设定为10 μg/g时,诊断结直肠癌的敏感性为91%,特异性为90%;诊断进展期腺瘤(具有以下1项或多项特征:长径≥10 mm,组织学绒毛状成分≥25%,高级别上皮内瘤变)的敏感性和特异性分别为40%和90%[34]。多数国内外相关指南推荐每年进行1次FIT筛查。成本-效益模型研究[35]显示,每年行FIT筛查与每10年进行1次结肠镜筛查可获得的生存年相当。我国单轮次FIT筛查参与率较高,长期重复筛查的参与率缺乏证据,需有组织地开展筛查项目以提高人群长期重复筛查的参与率[36]。FIT阳性者需及时进行结肠镜检查[37]。
【陈述6】乙状结肠镜、结肠胶囊内镜、结肠影像学技术、粪便DNA突变检测和粪便DNA甲基化检测是结直肠癌筛查的有效补充手段。
证据等级:Ⅲ;推荐等级:B;陈述同意率:88.9%
乙状结肠镜可检查左半结肠,对肠道准备要求较低,在欧美国家应用较多,在我国应用较少。一项纳入4项随机对照试验的meta分析表明,乙状结肠镜检查可降低31%的远端结直肠癌发病率和46%的远端结直肠癌死亡率[38]。然而,乙状结肠镜检查有阳性发现者仍需进一步行结肠镜检查,且有研究报道乙状结肠镜检查不能降低女性结直肠癌的发病率和死亡率[39-40]。由于乙状结肠镜检查有一定的侵入性且不能完整检查全结肠,其在筛查中的应用受到限制。推荐每3~5年进行1次乙状结肠镜检查。
CTC为拒绝行结肠镜检查和FIT的人群提供了一种筛查选择。2项分别纳入2 600例和1 233例无症状受检者的研究显示,CTC对结直肠癌的检出率与结肠镜检查基本相同[41-42]。一项纳入49项研究的系统综述和meta分析显示,以结肠镜检查为金标准,CTC诊断结直肠癌的敏感性为96.1%[43]。然而,CTC诊断高危无蒂锯齿状息肉的准确性低于结肠镜检查(0.8%对4.3%)[44]。推荐每5年进行一次CTC。
结肠胶囊内镜检查的结直肠癌检出率较高(64%~100%),但检查完成率较低(57%~92%)[45]。该项检查需要更高质量的肠道准备,有一定的胶囊滞留率且无法进行活检,能否用于结直肠癌筛查有待进一步验证。目前结肠胶囊内镜的使用在我国仍处于研究阶段。
多靶点粪便DNA检测是粪便脱落细胞DNA突变的检测方法。一项在美国和加拿大开展的纳入9 989例受试者的研究[46]显示,该方法诊断结直肠癌和进展期腺瘤的敏感性分别为92.3%和42.4%,均显著高于FIT(分别为73.8%和23.8%),但其用于结直肠癌和进展期腺瘤大规模人群筛查的效果尚需进一步验证。由于检测成本较高,目前仅推荐用于特定的目标人群筛查。推荐每3年进行1次检测。
我国关于粪便SFRP2和SDC2双基因甲基化检测的研究[47]显示该方法对结直肠癌筛查有一定应用价值。
二、结直肠癌的一级预防
1. 散发性结直肠腺瘤的一级预防
【陈述7】调整饮食习惯和生活方式是预防结直肠癌的基础,包括高膳食纤维饮食、减少红肉(牛肉、羊肉、猪肉等哺乳动物的肌肉组织)和加工肉类制品(腌制、熏烤、煎炸等肉类食品)的摄入以及合理的体育锻炼,避免肥胖、长期吸烟和长期大量饮酒。
证据等级:Ⅱ;推荐等级:B;陈述同意率:91.3%
饮食和生活方式是影响结直肠癌的重要因素。一项纳入20项研究、共10 948例结直肠腺瘤患者的meta分析显示,高膳食纤维摄入与结直肠腺瘤的发生风险呈负相关(RR=0.72, 95% CI: 0.63~0.83)[48]。2003年欧洲癌症和营养前瞻性调查(European Prospective Investigation into Cancer and Nutrition, EPIC)的队列研究[49]证实,与膳食纤维摄入量最低组相比,膳食纤维摄入量最高组结直肠癌风险显著降低(RR=0.58, 95% CI: 0.41~0.85)。2012年再次综合EPIC数据的研究[50]得出类似结论。
全谷物饮食是膳食纤维的来源,且富含维生素E、硒、铜、锌、木脂素、植物雌激素、酚类化合物等具有抗肿瘤作用的生物活性物质。一项纳入6项研究、共7 941例结直肠癌患者的meta分析显示,每天摄入全谷物90 g可减少17%的结直肠癌风险(RR=0.83, 95% CI: 0.78~0.89)[51]。
队列研究和病例对照研究大多支持红肉和加工肉类制品的摄入量与高结直肠癌风险相关[52-54]。一项meta分析显示,红肉摄入量最高组的结直肠癌风险是红肉摄入量最低组的1.28倍(95% CI: 1.15~1.42),加工肉类制品摄入量最高组的结直肠癌风险是加工肉类制品摄入量最低组的1.2倍(95% CI: 1.11~1.31)[52]。因此,世界癌症研究基金会和美国国家癌症研究所建议红肉摄入量<500 g/周,加工肉类制品摄入量<50 g/d。
吸烟是结直肠癌的重要危险因素,且癌症发生与吸烟年限和总量有一定的剂量-效应关系。一项meta分析显示,与从不吸烟者相比,有吸烟史者患结直肠癌的RR值为1.18(95% CI: 1.11~1.25)[55]。吸烟约可增加20%的结直肠癌风险[56]。2020年一项纳入188项研究的meta分析亦发现,与从不吸烟者相比,尚在吸烟者患结直肠癌的RR值为1.14(95% CI: 1.10~1.18),曾吸烟者的RR值为1.17(95% CI: 1.15~1.20);与尚在吸烟者相比,戒烟超过25年的曾吸烟者结直肠癌风险显著降低[57]。美国一项队列研究[58]发现,与从不吸烟者相比,尚在吸烟者高危结直肠腺瘤或有临床意义锯齿状息肉的风险增加约3倍,同时发生高危腺瘤与有临床意义锯齿状息肉的风险增加8倍(OR=8.66, 95% CI: 4.73~15.86)。一项meta分析亦提示吸烟与锯齿状息肉的发生风险呈正相关[59]。
Huxley等[56]对103项队列研究数据的回顾性分析显示,酒精摄入量最高组结直肠癌风险较对照组(未摄入或少量摄入酒精)升高近60%(RR=1.56, 95% CI: 1.42~1.70)。Bagnardi 等[60]对1966—2000年间发表的部分流行病学文献的分析发现,与对照组相比,饮酒人群的结直肠癌风险随饮酒量增加而上升(25 g/d: RR=1.08, 95% CI: 1.06~1.10; 50 g/d: RR=1.18, 95% CI: 1.14~1.22; 100 g/d: RR=1.38, 95% CI: 1.29~1.49)。饮酒量与结直肠癌风险之间呈正线性剂量-效应关系[61]。与不饮酒/偶尔饮酒(≤1 g/d)相比,大量饮酒(>42 g/d)与结直肠癌风险增加显著相关(OR=1.25, 95% CI: 1.11~1.40)[62]。
肥胖是结直肠癌,尤其是结肠癌发病的高危因素。对2014年之前发表的50项前瞻性观察性研究的分析发现,成人体质量每增加5 kg可导致包括结直肠癌在内的多种恶性肿瘤发生风险增加[63]。EPIC研究[64]发现,20~50岁年龄组成人体质量每增加1 kg/年,结肠癌风险升高60%。此外,一项meta分析表明,BMI每增加5 kg/m2,结直肠腺瘤风险升高约20%[65]。在一项有85 256名女性注册护士参与的前瞻性队列研究[66]中,与BMI为18.5~22.9 kg/m2的女性相比,肥胖(BMI≥30.0 kg/m2)女性罹患早发结直肠癌的RR值为1.93(95% CI: 1.15~3.25),提示肥胖与女性早发结直肠癌风险增加有关。
合理的体育锻炼可在一定程度上降低结直肠癌风险。EPIC等研究已明确提示体育活动可显著降低结肠癌风险[67-68]。日本一项基于流行病学证据的系统综述则表明体育活动可能降低结直肠癌风险[69]。一项纳入19项队列研究的meta分析显示,职业性或娱乐性体育活动均可降低男性结肠癌风险(职业性:RR=0.79, 95% CI: 0.72~0.87;娱乐性:RR=0.78, 95% CI: 0.68~0.91)[70]。Wolin等[71]对52项队列研究或病例对照研究的综合分析显示,与对照组人群相比,体育活动量最高组人群患结肠癌的RR值为0.76(95% CI: 0.72~0.81)。
【陈述8】阿司匹林、环氧合酶-2抑制剂等非甾体抗炎药可减少结直肠腺瘤初次发生(Ⅱa),但存在潜在不良反应(Ⅰ)。
证据等级:Ⅱa;推荐等级:B;陈述同意率:87.7%
大量研究支持阿司匹林能有效预防结直肠癌。随机对照试验结果显示,口服阿司匹林≥300 mg/d,持续5年及以上,可显著降低结直肠癌风险(HR=0.63, 95% CI: 0.47~0.85)[72]。2016年,USPSTF推荐阿司匹林用于结直肠癌的一级预防[73]。在结直肠腺瘤的一级预防方面,目前仅有1项中等质量的随机对照试验报道,其结果表明口服低剂量阿司匹林(325 mg, 隔日1次)持续5年未能减少一般风险男性人群的结直肠腺瘤发生[74]。规律服用阿司匹林可使一般风险人群的结直肠腺瘤发生率降低28%[75-76]。此外,对5项病例对照研究的系统综述显示,规律服用阿司匹林3~10年可明显降低一般风险人群的结直肠腺瘤发生率[77]。另一项对8项病例对照研究的系统综述亦提示,规律服用非甾体抗炎药(NSAIDs)可显著减少一般风险人群结直肠腺瘤的发生[78]。鉴于阿司匹林以及其他非选择性NSAIDs或环氧合酶-2(COX-2)抑制剂相关的消化性溃疡和心血管不良反应[79-80],以及预防用药剂量、年限、起始年龄尚未阐明,考虑到长期使用的风险-获益比和成本-效益比,目前并不支持其用于非高危人群结直肠腺瘤初次发生的预防。
【陈述9】叶酸干预可预防散发性结直肠腺瘤的初次发生。
证据等级:Ⅱa;推荐等级:B;陈述同意率:83.9%
我国一项前瞻性随机对照多中心临床干预试验中,860例年龄在50岁以上、经结肠镜检查排除腺瘤、血浆叶酸水平≤20 μg/L者随机分为2组:叶酸组予叶酸1 mg/d干预,对照组服用其他维生素,结果显示叶酸干预3年可预防散发性结直肠腺瘤,尤其是进展期腺瘤发生[81]。叶酸组中未发生结直肠腺瘤者,干预后血浆叶酸水平上升幅度明显大于发生结直肠腺瘤者。基础叶酸水平<4.27 μg/L者,补充叶酸后需血浆叶酸水平上升较大幅度才可预防结直肠腺瘤初次发生;而基础叶酸水平≥4.27 μg/L者,叶酸水平有一定上升即可预防结直肠腺瘤。
【陈述10】补充维生素D在一定程度上可能减少结直肠腺瘤的发生。
证据等级:Ⅱb;推荐等级:B;陈述同意率:81.5%
越来越多的证据显示,足够水平的维生素D对结直肠癌和结直肠腺瘤的发生具有保护作用[82-83]。循环25-羟维生素D[25(OH)D]水平与结直肠腺瘤的发生风险呈负相关[84],而低血清25(OH)D水平(<30 μg/L)可增加进展期结直肠腺瘤风险[85]。一项队列研究[86]发现总维生素D摄入可轻度降低远端结直肠腺瘤发生风险(RR=0.79, 95% CI: 0.63~0.99),并显著降低远端结肠腺瘤发生风险(RR=0.67, 95% CI: 0.52~0.87)。另一项队列研究[87]也显示维生素D摄入与进展期结肠肿瘤风险呈负相关(OR=0.94, 95% CI: 0.90~0.99)。但近年一项旨在评估维生素D3(2 000 IU/d)单独或联合ω-3多不饱和脂肪酸(1 000 mg/d)对心血管疾病和多种肿瘤一级预防作用的研究[88]发现,干预组结直肠癌发生率与安慰剂组相比差异无统计学意义(HR=1.09, 95% CI: 0.73~1.62)。因此,补充维生素D对结直肠癌或腺瘤的预防作用尚需更多研究数据证实。
【陈述11】通过调节肠道微生态预防结直肠腺瘤或结直肠癌具有一定前景。
证据等级:Ⅲ;推荐等级:C;陈述同意率:84.0%
目前已发现的与结直肠癌发生相关的肠道菌群主要包括具核梭杆菌、致病性大肠埃希菌、产毒性脆弱拟杆菌、口炎消化链球菌等[89]。通过调节肠道菌群可影响和预防结直肠肿瘤的发生、发展[90]。一项纳入16 642名成年女性的前瞻性队列研究[91]发现,在20~39岁和40~59岁年龄段有长期抗菌药物使用史者结直肠腺瘤发生风险增加。一项大型前瞻性队列研究[92]对173 229名成人随访长达26~32年,发现与进食富含红肉、加工肉类、精制谷物和甜点饮食的人群相比,进食富含全谷物和膳食纤维饮食的人群罹患具核梭杆菌阳性结直肠癌的风险降低(HR=0.43, 95% CI: 0.25~0.72),罹患具核梭杆菌阴性结直肠癌的风险则无明显变化(HR=0.95, 95% CI: 0.77~1.17)。酸奶主要含有两种益生菌,即保加利亚乳杆菌和嗜热链球菌。一项随访26~32年的大型前瞻性队列研究[93]发现,食用酸奶的频率与近端结肠癌风险呈负相关(HR=0.84, 95% CI: 0.70~0.99)。另一项大型前瞻性队列研究[94]显示,摄入酸奶可降低传统腺瘤的发生风险,亦可能与大的锯齿状息肉发生风险呈负相关,提示酸奶可能通过影响腺瘤-腺癌途径和锯齿状途径预防结直肠肿瘤。
2. 散发性结直肠腺瘤的二级预防
【陈述12】内镜下摘除结直肠腺瘤可明显降低结直肠癌发病率,但需关注摘除后的结直肠腺瘤再发率。
证据等级:Ⅰ;推荐等级:A;陈述同意率:98.8%
早在1993年,即有学者对1 418例完成结肠镜下腺瘤摘除者进行了5.9年的随访,发现内镜下摘除结直肠腺瘤继以内镜监测随访可减少75%以上的结直肠癌发生[3]。腺瘤摘除后再发包括局部复发和非原处再发,前者的发生率并不高。Martínez等[5]调查了9 167例结直肠腺瘤切除术后患者,中位随访期为4年,46.7%的患者再发结直肠肿瘤,11.2%为进展期腺瘤,0.6%为结直肠癌。多发腺瘤、长径>1 cm的腺瘤和近端结直肠腺瘤摘除后3年再发率高达40%~50%[4]。我国多中心研究[6](5个医疗中心)表明,进展期结直肠腺瘤摘除后1年再发率高达59.46%,5年再发率为78.07%。选择合适的结直肠腺瘤摘除方法对于降低再发率至关重要。
【陈述13】改善生活习惯和调整饮食结构可能降低结直肠腺瘤摘除后再发率。
证据等级:Ⅱb;推荐等级:B;陈述同意率:90.2%
具体方法见本共识意见第7 条陈述。
【陈述14】低剂量阿司匹林可用于年龄小于70岁且预期寿命≥10年、有心血管疾病风险、无消化道出血高危因素者结直肠腺瘤的再发预防;COX-2抑制剂等其他NSAIDs有减少腺瘤再发的作用,但需平衡风险-获益比。
证据等级:Ⅰ;推荐等级:A;陈述同意率:81.5%
大多数关于阿司匹林、COX-2抑制剂等NSAIDs的临床干预研究并未区分是针对腺瘤的一级还是二级预防[95-96]。临床试验和流行病学研究提示,规律服用阿司匹林可减少腺瘤再发、降低结直肠肿瘤发病率和死亡率[8,97]。日本一项多中心随机双盲安慰剂对照研究[98]中,结肠镜下腺瘤/腺癌摘除术后患者随机接受100 mg/d阿司匹林干预(751±67) d或安慰剂干预,结果显示阿司匹林组和安慰剂组结直肠肿瘤再发率分别为36.8%和45.9%,阿司匹林可减少结直肠肿瘤再发(OR=0.60, 95% CI: 0.36~0.98)。有结直肠腺瘤或腺癌史者服用不同剂量阿司匹林(81~325 mg/d)均可明显减少肿瘤再发[99];规律服用阿司匹林可使结直肠腺瘤再发率降低21%,使进展期腺瘤再发率降低37%[97]。一项多中心随机双盲安慰剂对照研究[100]发现,300 mg/d阿司匹林干预1年可明显减少结直肠高危腺瘤摘除后患者再发腺瘤的数量。
3项关于COX-2抑制剂预防结直肠腺瘤再发的著名大样本随机对照试验明确提出塞来昔布和罗非昔布可明显降低散发性腺瘤的再发率[101-103]。但塞来昔布400 mg/d或800 mg/d引起心血管源性死亡的概率分别是安慰剂的2.3倍(95% CI: 0.9~5.5)和3.4倍(95% CI: 1.4~7.8)[104]。此外,考虑到NSAIDs的心血管以及胃肠道出血等不良反应,阿司匹林的最佳剂量目前仍存在争议。一项纳入15项随机对照试验的meta分析显示,非阿司匹林NSAIDs是预防进展期异时性结直肠肿瘤再发最有效的药物,而低剂量阿司匹林则具有最佳风险-获益比[105]。
基于上述研究结果,并借鉴USPSTF和美国胃肠病学会(AGA)的推荐,对于年龄小于70岁、预期寿命至少为10年、消化道出血风险低、10年内心血管疾病发生风险≥10%的个体,应考虑采用低剂量阿司匹林预防结直肠腺瘤再发。
【陈述15】钙剂和维生素D单独或联合应用对结直肠腺瘤的再发可能有一定预防作用。
证据等级:Ⅰ;推荐等级:B;陈述同意率:81.5%
美国一项多中心前瞻性安慰剂对照研究[106]显示,钙剂(碳酸钙3 g/d;元素钙1 200 mg/d)干预4年可降低结直肠腺瘤再发率(RR=0.85, 95% CI: 0.74~0.98)。终止补钙5年后,该预防作用仍持续存在[107]。
钙摄入量(高水平)和血清25(OH)D水平与结直肠癌发生风险呈显著负相关[108-109]。随机对照研究[110]证实,与单独补充钙剂相比,同时补充钙剂和维生素D预防多种肿瘤的效果更佳(单独补充钙剂:RR=0.532, 95% CI: 0.27~1.03;补充钙剂和维生素D:RR=0.402, 95% CI: 0.20~0.82)。然而,2015年发表于《新英格兰医学杂志》的一项前瞻性多中心随机双盲安慰剂对照干预研究[111]否定了上述观点,单独补充维生素D3 1 000 IU/d或钙剂1 200 mg/d或两者联合3~5年均不能降低结直肠腺瘤再发风险。但这一研究结果也受到多方质疑,主要是指出应重点观察高危腺瘤,并应考虑其他食物营养素的干扰[112]。基于上述质疑,该研究团队进一步延长观察随访时间至治疗后4.6年,亦未观察到补充维生素D3和钙剂对预防结直肠腺瘤再发存在延迟效应[113]。此外,维生素D受体基因型可影响维生素D3对进展期结直肠腺瘤再发的预防效应[114]。因此,钙剂和(或)维生素D对结直肠腺瘤再发的预防效应仍需更长干预或随访时间的随机对照试验进一步证实。
【陈述16】小檗碱(黄连素)可能在一定程度上减少结直肠腺瘤的再发。
证据等级:Ⅱa;推荐等级:B;陈述同意率:83.9%
我国多中心随机双盲安慰剂对照临床研究[115]证实,传统中成药小檗碱(黄连素)有一定的预防结直肠腺瘤再发作用。该研究中,891例近期(6个月内)诊断为结直肠腺瘤并全部切除的患者纳入分析,结果显示小檗碱组(口服小檗碱0.3 g bid,疗程2年)随访期内腺瘤再发率显著低于安慰剂组[36.1%(155例)对46.8%(216例), RR=0.77, 95% CI: 0.66~0.91,P=0.001]且无严重不良反应。
【陈述17】叶酸对结直肠腺瘤再发的预防作用尚无定论。
证据等级:Ⅰ;推荐等级:A;陈述同意率:91.4%
叶酸可预防结直肠腺瘤初次发生,但其对腺瘤摘除后再发的作用尚无定论。英国一项关于预防结直肠腺瘤再发的多中心随机双盲研究[97]发现补充叶酸(0.5 mg/d)不能降低结直肠腺瘤再发风险。一项多中心临床试验将1 021例结直肠腺瘤患者随机分为2组,516例服用1 mg/d叶酸干预,505例服用安慰剂,3年和5年随访均未观察到叶酸具有预防腺瘤摘除后再发的作用,甚至发现叶酸干预组的进展期腺瘤再发率明显高于安慰剂组(11.6%对6.9%)[116]。部分患者进一步延长干预时间(平均6.2年)或随访时间(平均7.3年),观察显示补充叶酸会增加无蒂锯齿状腺瘤/息肉风险(RR=1.94, 95% CI: 1.02~3.68)[117]。然而,美国学者发现,对于低叶酸水平(血浆叶酸≤7.5 μg/L)的结直肠腺瘤患者(至少一个腺瘤),补充叶酸可降低腺瘤再发率[118]。
叶酸对结直肠肿瘤的预防作用可能仅出现于基础叶酸水平较低者。一项系统综述和meta分析显示,在仅纳入随机对照试验的分析中,补充叶酸对结直肠癌风险无明显影响;但在分别纳入队列研究和病例对照研究的分析中,总叶酸摄入可显著降低结直肠癌风险[119]。化学合成叶酸与膳食中天然叶酸生物利用度和代谢的差异、摄入剂量、干预时间长短和干预时间点的选择、基础血浆叶酸水平、酒精摄入等因素均可影响叶酸对结直肠肿瘤的作用,有待进一步探索。
【陈述18】二甲双胍可能具有预防结直肠腺瘤再发的作用,但需更多研究证实。
证据等级:Ⅱb;推荐等级:C;陈述同意率:82.7%
二甲双胍具有较广泛的抗肿瘤作用。日本一项多中心随机双盲安慰剂对照试验中,结直肠息肉切除术后患者随机接受二甲双胍(250 mg/d)或安慰剂干预1年,结果显示二甲双胍组腺瘤再发率显著低于安慰剂组[31.0%(22/71)对51.6%(32/62), RR=0.60, 95% CI: 0.39~0.92,P=0.016],且观察过程中未发现二甲双胍可引起明显不良反应[120]。一项回顾性队列研究[121]亦发现,二甲双胍可减少结直肠腺瘤再发(HR=0.76, 95% CI: 0.65~0.89)。但二甲双胍对腺瘤再发的预防作用仍需更大样本量和更长观察时间的研究进一步验证。
三、结直肠癌的二级预防
【陈述19】结肠镜和病理检查是诊断结直肠癌的金标准,放大内镜和染色内镜的应用有助于提高早期结直肠癌的诊断准确性。
证据等级:Ⅰ;推荐等级:A;陈述同意率:97.5%
高质量白光内镜检查仍是提高结直肠癌诊断率和诊断准确性最主要的方法,放大内镜(magnifying endoscopy)和染色内镜的发展、应用则能有效提高早期结直肠癌的诊断准确性。放大内镜对于鉴别病变的异型性和浸润深度具有较高价值,并可为能否进行内镜下治疗提供依据[122-123]。在内镜下使用黏膜染色剂喷洒于黏膜表面的黏膜染色技术可更好地显示病变范围以及表面腺管结构等特征[124-125]。图像增强内镜(image-enhanced endoscopy)如电子染色内镜包括窄带成像(narrow-band imaging, NBI)、智能分光染色内镜(Fujinon intelligent chromoendoscopy, FICE)、联动成像(linked color imaging, LCI)、蓝激光成像(blue light imaging, BLI)、I-Scan等,能通过不同波长光谱的变化更好地呈现病变血管和表面腺管结构,有利于更精确地判断病变浸润深度、异型性等特征[126-127]。一项大规模meta分析显示,使用NBI技术的结肠镜检查腺瘤检出率明显高于白光内镜[126]。放大内镜与染色内镜技术联合,同时结合结直肠癌分型系统,如NICE分型、JNET分型、Kudo分型等,能有效提高以白光内镜检查为基础的结直肠癌早期筛查的准确性和精准性[128-129]。
【陈述20】内镜超声联合放大电子染色内镜有助于评估早期结直肠癌的浸润深度以及是否可行内镜下切除。
证据等级:Ⅱb;推荐等级:A;陈述同意率:95.1%
内镜超声(endoscopic ultrasonography, EUS)广泛应用于结直肠癌的分期评估,特别是早期结直肠癌浸润深度的评估,可为能否进行内镜下治疗提供依据[130]。研究认为EUS应用于直肠癌术前分期有助于制订针对性治疗策略,提高治愈率,降低短期和长期治疗失败率[131]。EUS评估直肠癌T分期的准确性(80%~95%)高于CT(65%~75%)和MRI(75%~85%)[132],特别是小探头EUS,对T1期病变的敏感性和特异性高达91%和98%[130]。一项纳入42项研究、共5 039例直肠癌病例的大规模meta分析比较了EUS术前评估直肠癌T分期与手术标本组织病理学分期的一致性,结果显示EUS对T1期病变的诊断敏感性和特异性分别为87.8%和98.3%[133]。但在评估N分期方面,因EUS难以完整检查全部肠系膜,MRI可能更为有效。另一项研究[134]显示,EUS对早期结直肠癌T分期的诊断效能优于放大内镜。EUS有助于明确早期结直肠癌是否适于行内镜下切除,内镜治疗前,在可能的情况下,最好同时使用放大内镜结合电子染色技术如NBI和EUS评估早期结直肠癌的浸润深度[135]。
【陈述21】共聚焦激光显微内镜对早期结直肠癌有一定诊断价值。
证据等级:Ⅱc;推荐等级:B;陈述同意率:81.5%
共聚焦激光显微内镜(confocal laser endomicroscopy, CLE)对早期结直肠癌和腺瘤性息肉有一定诊断价值,其诊断腺瘤性息肉的敏感性为94.0%,特异性为92.9%,准确性为93.4%,阳性和阴性预测值分别为92.2%和94.5%,与组织病理学诊断一致性较好(κ=0.893)[136]。一项纳入15项研究、共719例患者、2 290份标本的meta分析显示,CLE区分结直肠肿瘤与非肿瘤的合并敏感性为0.94(95% CI: 0.88~0.97),合并特异性为0.95(95% CI: 0.89~0.97);实时CLE的敏感性和特异性均高于盲法CLE(敏感性:0.96对0.85,P<0.001;特异性:0.97对0.82,P<0.001);对于实时CLE,基于内镜的系统与基于探针的系统相比具有更高的敏感性和特异性(敏感性:0.96对0.89,P<0.001;特异性:0.99对0.82,P<0.000 1);CLE与放大内镜结合电子染色或黏膜染色技术准确性相当(P>0.05)[137]。
【陈述22】需规范化处理早期结直肠上皮性肿瘤的内镜切除标本。
证据等级:Ⅲ;推荐等级:B;陈述同意率:91.4%
内镜下切除病变从体内取出后,内镜医师应及时伸展、标记组织标本,固定后送病理科。可使用镊子伸展标本,如标本边缘区域卷曲,可将肾上腺素溶液滴于标本基底面,待黏膜肌组织松弛后再伸展标本[138]。伸展标本时将黏膜面朝上摆放,以不锈钢细针将标本固定于橡胶板上,标识口侧和肛侧方向。固定液使用10%~20%甲醛溶液,甲醛溶液容量应不少于所固定标本体积的10倍,室温下固定12~48 h[7]。取材时,病理医师需确认距标本边缘最近的肿瘤组织区域,以其连线作为第1条切开线,或根据内镜医师提交的病理申请单注明的取材需求确定第1条切开线,以该切开线为基准,间隔2~3 mm平行切开标本,对所有组织条进行组织学诊断[139]。
规范的病理报告须包括以下几项内容:①标本类型、病变肉眼形态和大小;②组织学分型;③肿瘤侵犯深度,建议黏膜肌层染色;④脉管有无侵犯;⑤黏膜标本的侧切缘和基底切缘状态;⑥周围黏膜其他病变;⑦建议绘制黏膜病变谱系图。
尤其需注意的是,如标本只有上皮内瘤变成分,则报告上皮内瘤变分级;如存在黏膜下浸润癌成分,则需报告癌组织的组织学分化类型、黏膜下浸润深度[建议使用结蛋白(desmin)免疫组化染色明确黏膜肌层情况,报告中注明所使用的测量方法]、脉管累及情况(建议使用EVG弹力纤维染色评估静脉累及,使用淋巴管内皮细胞特异性标志物D2-40免疫组化染色评估淋巴管累及)、肿瘤出芽分级、神经侵犯情况等[7,139]。
【陈述23】位于直肠或乙状结肠、长径≤5 mm并经病理证实的增生性息肉可随访观察,腺瘤和其余锯齿状病变推荐内镜下切除。
证据等级:Ⅲ;推荐等级:C;陈述同意率:86.4%
对于长径≤5 mm的隆起型腺瘤,推荐内镜下切除,但也可内镜随访观察。常规结肠镜检查发现的70%~80%的隆起型腺瘤长径≤5 mm,由于这些病变的癌变率很低,仅为0.03%~0.3%[140-142],故可行内镜下切除,或内镜随访观察。平坦型和凹陷型肿瘤性病变,即使长径≤5 mm,也应行内镜下切除。较之隆起型病变,平坦型和凹陷型腺瘤的浸润性癌发生率更高[143],故即使很小,也推荐内镜下切除。对于长径≥6 mm的腺瘤推荐内镜下切除,因其癌变率高于长径≤5 mm的腺瘤,且单独使用结肠镜很难区分良性腺瘤与癌,故推荐内镜下切除[140,144-145]。结直肠锯齿状病变包括无蒂锯齿状腺瘤/息肉、传统锯齿状腺瘤和部分增生性息肉[146]。位于直肠或乙状结肠、长径≤5 mm的增生性息肉建议随访观察,位于其他部位或更大的增生性息肉,推荐内镜下切除。大部分增生性息肉分布于远端结直肠,且通常长径<5 mm,该类病变与腺瘤样变无关,可使用NBI和(或)黏膜染色技术在内镜下精准判断[147-148],故推荐随访观察。无蒂锯齿状腺瘤/息肉和传统锯齿状腺瘤被认为有恶变潜能,是结直肠癌的癌前疾病[146],无论大小和部位,均推荐内镜下治疗。
【陈述24】基于病变大小和位置判断可整块切除的早期结直肠癌(Tis/T1a)推荐内镜下治疗,内镜黏膜下剥离术是最适合整块切除的方法。
证据等级:Ⅱb;推荐等级:A;陈述同意率:84.0%
早期结直肠癌(Tis/T1a)淋巴结转移风险低,基于病变大小和位置判断可整块切除的病变推荐内镜下治疗,明确的临床T1b癌(黏膜下层浸润深度≥1 000 μm)目前建议手术治疗[149]。整块切除是最理想的内镜下治疗,内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)是最适合整块切除的方法,特别是对于以下情况[149]:①以圈套器行内镜黏膜切除术(endoscopic mucosal resection, EMR)难以整块切除的病变,包括非颗粒型侧向发育型肿瘤(laterally spreading tumor-non-granular type, LST-NG)尤其是LST-NG假凹陷型、pit pattern Ⅴi型病变、浅T1期(黏膜下)浸润癌、大的凹陷型肿瘤、怀疑癌变的大的凸起型肿瘤;②黏膜肿瘤伴黏膜下纤维化;③慢性炎症如UC基础上的散发肿瘤;④内镜切除术后残留或复发的早癌。建议根据病变实际情况(病变位置、大小、形态)以及操作医师的经验灵活选择不同类型的ESD术式。常规(狭义的)ESD指不使用圈套器完成的完整黏膜下层剥离[150-151]。使用ESD治疗刀或圈套器尖端切开病变周围黏膜后,不进行黏膜下层剥离而直接进行圈套器切除的技术,称为“预切割EMR”[149]。使用ESD治疗刀或圈套器尖端切开病变周围黏膜后,先进行黏膜下层剥离,再使用圈套器切除的方法,定义为“混合ESD”[152-154]。如存在严重的黏膜下纤维化病变(如结肠炎相关上皮内瘤变、LST-NG病变),或考虑有黏膜下浸润、使用圈套器切除成功率较低时,建议使用混合ESD[155]。
【陈述25】结直肠腺瘤内镜下治疗后的随访应采取风险分层,低危腺瘤患者应在内镜下治疗后3年内行结肠镜复查,高危腺瘤患者的复查时间应适当缩短。
证据等级:Ⅱb;推荐等级:B;陈述同意率:93.8%
首次行结肠镜筛查后发现结直肠息肉并完成内镜下治疗的患者,总体长期结直肠癌风险略高于一般人群,与结肠镜筛查后不复查相比,结肠镜筛查后复查可有效降低之后的结直肠癌发生率(校正HR=0.57, 95% CI: 0.40~0.80)[156]。应根据腺瘤数量、大小和组织病理学结果确定最佳内镜随访时间。日本一项多中心回顾性队列研究[157]中,基线结肠镜筛查发现腺瘤的患者分为长径<6 mm组和长径≥6 mm组,中位随访期为5.1年,随访3年时两组发现长径≥10 mm的腺瘤和结直肠癌的比例分别为2.9%和5.4%,至随访截止时,相应比例分别为6.7%和13.4%,因此有必要在内镜下息肉摘除术后3年内行结肠镜复查。一项meta分析显示,基线检查时腺瘤长径<10 mm、数量≤3个的低危腺瘤患者与未发现腺瘤者,随访中异时性高危腺瘤的5年累积发生率分别为4.9%和3.3%,而腺瘤长径≥10 mm、数量>3个或合并高级别上皮内瘤变的高危腺瘤患者,异时性高危腺瘤5年累积发生率为17.1%[158]。因此,对于高危腺瘤患者,应进行更密切的随访。根据国内外相关共识意见,并结合我国实际情况,建议结直肠腺瘤内镜下治疗后3年内行结肠镜复查;对于腺瘤数量>3个、长径≥10 mm或合并高级别上皮内瘤变者,复查时间应缩短至1~2年[159]。
【陈述26】应根据治疗方式、基于病理的治愈性评估、危险因素和基础疾病制订结直肠早癌患者内镜下治疗后的随访方案;结直肠早癌内镜下治疗后应密切随访至少3年,条件允许者应长期随访。
证据等级:Ⅱb;推荐等级:B;陈述同意率:91.3%
结直肠早癌内镜下治疗3年后复发的报道很少,因此对于结直肠早癌患者应严密随访3年。T1期结直肠早癌术后有0%~26.5%的病例在25.6~102.8个月时发生异时性癌,应考虑长期随访[149]。建议随访时间为治疗后6个月、1年,之后每年随访1次。推荐随访时复查胸、腹、盆腔CT和结肠镜[160]。此外,T1期直肠早癌复发比例(4.2%)高于T1期结肠早癌(1.5%)[161],故复查时应仔细观察直肠情况。进展期腺瘤内镜下分块切除时,如分块切除病理评估难度大、或黏膜内癌水平切缘评估困难、局部残留或复发风险高,则应在术后3~6个月内完成结肠镜随访[162-166]。
【陈述27】病理报告出现以下任一情况时,建议追加外科肠切除术并清扫淋巴结:①黏膜下浸润深度≥1 000 μm(T1b期);②脉管浸润阳性;③低分化腺癌、印戒细胞癌或黏液腺癌[167];④肿瘤出芽分级为BD2或BD3[167];⑤基底切缘(垂直切缘)阳性。
证据等级:Ⅱb;推荐等级:B;陈述同意率:91.3%
影响结直肠早癌局部淋巴结转移的因素包括黏膜下浸润深度[168]、组织学类型(如低分化腺癌、印戒细胞癌、黏液腺癌)[169]、肿瘤出芽分级和脉管浸润[167,170]。日本结肠和直肠癌学会(JSCCR)指南指出,黏膜下浸润深度≥1 000 μm的结直肠癌淋巴结转移率为12.5%[171]。另一项关于T1b癌(黏膜下浸润深度>1 000 μm)淋巴结转移风险分层的研究[172]表明,虽然黏膜下浸润深度不符合内镜下根治性标准,但未观察到其他转移危险因素的病例,淋巴结转移发生率仅为1.3%。因此,并非所有黏膜下浸润深度>1 000 μm的病例都必须进行额外的手术。应在充分考虑除黏膜下浸润深度以外的其他淋巴结转移危险因素后,结合患者身体机能、社会背景和意愿作出临床决策。
肿瘤出芽是pT1结直肠癌淋巴结转移的独立危险因素[173]。肿瘤出芽可分为3级:0~4个为BD1级,5~9个为BD2级,≥10个为BD3级。此分类有利于pT1结直肠癌淋巴结转移的危险程度分级,BD2和BD3级与更高的淋巴结转移风险相关。据报道,出芽生长的结直肠癌淋巴结转移率是无出芽生长者的7.74倍,BD3级结直肠癌淋巴结转移率高达21%[174-176]。
基底切缘阳性系指在切除标本的黏膜下层边缘发现肿瘤组织。局部残留癌需引起高度关注,与垂直切缘阴性相比,垂直切缘阳性复发风险更高[177]。 此外,临床上很难对垂直切缘阳性的肿瘤进行侵袭性评估,故建议在充分权衡风险与获益的前提下追加外科手术。
【陈述28】血清肿瘤标志物如CEA、CA19-9对结直肠癌具有一定监测价值,血清肿瘤标志物水平持续升高时,推荐进一步行结肠镜检查。
证据等级:Ⅱb;推荐等级:B;陈述同意率:86.4%
CEA是应用最为广泛的结直肠癌血清学标志物,其他血清肿瘤标志物如CA19-9、CA125、CA72-4等也被报道可用于结直肠癌的诊断、术后监测和治疗效果监测,但这些标志物在结直肠癌早期诊断和筛查方面的应用仍存在争议。
一项系统综述结果显示,CEA诊断结直肠癌的合并敏感性和特异性分别为0.53(95% CI: 0.50~0.56)和0.86(95% CI: 0.85~0.88);CA19-9分别为0.47(95% CI: 0.44~0.51)和0.92(95% CI: 0.91~0.94);CA125分别为0.20(95% CI: 0.15~0.26)和0.99(95% CI: 0.98~1.00)[178]。一项纳入1 027例样本(结直肠癌301例,腺瘤143例,非肿瘤良性结肠疾病对照141例,其他癌症176例,健康对照266例)的研究[179]结果表明,在特异性达到95%的情况下,CEA诊断结直肠癌的敏感性为43.9%,相应cut-off值为4.8 μg/L,AUC为0.77;CA19-9敏感性为22.6%,cut-off值为34.0 U/mL,AUC为0.64;CA72-4敏感性为20.6%,cut-off值为8.0 U/mL,AUC为0.66;AFP敏感性为6.6%,cut-off值为5.8 U/mL,AUC为0.56;CA125敏感性为17.6%,cut-off值为28.3 U/mL,AUC为0.56;CA15-3敏感性为4.0%,cut-off值为33.3 U/mL,AUC为0.53。我国一项研究[180]表明,CEA诊断结直肠癌的敏感性为46.59%,特异性为80%;CA19-9敏感性为14.39%,特异性为89%;联合检测可提高血清肿瘤标志物的敏感性和特异性。
四、结直肠癌的三级预防
三级预防主要是对症治疗和康复治疗,防止伤残和促进功能恢复,提高生活质量,延长生存期。对于早中期癌症患者,可通过手术切除病灶并辅以合理的辅助治疗以提高治愈率;对于晚期患者,应积极采用以提高患者尊严和生活质量为目的的姑息治疗。除对疼痛患者进行三阶梯止痛,给予有效的心理治疗以稳定患者情绪,调节饮食、补充营养,通过医疗护理使患者在精神和身体层面获得最大安慰外[181],医务工作者还应重视进展期结直肠癌的术后化疗、放疗、免疫治疗、靶向治疗等。
【陈述29】对于结直肠癌的三级预防,宜采用多学科团队协作治疗模式。
证据等级:Ⅰ;推荐等级:A;陈述同意率:95.1%
结直肠癌的多学科团队(MDT)协作治疗模式以患者为中心,成员包括胃肠外科、肝外科、肿瘤内科、放疗科、放射和超声影像科以及其他相关专业的医师。该治疗模式是转移性结直肠癌的主流治疗模式,不仅能有效延长患者的中位生存期,还能为部分患者提供根治机会。MDT治疗模式可根据肿瘤生物学特点、病灶可切除性、患者基础状态、并发症以及原发灶与转移灶的关系,结合不同治疗目标,给予患者最合理的检查和最恰当的治疗方案,使患者达到最佳临床和生存获益以及更高的生活质量。
【陈述30】结直肠癌患者术后3~6个月行辅助化疗能提高无病生存率和总生存率。
证据等级:Ⅰ;推荐等级:A;陈述同意率:84.0%
术前未接受过化疗的高危Ⅱ期和Ⅲ期结直肠癌患者术后进行辅助化疗能提高5年无病生存率和总生存率。辅助化疗方案可选择FOLFOX(奥沙利铂+亚叶酸钙+5-氟尿嘧啶)、CapeOX(卡培他滨+奥沙利铂)、5-氟尿嘧啶或亚叶酸钙或卡培他滨单药。黏膜组织中高水平的具核梭杆菌等致病菌会降低辅助化疗疗效[182]。目前对辅助化疗的时长仍存在争议,标准化疗时长为6个月,有研究探讨了3个月辅助化疗时长的可靠性。根据国际辅助化疗持续时间评估(International Duration Evaluation of Adjuvant Chemotherapy, IDEA)研究[183]结果,低风险Ⅲ期结肠癌患者使用CapeOX方案治疗3个月的3年无病生存率与6个月标准时长化疗相当(83.1%对83.3%; HR=1.01, 95% CI: 0.90~1.12),故低风险Ⅲ期结肠癌患者可考虑3个月时长的化疗;但高风险Ⅲ期结肠癌患者6个月时长的化疗效果优于3个月,无病生存率显著较高(64.4%对62.7%; HR=1.12, 95% CI: 1.03~1.23,P=0.01),故仍应接受6个月标准时长化疗。高危Ⅱ期结直肠癌患者的辅助化疗方案可参照Ⅲ期患者。如高危Ⅱ期结直肠癌患者适合以奥沙利铂为基础的化疗方案,可考虑应用3个月CapeOX方案[184]。
【陈述31】术前新辅助放疗或放化疗可提高局部进展期直肠癌患者的局部控制率,是目前局部进展期直肠癌的标准治疗模式,建议局部进展期直肠癌患者术前常规评估新辅助放疗或放化疗的可行性和必要性。
证据等级:Ⅱa;推荐等级:B;陈述同意率:85.2%
目前推荐对T3N1-2M0或T4N0-2M0的局部进展期直肠癌患者采用术前辅助放疗或同步放化疗的治疗模式[177,185-187]。在12项关于直肠癌术前放疗(无化疗)的Ⅲ期临床试验中,5项显示术前放疗组局部控制率显著优于单纯手术组[188]。一项临床试验还观察到,接受术前放疗的患者5年总生存率明显优于接受单纯手术治疗者[189]。荷兰的CKVO 95-04试验比较了术前放疗联合全直肠系膜切除术与单独全直肠系膜切除术的疗效,结果显示前者局部控制率显著升高,但两种治疗模式的2年、5年和10年总生存率无明显差异[190-191]。相关meta分析和系统综述的结论尚不统一[192-193],无足够证据表明辅助放疗能提高直肠癌患者的生存率。
术前放疗可通过射线杀灭肿瘤细胞,缩小原发肿瘤病灶,有助于提高直肠癌预期R0切除率和保留肛门括约肌。由于术前小肠不是固定于盆腔内,因此放疗对消化道的损伤和术后毒性反应较小[188,194]。
【陈述32】直肠MRI是评估局部进展期直肠癌新辅助放化疗前后分期和疗效准确性较好且最常用的影像学技术。
证据等级:Ⅱb;推荐等级:B;陈述同意率:93.8%
EUS、CT和MRI均可用于直肠癌放化疗后评估,目前最常用的方法仍是直肠MRI[195-196]。推荐在新辅助放化疗前后分别行MRI以明确T、N分期,评价治疗效果。对于有MRI禁忌证者,可行增强CT扫描。影像学检查须明确肿瘤位置(肿瘤最低缘至肛缘的距离)和长径、T分期和N分期、直肠系膜和筋膜状态以及有无直肠壁外血管侵犯。
【陈述33】结直肠癌转移病灶可采用姑息减症放疗,如选择三维适形放疗或调强放疗、立体定向放疗等,对于脑转移,可行病灶的立体定向放射外科治疗或全脑放疗。
证据等级:Ⅱa;推荐等级:B;陈述同意率:87.6%
放疗的主要获益是减轻局部症状,提高局部控制率,对于无法切除的脑转移、肺转移、肝转移灶,可行强调放疗(IMRT)或立体定向放疗(SRT)。多项回顾性研究表明,无论是治愈性治疗还是姑息性治疗,SRT对各种转移病灶,尤其是寡转移灶可获得良好疗效。尚缺乏比较SRT与标准疗法治疗效果的高水平临床研究。脑转移灶的放疗能缓解颅神经症状和颅内高压症状,症状改善率为60%~80%,并可通过减少局部复发延长生存期[197-198]。根据相关系统综述结果,立体定向放射外科治疗(SRS)、全脑放疗和最佳支持治疗的中位生存期分别为6.4、4.4和1.8个月[199]。脑转移灶数量≤4个且每个转移灶最大径均<3 cm时,建议采用SRS,可达到80%~90%的局部控制率[177]。
【陈述34】靶向治疗目前适用于晚期或转移性结直肠癌的全身系统治疗。
证据等级:Ⅰ;推荐等级:A;陈述同意率:95.1%
随着精准治疗的发展,结直肠癌分子靶向治疗的疗效评价日益受到重视。目前常用的靶向治疗药物主要包括表皮生长因子受体(epidermal growth factor receptor, EGFR)药物(如西妥昔单抗、帕尼单抗)、人表皮生长因子受体2(human epidermal growth factor receptor 2, HER2)药物(如曲妥珠单抗、帕妥珠单抗)、血管内皮生长因子(vascular endothelial growth factor, VEGF)及其受体药物(如贝伐珠单抗、阿柏西普、雷莫芦单抗、瑞戈非尼、呋喹替尼)等。目前尚无证据表明靶向治疗在Ⅱ期或Ⅲ期结直肠癌的辅助治疗中能使患者额外获益,甚至会出现相关不良事件[200-202]。靶向治疗推荐用于晚期或转移性结直肠癌的全身系统治疗。相关meta分析显示,RAS野生型转移性结直肠癌患者使用EGFR抑制剂有明显的临床获益[203-204]。美国国家综合癌症网络(NCCN)临床实践指南建议曲妥珠单抗与帕妥珠单抗或拉帕替尼(HER2/EGFR双抑制剂)联用作为伴HER2基因扩增的转移性结直肠癌的后续治疗方案[205]。研究表明,与不含贝伐珠单抗的化疗方案相比,贝伐珠单抗与一线化疗方案5-氟尿嘧啶/亚叶酸钙联用可改善不可切除的转移性结直肠癌患者的总生存率[206-207]。相关meta分析也表明,转移性结直肠癌一线化疗方案与贝伐珠单抗联用可使患者获益[208-209]。
【陈述35】应于靶向治疗开始前进行肿瘤相关基因检测,于根据实体瘤疗效评价标准(RECIST 1.1)评估疾病进展后进行耐药相关基因检测。
证据等级:Ⅰ;推荐等级:A;陈述同意率:96.3%
对于转移性结直肠癌,建议检测肿瘤相关基因KRAS/NRAS、BRAF突变状态和HER2基因扩增情况[205]。《中国结直肠癌诊疗规范(2020年版)》推荐对临床确诊为复发或转移性结直肠癌的患者行KRAS、NRAS和BRAF基因突变检测,以指导肿瘤靶向治疗[139]。对具有RAS或BRAF基因突变的转移性结直肠癌,仅推荐化疗联合VEGF单抗作为一线治疗方案。对于RAS和BRAF全野生型的转移性结直肠癌,化疗联合EGFR单抗或VEGF单抗一线治疗能使之获益。
随着靶向药物的广泛应用,研究发现部分无原发性耐药的患者在EGFR单抗治疗3~12个月后对该药物不再敏感,此时对肿瘤组织、转移灶或血清中的肿瘤细胞DNA进行检测,可发现肿瘤在EGFR单抗治疗过程中发生基因表达改变,导致获得性耐药,主要包括KRAS、BRAF、EGFR受体酪氨酸激酶基因突变以及获得性HER2扩增、c-MET基因突变等[210-211]。此种获得性耐药目前无法避免,根据RECIST 1.1评估疾病进展后,在无法获取组织标本的情况下,可选择检测血清游离肿瘤细胞DNA,以期早期发现获得性耐药,从而及时改变治疗策略[212]。
【陈述36】不同靶向药物联合治疗对晚期结直肠癌的有效性仍待验证。应重视靶向药物的不良反应。
证据等级:Ⅰ;推荐等级:A;陈述同意率:90.2%
肿瘤的发生、发展是多个分子信号通路共同作用的结果,不同靶向药物联合治疗成为晚期结直肠癌新的治疗突破口,但目前临床试验显示EGFR单抗联合VEGF单抗治疗效果不佳。CAIRO-2和PACCE两项试验比较了EGFR单抗联合VEGF单抗治疗晚期结直肠癌的效果,结果均未显示总生存率和无进展生存期(progression-free survival, PFS)获益[213-214]。临床不推荐EGFR单抗与VEGF单抗联用作为晚期结直肠癌的一线或二线治疗。其他分子靶向药物联用的疗效尚无进一步的试验证实。
抗EGFR治疗的不良反应包括皮肤毒性反应、骨髓抑制、低镁血症等。Pinto等[215]的研究发现,经西妥昔单抗治疗的转移性结直肠癌患者,60%~80%出现皮疹,严重皮疹比例可达5%~20%,发病率和严重程度通常与西妥昔单抗剂量相关。抗HER2治疗的不良反应包括心脏毒性、低钾血症、腹痛、皮疹、疲劳等[216-217]。抗VEGF治疗的不良反应包括高血压、蛋白尿、血栓、出血等[218-220]。贝伐珠单抗和瑞戈非尼治疗的高血压总发生率分别为23.6%和44.4%[221]。一项纳入33项临床试验、共6 882例实体瘤病例的meta分析显示,接受VEGF受体酪氨酸激酶抑制剂治疗者的蛋白尿发生率为18.7%[222]。
【陈述37】免疫检查点抑制剂可作为DNA错配修复缺陷/高度微卫星不稳定型转移性结直肠癌的标准一线治疗。同时应重视治疗相关不良反应和药物毒性管理。
证据等级:Ⅰ;推荐等级:A;陈述同意率:88.9%
免疫检查点抑制剂(immune checkpoint inhibitor, ICI)的出现为不可切除或转移性结直肠癌患者带来了新的治疗选择。DNA错配修复缺陷(mismatch repair-deficient, dMMR)/高度微卫星不稳定(microsatellite instability-high, MSI-H)型转移性结直肠癌患者是ICI治疗的敏感人群。美国食品药品管理局(FDA)已批准 3 种 ICI用于治疗dMMR/MSI-H型转移性结直肠癌,包括两种程序性死亡受体1(PD-1)单抗,分别为帕博利珠单抗(pembrolizumab)和纳武利尤单抗(nivolumab),以及细胞毒性T细胞相关抗原4(CTLA-4)单抗伊匹单抗(ipilimumab)。近年多项随机对照试验显示帕博利珠单抗或纳武利尤单抗单用或联合伊匹单抗方案可显著改善dMMR/MSI-H型转移性结直肠癌患者的治疗应答和PFS[223-225],为权威共识指南所推荐。2021年NCCN结肠癌指南V2版[205]、《中国临床肿瘤学会(CSCO)结直肠癌诊疗指南(2020)》[226]和中国结直肠癌患者免疫治疗专家共识[227]均建议帕博利珠单抗作为一线方案用于治疗dMMR/MSI-H型转移性结直肠癌或不耐受强烈治疗的dMMR/MSI-H型转移性结直肠癌。
一项开放标签、随机对照Ⅲ期临床试验KEYNOTE-177结果显示,dMMR/MSI-H型转移性结直肠癌初治患者接受帕博利珠单抗一线治疗(153例),中位PFS(16.5个月对8.2个月;HR=0. 60,P=0.000 2)和客观应答率(objective response rate, ORR; 43.8%对33.1%)均高于标准治疗组(mFOLFOX6或FOLFIRI方案,联合或不联合贝伐珠单抗或西妥昔单抗;154例),生存期有延长趋势,生活质量亦更高[223]。多中心、多队列、开放标签、非对照Ⅱ期临床试验CheckMate-142结果显示,119例组织学确诊的dMMR/MSI-H型复发或转移性结直肠癌患者接受纳武利尤单抗联合伊匹单抗治疗,ORR达到55%,9个月和12个月无进展生存率分别为76%和71%,总生存率分别为87%和85%[225]。
根据常见不良事件评价标准(CTCAE 5.0),ICI总体安全,≥3级治疗相关不良事件发生率较低:CTLA-4单抗为31%,PD-1单抗为10%。不良反应可累及全身所有器官,常见的受累部位有皮肤、胃肠道、肾脏、肝脏、肺、关节、肌肉等。神经系统、心血管系统毒性罕见,但发展迅速,是死亡的重要原因。ICI治疗过程中应严密监测相关不良反应,早发现、早诊断、早治疗,采取MDT协作管理[228]。
【陈述38】DNA错配修复缺陷/高度微卫星不稳定型非转移性结直肠癌(Ⅰ-Ⅲ期)可能从包含免疫检查点抑制剂的术前新辅助化疗方案中获益。
证据等级:Ⅲ;推荐等级:B;陈述同意率:82.8%
NICHE研究[229]纳入40例可切除结直肠癌患者,其中21例为dMMR型,20例为DNA错配修复完整(mismatch repair-proficient, pMMR)型(其中1例同时为dMMR型),81%的dMMR型患者和40%的pMMR型患者为Ⅲ期结直肠癌。患者接受伊匹单抗1 mg/kg(第1天)联合纳武利尤单抗3 mg/kg(第1天和第15天)治疗,并在6周内接受外科手术治疗,结果显示20例可评估的dMMR型患者100%达到病理学应答,19例为主要病理学应答,12例为完全病理学应答,且安全性良好。所有患者均完成根治性手术,未发生手术延迟。该研究表明,通过新辅助免疫治疗,结直肠癌手术或可择期进行,且术后不会产生预期外的更多并发症。新辅助免疫治疗未来是否会成为dMMR型非转移性结直肠癌的标准治疗方案,有待更大样本、更长随访时间的临床研究验证。
【陈述39】除药物临床研究外,不推荐DNA错配修复完整/微卫星稳定型转移性结直肠癌患者单独使用免疫检查点抑制剂治疗。
证据等级:Ⅱ;推荐等级:B;陈述同意率:87.7%
90%~95%的转移性结直肠癌属于pMMR/微卫星稳定(microsatellite stable, MSS)型,使用ICI单药治疗获益甚微。多项采用ICI单药治疗转移性结直肠癌的国际性临床研究均未在pMMR/MSS型转移性结直肠癌患者中观察到有效应答[230]。通过其他分子标志物筛选出免疫治疗可能的获益人群以及探索联合治疗方案是当前的研究热点。目前已公布的Ⅲ期临床试验显示,阿特珠单抗(atezolizumab)联合丝裂原细胞外激酶抑制剂考比替尼(cobimetinib)无法提高pMMR/MSS型转移性结直肠癌患者的ORR或总生存期(overall survival, OS)[231]。纳武利尤单抗与抗血管生成药物瑞戈非尼联合治疗pMMR/MSS型转移性结直肠癌的临床试验(REGONIVO研究)初步显示该方案可使患者临床获益,但需Ⅲ期随机对照试验进一步验证[232]。综上所述,不推荐pMMR/MSS型转移性结直肠癌患者单独使用ICI治疗,鼓励该类患者积极参与免疫治疗联合抗血管药物或抗EGFR药物的临床试验。
【陈述40】嵌合抗原受体T细胞、肿瘤疫苗等免疫治疗方法在结直肠癌的治疗中具有一定前景,但有待进一步临床研究验证。
证据等级:Ⅲ;推荐等级:B;陈述同意率:86.4%
细胞免疫疗法又称过继性细胞免疫治疗(adoptive cell transfer therapy),是将体内具有抗肿瘤活性的细胞分离后,经诱导、修饰、培养、扩增后再回输至患者体内发挥抗肿瘤效应的免疫疗法。在结直肠癌的过继性细胞免疫治疗中,嵌合抗原受体T细胞(chimeric antigen receptor-expressing T-cells, CAR-T)疗法为研究热点,迄今已陆续发现了众多新型潜在靶点,如自然杀伤细胞NKG2D(natural killer group 2 member D)分子、CEA、上皮细胞黏附分子(epithelial cell adhesion molecule, EpCAM)、鸟苷酸环化酶C(guanylyl cyclase C, GUCY2C),但疗效报道不一[233-234]。目前在美国临床试验数据库(ClinicalTrials.gov)已有10余项处于不同研究阶段的有关结直肠癌CAR-T疗法的临床试验注册。
肿瘤疫苗是指将肿瘤抗原以多种形式导入患者体内以激活免疫反应,进而发挥抗肿瘤效应的免疫治疗方法。针对结直肠癌的肿瘤疫苗研究已开展多年,新近报道中的PolyPEPI1018和Ad5-GUCY2C-PADRE疫苗[235]因能显著延缓肿瘤进展而备受关注,但仍处于Ⅰ期临床试验阶段。至今尚无相关治疗方案获得上市许可。
【陈述41】非特异性主动免疫治疗有助于增强机体免疫功能,激活抗肿瘤免疫反应,与化疗联合应用可能有助于提高疗效。
证据等级:Ⅲ;推荐等级:C;陈述同意率:82.7%
胸腺肽α1作为一种免疫增强剂,与化疗药物联合应用可显著改善被化疗抑制的机体免疫功能,加速T细胞恢复,减少化疗相关不良反应,增强患者对化疗的耐受性[236]。细菌疫苗如霍乱疫苗亦可作为免疫调节剂使用。一项纳入175例晚期结直肠癌患者的研究[237]显示,与未接种霍乱疫苗对照组相比,接种霍乱疫苗组癌症相关死亡率降低47%,全因死亡率降低41%。另一项回顾性研究[238]分析了接受GOLFIG化学免疫治疗方案[吉西他滨+FLOFOX方案联合重组白细胞介素-2(IL-2)和粒细胞巨噬细胞集落刺激因子(GM-CSF)]治疗的179例转移性结直肠癌患者的生存情况,其中位PFS和OS分别为15.28个月和24.6个月,与单用FOLFOX方案相比,PFS更长且OS有延长趋势。上述研究表明,联合非特异性免疫治疗或联合应用免疫调节剂,可提高晚期结直肠癌患者的化疗疗效,改善预后。
五、遗传性结直肠癌的预防
【陈述42】首次诊断为结直肠癌的患者,应检测错配修复蛋白或微卫星稳定性情况,以明确是否存在DNA错配修复功能缺陷,并由此指导测序分析基因胚系突变情况。
证据等级:Ⅱb;推荐等级:A;陈述同意率:88.9%
林奇综合征是一种常染色体显性遗传病,与错配修复基因胚系突变有关,包括MLH1、MSH2、MSH6和PMS2,其中MLH1和MSH2基因突变携带者具有较高的结直肠癌风险[239]。此外,当EpCAM基因缺失时,MSH2启动子区高甲基化所致的基因沉默也可诱发林奇综合征[240]。林奇综合征的基因胚系突变筛查流程见图1。
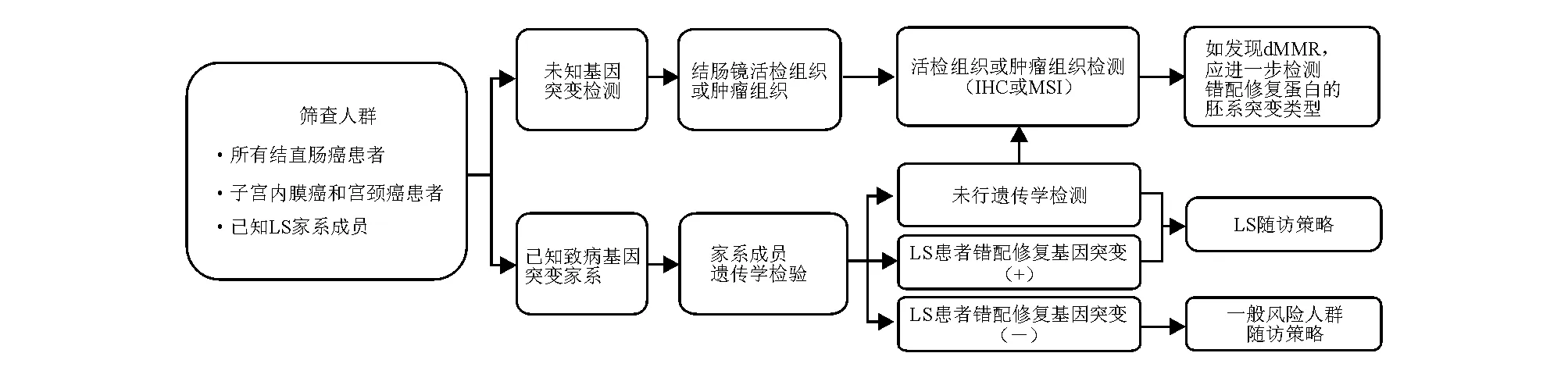
LS:林奇综合征;IHC:免疫组化法;MSI:微卫星不稳定;dMMR:错配修复缺陷
目前推荐错配修复基因检测、免疫组化法检测错配修复蛋白和微卫星不稳定(microsatellite instability, MSI)检测三种方法进行林奇综合征遗传学评估,其中错配修复基因突变检测最为可靠。传统基因胚系突变检测采用桑格(Sanger)法测序,只能逐个检测可疑突变基因,而二代测序可一次性检测多个候选基因,明显提高了检测效率和诊断率,多基因联合检测可作为可疑遗传性结直肠癌患者基因突变检测的首选方法[241]。免疫组化法提示任一错配修复蛋白(MLH1、MSH2、MSH6和PMS2)缺失即为错配修复功能缺陷,经免疫组化法明确诊断的错配修复功能缺陷结直肠癌患者,建议进一步行基因胚系突变检测;如MLH1蛋白表达缺失,需排除BRAF基因突变或MLH1基因启动子区甲基化[242]。MSI检测也可反映错配修复功能,NCCN指南推荐5个常用检测位点:BAT-25、BAT-26、D2S123、D5S346和D17S250;≥2个位点不稳定称为MSI-H,1个位点不稳定称为低度MSI(MSI-low, MSI-L),无位点不稳定称为MSS。建议MSI-H结直肠癌患者进一步检测错配修复基因胚系突变或MLH1基因启动子区甲基化[243]。
【陈述43】林奇综合征患者及其家系成员应定期接受结肠镜随访和息肉切除术以降低结直肠癌发生风险,同时进行肠外肿瘤监测。
证据等级:Ⅱb;推荐等级:A;陈述同意率:97.5%
林奇综合征患者及其家系成员患结直肠癌、子宫内膜癌、卵巢癌、胃癌以及其他恶性肿瘤的风险明显升高,且不同错配修复基因突变携带者的肿瘤发生风险存在差异,建议定期行结肠镜检查并联合息肉切除术以降低结直肠癌发生风险[244]。
携带MLH1或MSH2基因突变的林奇综合征患者应从25岁开始接受结肠镜检查,每1~2年复查1次,如家系成员中最早发病者年龄小于25岁,则筛查初始年龄提前2~5年;MSH6或PMS2基因突变携带者应从35岁开始接受结肠镜检查,每2~3年复查1次,如家系成员中最早发病者年龄小于30岁,则筛查初始年龄提前2~5年[245]。林奇综合征家系中未行基因检测的成员,随访策略与基因突变携带者相同,经基因检测未发现突变者则按一般风险人群进行随访。
我国林奇综合征患者的肠外肿瘤以胃癌最为多见,其次为子宫内膜癌,建议患者从30~35岁开始每3~5年进行1次胃镜检查[246]。对于携带错配修复基因突变且无生育需求的女性,可考虑行子宫和双侧附件预防性切除术,否则建议每1~2年进行1次子宫内膜活检,定期行经阴道子宫双侧附件区超声检查和血清CA125检测[247]。
【陈述44】首次发现结直肠癌的林奇综合征患者应制订个体化手术方案。
证据等级:Ⅱb;推荐等级:A;陈述同意率:95.1%
对于初诊时发现结直肠癌的林奇综合征患者,需综合考虑年龄、术后随访依从性等因素以制订个体化治疗方案,一般治疗方式包括节段性结肠切除术、结肠次全切除术和全结肠切除术[248]。研究[249]表明节段性结肠切除术后5年、10年异时性结直肠癌累积风险分别为8.4%和20.4%。目前尚无证据表明结肠次全切除术和全结肠切除术可显著延长首次发现结直肠癌的林奇综合征患者的生存期,且节段性结肠切除术后患者的生活质量优于行结肠次全切除术和全结肠切除术者。
【陈述45】建议对以下可疑为腺瘤性息肉综合征(包括家族性腺瘤性息肉病、MUTYH相关息肉病)的患者行基因检测,主要是APC基因和MUTYH基因:①结直肠腺瘤性息肉数量≥10个,且有结直肠癌个人史或家族史;②腺瘤性息肉综合征家族史;③结直肠腺瘤史且有家族性腺瘤性息肉病肠外表现。
证据等级:Ⅲ;推荐等级:C;陈述同意率:96.3%
腺瘤性息肉综合征包括经典型FAP、衰减型FAP和MUTYH相关息肉病。FAP是一种常染色体显性遗传病,与APC基因突变有关,其阳性检出率为70%~79%[250-251];而MUTYH相关息肉病是由MUTYH双等位基因突变引起,是APC基因突变检测阴性的常染色体隐性遗传病,MUTYH基因阳性突变率最高为11%~12%[252]。我国学者关于中国FAP患者基因突变谱的研究[253]表明,APC、MUTYH基因突变率分别为76.09%和6.52%,同时存在APC、MUTYH(双基因)突变的比例约为8.7%。欧美人群MUTYH基因突变热点为Y179C和G396D[252],但目前尚无针对中国人群的相关报道。建议对可疑腺瘤性息肉综合征患者同时行APC、MUTYH基因突变检测,有明确突变患者的家系成员也应行相关基因突变位点检测。APC基因检测结果为阴性时,应行MUTYH基因检测,如MUTYH基因出现等位基因突变,或MUTYH基因两条链均包含致病性突变,可确诊MUTYH相关息肉病[253-255]。基因检测方法主要包括一代测序结合多重连接探针扩增技术和多基因组合的二代高通量测序[256]。腺瘤性息肉综合征的基因筛查检测流程见图2。

FAP:家族性腺瘤性息肉病;CFAP:经典型家族性腺瘤性息肉病;AFAP:衰减型家族性腺瘤性息肉病
【陈述46】临床诊断为经典型家族性腺瘤性息肉病的患者,建议根据结肠表型从10~15岁开始每1~3年进行1次结肠镜检查;衰减型家族性腺瘤性息肉病患者从18~20岁开始每2年进行1次结肠镜检查。
证据等级:Ⅲ;推荐等级:B;陈述同意率:96.3%
携带致病性基因突变的经典型FAP家系成员通常于青春期发病,建议从10~15岁开始每1~3年进行1次结肠镜筛查[257],一旦发现息肉,则每年进行1次结肠镜检查并行息肉切除术,以降低息肉负荷,推迟因息肉负荷过重或发生结直肠癌而需行外科手术治疗的时间,从而延长生存期。对于有直肠出血、腹泻或黏液便等息肉病相关症状的FAP患者,无论年龄大小,均应行结肠镜检查,特别是存在密码子1309结构性致病性突变的患者,因其患癌风险更高[245]。衰减型FAP家系成员从18~20岁开始每2年进行1次结肠镜检查。
【陈述47】临床诊断为经典型家族性腺瘤性息肉病和衰减型家族性腺瘤性息肉病的患者,建议从25~30岁开始监测相关结直肠外肿瘤。
证据等级:Ⅲ;推荐等级:C;陈述同意率:95.0%
经典型FAP和衰减型FAP患者的上消化道监测开始时间目前尚无定论,推荐从发现结直肠息肉时或25岁开始,每3年进行1次胃镜检查[245]。研究显示58%~74%的FAP患者存在十二指肠腺瘤病,癌变风险为3%~5%甚至更高[258-259],建议根据Spigelman分级决定十二指肠镜随访时间间隔[260-261](表2、表3)。FAP患者胃底腺息肉癌变比例约为0.6%[258],发生高级别上皮内瘤变或浸润癌时应行内镜或手术治疗;甲状腺癌的筛查应从17~19岁开始,每2~5年进行1次甲状腺超声检查[257];对于携带基因突变的婴幼儿,建议从出生起每6个月进行1次AFP检测和肝脏超声检查,直至7岁;腹内纤维瘤的筛查应包括每年进行规范的腹壁触诊,如患者有相应症状或纤维瘤家族史,肠切除术后 1~3年应进行一次全腹MRI/CT检查,此后每5~10年复查1次;对于其他肠外器官,目前尚无统一的随访方案[245,262]。

表2 十二指肠腺瘤病Spigelman评分标准

表3 十二指肠腺瘤病随访时间间隔
【陈述48】应根据家族性腺瘤性息肉病患者的年龄、息肉负荷和一般情况综合考虑行结直肠切除术的时间。
证据等级:Ⅲ;推荐等级:C;陈述同意率:91.4%
目前对于FAP患者预防性结直肠切除的时间尚无定论,应根据患者年龄、息肉负荷和一般情况综合考虑[257]。内镜下可治疗的息肉建议直接行内镜下切除术,如发现结直肠癌或内镜下无法切除的癌前病变,应立即行全结直肠切除术。
【陈述49】有研究表明家族性腺瘤性息肉病化学预防有效,但仍需更多证据支持。
证据等级:Ⅰ;推荐等级:C;陈述同意率:88.9%
NSAIDs是最常使用的化学预防药物,其中舒林酸的研究和应用最为广泛。一项纳入22例FAP患者(其中18例未行结肠切除术)的随机双盲安慰剂对照研究[263]显示,舒林酸150 mg bid治疗9个月后,患者腺瘤数量减少56%,平均腺瘤最大径缩小65%。尽管舒林酸、塞来昔布、罗非昔布和吲哚美辛均可在短期内减少腺瘤负荷[264-267],但能否实现肿瘤的长期预防尚缺乏有力证据[268-269]。另有一项纳入92例FAP患者的随机安慰剂对照研究[270]提示,舒林酸和EGFR受体酪氨酸激酶抑制剂厄洛替尼(erlotinib)联合治疗6个月后,FAP患者的结直肠息肉负荷显著降低。
【陈述50】在诊断Peutz-Jeghers综合征的同时,应分析其罹患恶性肿瘤的风险并制订监测策略。
证据等级:Ⅲ;推荐等级:C;陈述同意率:95.1%
Peutz-Jeghers综合征是一种常染色体显性遗传病,诊断需满足以下条件之一:①胃肠道多发(≥2个)错构瘤性息肉;②有Peutz-Jeghers综合征家族史,无论错构瘤性息肉数量;③有Peutz-Jeghers综合征家族史,特定部位(口唇、颊黏膜、生殖器、手指或足趾)皮肤黏膜色素沉着;④无论错构瘤性息肉数量,有特定部位皮肤黏膜色素沉着;⑤有STK11基因致病性突变[271]。除胃肠道癌风险增加外,Peutz-Jeghers综合征还与乳腺癌、胰腺癌、卵巢癌、胆囊癌风险增加相关。一项纳入419例Peutz-Jeghers综合征患者的研究[272]显示,其30、40、50、60、70岁发生消化系统癌症的风险分别为1%、9%、15%、33%和57%。另一项研究[273]对来自48个家系的63例Peutz-Jeghers综合征患者随访2~41年(中位随访期10年),结果显示肠外癌以乳腺癌和胰腺癌最为常见。
无症状Peutz-Jeghers综合征患者建议从8岁开始通过胃镜、结肠镜或可视化胶囊内镜进行消化道癌筛查;对小肠的监测建议每年1次,连续监测3年[274-275]。如基线检查均正常,则可推迟至18岁后继续接受筛查,每2~3年进行1次胃肠镜和影像学检查;如基线检查发现息肉,则需按上述方法重复监测3年。有症状的Peutz-Jeghers综合征患者需更早开始进行监测[245]。对于乳腺癌的监测,应从25岁左右开始每年进行1次乳腺钼靶和乳腺MRI检查,每6个月进行1次临床乳房检查。对于胰腺癌的监测,应从30岁开始每1~2年进行1次增强磁共振胰胆管成像(MRCP)或EUS检查。对于卵巢癌的监测,建议从8岁开始每年进行体检,并观察是否存在性早熟[274]。
【陈述51】推荐选择性息肉切除术预防Peutz-Jeghers综合征息肉癌变和相关并发症。小肠息肉最大径>1.5 cm或最大径≤1.5 cm但有症状者,建议行息肉切除术预防肠套叠。
证据等级:Ⅲ;推荐等级:C;陈述同意率:88.8%
Peutz-Jeghers综合征患者进行内镜随访时,需评估息肉有无进行性增大或恶变,并对最大径>1.5 cm的小肠息肉行内镜下切除以预防息肉癌变和相关并发症,如贫血或出血。肠套叠是该病患儿最重要的并发症,儿童期累积发生风险为50%~68%,在确诊肠套叠病例中,息肉中位最大径为35 mm (15~60 mm)[275],因此应对小肠息肉最大径>1.5 cm或最大径虽≤1.5 cm但有症状者尽早进行干预,干预方法包括内镜、手术或MDT联合治疗,主要取决于患者年龄、息肉大小、位置以及技术可行性等[274]。
【陈述52】幼年性息肉病综合征患者及其家系成员建议接受结直肠监测和基因胚系突变检测。
证据等级:Ⅲ;推荐等级:C;陈述同意率:91.4%
幼年性息肉病综合征是以胃肠道多发幼年性息肉为特征的常染色体显性遗传病,符合以下条件之一即可诊断:①结直肠幼年性息肉数量≥5个;②全胃肠道有幼年性息肉;③有幼年性息肉病综合征家族史,不论幼年性息肉数量;④有BMPR1A或SMAD4基因突变[245]。该病好发于2~8岁儿童,临床症状以直肠出血、息肉脱垂、黑便、腹痛多见,息肉有癌变倾向。一项纳入来自30个家系的44例幼年性息肉病综合征患者的单中心回顾性研究[276]表明,在已切除的息肉中,8.3%(65/787)发生低级别上皮内瘤变。另一项队列研究[277]发现,幼年性息肉病综合征患者一生中发生结直肠癌的累积风险为38.7%。
对于无症状的幼年性息肉病综合征患者,建议从12~15岁开始进行结肠镜监测,根据结肠表型每1~3年检查1次[278]。对于家系成员中未发现SMAD4、BMPR1A基因突变且未发现息肉的高危人群,可每5年进行1次结肠镜检查;如发现息肉,可选择内镜下切除、外科干预或密切随访,并根据息肉大小、数量和病理结果适当缩短随访时间间隔。如内镜下干预无法控制息肉负荷或无法有效监测癌症发生,或已出现息肉相关症状如出血、贫血,则可考虑行结直肠切除术[257]。对于SMAD4基因突变者,应监测遗传性出血性毛细血管扩张症(hereditary hemorrhagic telangiectasia, HHT),许多幼年性息肉病综合征患者伴发HHT,临床特征包括鼻出血、毛细血管扩张、杵状指、内脏动静脉畸形等。如患者家系中存在SMAD4基因突变,则婴儿应在出生后6个月内行SMAD4基因突变检测[278]。对于存在特定基因(SMAD4 或BMPR1A)突变的幼年性息肉病综合征患者,建议其一级亲属行相关基因检测,以确定监测策略[279];胚系突变携带者应按患者随访标准进行监测。
【陈述53】建议锯齿状息肉病综合征患者及其家系成员定期进行结肠镜监测,并及时切除息肉。
证据等级:Ⅲ;推荐等级:B;陈述同意率:97.5%
锯齿状息肉病综合征是一种以结肠多发锯齿状息肉为临床特征的遗传性疾病[280],世界卫生组织(WHO)建议满足以下任意一项标准即可诊断:①近端直肠锯齿状息肉数量≥5个,最大径均≥5 mm,其中至少2个最大径≥10 mm;②锯齿状息肉(不论大小)数量≥20个,其中≥5个位于近端直肠[281]。在明确诊断锯齿状息肉病综合征之前,应行基因检测以排除其他息肉病综合征。一项meta分析表明,在发生结直肠癌的锯齿状息肉病综合征患者中,40%(95% CI: 18%~64%)可检测到MSI,49%(95% CI: 33%~64%)可检测到BRAF基因突变[282]。锯齿状息肉病综合征患者因结直肠内有大量锯齿状息肉,结直肠癌风险显著增加。欧洲一项纳入434例锯齿状息肉病综合征患者的多中心回顾性队列研究[283]中,29.3%(127例)的患者发生结直肠癌。
对于锯齿状息肉病综合征患者,建议通过结肠镜切除所有最大径≥5 mm的息肉。对满足以下至少一项条件的患者,建议每年进行1次结肠镜检查:①发现≥1个进展期锯齿状息肉,即息肉最大径≥10 mm和(或)伴上皮内瘤变;②发现≥1个进展期腺瘤,即腺瘤最大径≥10 mm和(或)高级别上皮内瘤变和(或)绒毛组织成分≥25%;③发现≥5个无蒂锯齿状病变(不论大小)和(或)增生性息肉最大径≥5 mm。如以上3项条件均不符合,可将结肠镜检查间隔时间延长为每2年1次。锯齿状息肉病综合征患者的一级亲属从40岁开始,每5年进行1次结肠镜检查,如既往已确诊结直肠癌,则应从30岁开始进行监测[284-285]。
六、炎症性肠病癌变的预防
【陈述54】炎症性肠病是结直肠癌的癌前疾病。溃疡性结肠炎发生癌变的高危因素包括病程超过10年、全结肠病变、年轻起病。反复炎症是癌变发生的独立危险因素。
证据等级:Ⅱa;推荐等级:A;陈述同意率:96.3%
IBD是结直肠癌的癌前疾病,IBD患者结直肠癌发病率明显升高,UC与结直肠癌的关系更为密切[286]。我国一项多中心回顾性研究[287]表明,UC总体癌变率为0.81%,其中58.6%的病例病程超过10年,79.3%为全结肠病变。亚洲地区基于人群队列研究的系统综述和meta分析显示,UC患者结直肠癌总体患病率为0.85%,病程为10年、20年、30年的患者累积癌变风险分别为0.02%、4.81%和13.91%,与欧美地区相似[288]。与散发性结直肠癌相比,年轻起病、多灶性病变为UC相关结直肠癌的主要特点[289]。UC癌变相关基因包括NCOR2和MECP2,多涉及核因子-κB(NF-κB)和甲基化途径,与散发性结直肠癌有所区别[290]。
病变范围和年轻起病是UC癌变的高危因素,广泛结肠型、左半结肠型、直肠型UC的癌变风险分别为1.42%(95% CI: 0.83%~2.42%)、0.56%(95% CI: 0.38%~0.83%)和0.18%(95% CI: 0.10%~0.31%;P均<0.01),广泛结肠型和左半结肠型UC癌变风险明显高于直肠型UC;研究同时发现不同地域的UC相关结直肠癌发病率存在差异,日本、英国、奥地利最高,加拿大和韩国最低[291]。
UC患者中,30岁之前起病者的癌变风险明显高于30岁及之后起病者,分别为8.2%(95% CI: 1.8%~14.6%)和1.8%(95% CI: 0.9%~2.7%)[286]。其他高危因素还包括吸烟、饮酒、一级亲属有结直肠癌病史等。
对于克罗恩病(Crohn’s disease, CD)的癌变问题目前尚在研究中,基于人群的研究发现长期罹患CD并不增加结直肠癌风险,尤其是病变局限于小肠的CD[292]。与所有高危因素相比,反复炎症是IBD相关结直肠癌发生的独立危险因素。
【陈述55】5-氨基水杨酸通过控制炎症和维持缓解对溃疡性结肠炎相关癌变有一定预防作用,但在预防克罗恩病癌变中的作用尚未明确。
证据等级:Ⅱa;推荐等级:B;陈述同意率:86.4%
反复炎症反应是IBD癌变的病理学基础,因此控制炎症反应、维持病变缓解在预防IBD肿瘤发生方面具有重要作用。5-氨基水杨酸(5-ASA)作为治疗轻中度UC的一线药物,在控制炎症反应和维持缓解方面具有重要作用。我国一项多中心回顾性研究[287]表明,5-ASA对UC癌变具有保护作用(OR=0.368, 95% CI: 0.173~0.782),而激素的使用与癌变发生率无相关性。一项系统综述和meta分析纳入31项研究、共2 137例IBD相关结直肠肿瘤患者(76%为结直肠癌),发现5-ASA对结直肠肿瘤有明显预防作用(RR=0.57, 95% CI: 0.45~0.71),基于医院的研究得出的预防作用较基于人群的研究更明显(基于医院:RR=0.46, 95% CI: 0.34~0.61;基于人群:RR=0.70, 95% CI: 0.52~0.94);分析还表明5-ASA对UC的保护作用优于CD(UC: RR=0.50, 95% CI: 0.38~0.64; CD: RR=0.76, 95% CI: 0.43~1.33)[293]。另一项系统综述和meta分析亦得出类似结果,并提出5-ASA ≥1.2 g/d维持治疗可降低IBD癌变风险[294]。然而一项基于中国香港地区2 103例IBD患者(其中UC 1 246例)的研究[295]发现,5-ASA在IBD患者中并无预防结直肠癌发生的作用(HR=1.22, 95% CI: 0.60~2.48,P=0.593),后续仍需进一步分析5-ASA对IBD相关结直肠癌的预防作用。
【陈述56】硫唑嘌呤和生物制剂能有效控制炎症并促进黏膜愈合,在预防炎症性肠病癌变中的作用还需进一步研究确定。
证据等级:Ⅱb;推荐等级:B;陈述同意率:96.3%
IBD治疗中常用的免疫抑制剂有硫唑嘌呤、6-巯基嘌呤、甲氨蝶呤、环磷酰胺等。免疫抑制剂在控制炎症、维持缓解和黏膜愈合方面具有重要作用。免疫抑制剂预防IBD癌变的研究以硫唑嘌呤为主。一项前瞻性观察性队列研究[296]发现,对于病程超过10年、结肠受累≥50%的长期广泛性结肠炎患者,硫唑嘌呤能显著降低高级别上皮内瘤变和结直肠癌风险(HR=0.28, 95% CI: 0.09~0.89,P=0.03)。另一项纳入2 578例IBD患者的人群队列研究[297]亦表明,硫唑嘌呤能显著降低进展期结直肠肿瘤风险(HR=0.10, 95% CI: 0.01~0.75)。
生物制剂是目前治疗中重度IBD的常用药物,在诱导和维持疾病缓解、促进黏膜愈合方面有较好的疗效。由于生物制剂应用时间尚短,目前仅有少量临床研究认为肿瘤坏死因子-α(TNF-α)抗体在预防IBD癌变中有一定作用。一项纳入173例IBD相关结直肠癌患者的病例对照研究发现,抗TNF-α治疗对IBD癌变具有显著保护作用(OR=0.09, 95% CI: 0.01~0.68,P=0.02);而丹麦一项全国性人群队列研究却发现,抗TNF-α治疗对于降低IBD相关结直肠癌风险并无明显作用(RR=1.06, 95% CI: 0.33~3.40)[298]。 随着生物制剂在临床实践中的长期应用,其对IBD癌变的预防作用还需进一步证实。
【陈述57】我国缺乏原发性硬化性胆管炎作为炎症性肠病癌变高危因素的相关数据,尚无证据表明熊去氧胆酸有预防炎症性肠病癌变的作用。
证据等级:Ⅱb;推荐等级:B;陈述同意率:95.1%
原发性硬化性胆管炎(primary sclerosing cholangitis, PSC)也是IBD癌变的高危因素之一。有研究[299]表明,伴有PSC且40岁之前起病的IBD患者发生结直肠癌的风险是单纯IBD患者的4倍,但不同地域的情况有一定差异。欧美和亚洲国家PSC合并IBD的发病率存在差异,分别为60%~80%和20%~34%[300-301]。我国的初步研究未发现PSC与IBD癌变之间存在相关性,可能与亚洲国家PSC合并IBD发病率较低有关[287,302]。熊去氧胆酸虽有改善胆汁淤积的作用,但国内外共识尚不推荐其作为PSC的常规治疗药物。另有研究[303]显示,PSC合并UC患者长期使用高剂量熊去氧胆酸会增加结直肠肿瘤发生风险。
【陈述58】微生态制剂有助于维持炎症性肠病缓解,其在预防癌变中的作用需进一步临床研究验证。
证据等级:Ⅲ;推荐等级:C;陈述同意率:90.1%
微生态制剂在缓解UC炎症反应方面有一定疗效。一项纳入38项研究的meta分析显示,益生菌、益生元和合生元可通过调控肠道微生态促进并维持IBD缓解,在UC中的作用更为明显[304]。研究认为含双歧杆菌、乳酸杆菌的复合微生态制剂缓解IBD炎症反应的效果更为明确[305]。目前仅有少量研究表明益生菌具有预防结直肠癌发生的作用[306],更多的是动物实验发现益生菌可明显减少UC癌变小鼠的肿瘤负荷,其作用与下调肠黏膜组织中的TNF-α、IL-6等促炎细胞因子水平、抑制NF-κB通路有关[307-308]。微生态制剂对IBD癌变的预防作用尚需临床研究验证。
【陈述59】应重视炎症性肠病癌变的筛查和监测,建议采用高清内镜结合黏膜染色技术全程观察结直肠,行随机活检或对可疑部位行靶向活检。
证据等级:Ⅱa;推荐等级:A;陈述同意率:96.3%
我国IBD发病率呈明显上升趋势,长病程患者日益增多,因此应重视IBD癌变的筛查。国内外多项指南建议在IBD发病8~10年后开始进行结肠镜筛查[309-311]。通过对IBD患者进行定期结肠镜筛查,可及早发现上皮内瘤变或早期癌变,及时给予相应处理,有效降低癌变发生率和死亡率[312]。一项人群队列研究[313]表明,IBD患者初次结肠镜检查后3年内结直肠癌发生率为24.3%(95% CI: 20.4%~28.7%),而非IBD患者结直肠癌发生率仅为7.5%(95% CI: 7.2%~7.8%),因此建议根据病变情况,结肠镜筛查时间间隔为1~3年。
IBD上皮内瘤变内镜下可分为息肉样、非息肉平坦样和内镜下不可见样[314]。由于病变多发,病灶隐匿,既往推荐每隔10 cm四点活检进行病变筛查,但该方法不易在临床开展。随着内镜技术的发展,多项指南推荐采用高清内镜结合亚甲蓝、靛胭脂以及电子染色技术全程观察结直肠,针对可疑部位进行靶向活检,对IBD患者进行筛查,该方法的上皮内瘤变检出率较常规结肠镜检查提高4~5倍。对于内镜下发现的任何级别的上皮内瘤变,均需行内镜下治疗,并根据最终病理结果密切随诊或行手术治疗[312,314-315]。
【陈述60】对于息肉样高/低级别上皮内瘤变,建议内镜下切除后进行病理学评估,全结肠切除目前仅推荐用于癌变或无法内镜下切除的高级别上皮内瘤变。
证据等级:Ⅱb;推荐等级:B;陈述同意率:96.3%
随着内镜技术的发展,对IBD的多灶性、异时性癌变是否需行全结肠切除存在争议。我国共识意见建议,对于明确癌变、平坦黏膜上的高级别上皮内瘤变建议全结肠切除;平坦黏膜上的低级别上皮内瘤变建议全结肠切除或随访3~6个月,如仍为同样改变,再行全结肠切除;对于隆起型病变伴上皮内瘤变,建议内镜下切除后密切随访[311]。对于随机活检发现的内镜下不可见的上皮内瘤变,如病理明确为高级别上皮内瘤变,可选择全结肠切除或行高清结肠镜检查以进一步明确病变性质[310,316]。一项系统综述和meta分析显示,术前经内镜和病理检查诊断为可见和不可见高级别上皮内瘤变的病变,在结肠切除时发现同时性癌的比例分别为 13.7%(95% CI: 0.0%~54.1%)和11.4%(95% CI: 4.6%~20.3%),术前内镜和病理检查诊断为可见和不可见低级别上皮内瘤变的病变,在结肠切除时发现同时性癌的比例分别为2.7%(95% CI: 0.0%~7.1%)和2.4%(95% CI: 0.0%~8.5%)[315]。上述数据表明,无论是内镜下可见还是不可见低级别上皮内瘤变,行全结肠切除时发现癌的概率均较低。需进一步开展高质量、大规模研究证实全结肠切除对IBD癌变再发的预防作用。
七、结语
随着科学技术的发展,特别是疾病全程管理和预防理念的更新、检测平台的完善以及技术的进步,更多的结直肠癌可得到控制。尽管目前可通过改善生活习惯、调整饮食结构、癌变筛查、内镜下腺瘤摘除、定期随访以及辅助化疗、放疗、靶向治疗、免疫治疗降低结直肠癌的发生率、转移率和复发率,但尚未达到满意效果。临床工作正期待能发现和开拓分别更适合一般风险人群和高危人群的预防策略。
利益冲突:所有作者均声明不存在利益冲突
执笔者(按编写条款顺序排序):
房静远(上海交通大学医学院附属仁济医院消化内科),李延青(山东大学齐鲁医院消化内科),陈萦晅(上海交通大学医学院附属仁济医院消化内科),刘思德(南方医科大学南方医院消化内科),李鹏(首都医科大学附属北京友谊医院消化分中心),时永全(空军军医大学第一附属医院消化内科),田字彬(青岛大学附属医院消化内科),王邦茂(天津医科大学总医院消化内科),任建林(厦门大学附属中山医院消化内科),盛剑秋(中国人民解放军总医院第七医学中心消化内科),李景南(中国医学科学院 北京协和医学院 北京协和医院消化内科)
参与讨论和定稿专家(按姓氏汉语拼音排序):
白飞虎(海南医学院第二附属医院消化内科),白文元(河北医科大学第二医院消化内科),白永瑞(上海交通大学医学院附属仁济医院放疗科),曹海龙(天津医科大学总医院消化内科),陈东风(陆军军医大学附属大坪医院消化内科),陈红梅(西藏大学医学院),陈旻湖(中山大学附属第一医院消化内科),陈平(内蒙古医科大学附属医院消化内科),陈其奎(中山大学孙逸仙纪念医院消化内科),陈卫昌(苏州大学附属第一医院消化内科),陈烨(南方医科大学深圳医院消化内科),陈萦晅(上海交通大学医学院附属仁济医院消化内科),丁士刚(北京大学第三医院消化内科),董卫国(武汉大学人民医院消化内科),杜奕奇(海军军医大学第一附属医院消化内科),范建高(上海交通大学医学院附属新华医院消化内科),房殿春(陆军军医大学附属西南医院消化内科),房静远(上海交通大学医学院附属仁济医院消化内科),冯缨(《中华消化杂志》编辑部),高峰(新疆维吾尔自治区人民医院消化内科),高琴琰(上海交通大学医学院附属仁济医院消化内科),郜恒骏(生物芯片上海国家工程研究中心),郭晓钟(中国人民解放军北部战区总医院消化内科),韩英(中国人民解放军总医院第七医学中心消化内科),韩泽龙(南方医科大学南方医院消化内科),郝建宇(首都医科大学附属北京朝阳医院消化内科),侯晓华(华中科技大学同济医学院附属协和医院消化内科),胡锦华(山东省立医院消化内科),姜海行(广西医科大学第一附属医院消化内科),金鹏(中国人民解放军总医院第七医学中心消化内科),蓝宇(首都医科大学附属北京积水潭医院消化内科),李景南(中国医学科学院 北京协和医学院 北京协和医院消化内科),李良平(四川省人民医院消化内科),李鹏(首都医科大学附属北京友谊医院消化分中心),李锐(苏州大学第一附属医院消化内科),李岩(中国医科大学附属盛京医院消化内科),李延青(山东大学齐鲁医院消化内科),李兆申(海军军医大学第一附属医院消化内科),林志辉(福建省立医院消化内科),蔺蓉(华中科技大学同济医学院附属协和医院消化内科),刘杰(复旦大学附属华山医院消化内科),刘思德(南方医科大学南方医院消化内科),刘玉兰(北京大学人民医院消化内科),陆伦根(上海交通大学附属第一人民医院消化内科),吕宾(浙江中医药大学附属第一医院消化内科),吕农华(南昌大学第一附属医院消化内科),孟祥军(上海交通大学医学院附属第九人民医院消化内科),缪应雷(昆明医科大学第一附属医院消化内科),聂玉强(广州市第一人民医院消化内科),钱家鸣(中国医学科学院 北京协和医学院 北京协和医院消化内科),任建林(厦门大学附属中山医院消化内科),沈锡中(复旦大学附属中山医院消化内科),盛剑秋(中国人民解放军总医院第七医学中心消化内科),时永全(空军军医大学第一附属医院消化内科),孙刚(中国人民解放军总医院第一医学中心消化内科),唐承薇(四川大学华西医院消化内科),田德安(华中科技大学同济医学院附属同济医院消化内科),田字彬(青岛大学附属医院消化内科),涂水平(上海交通大学医学院附属仁济医院肿瘤内科),庹必光(遵义医科大学附属医院消化内科),万荣(上海交通大学附属第一人民医院消化内科),汪芳裕(中国人民解放军东部战区总医院消化内科),王邦茂(天津医科大学总医院消化内科),王斌(陆军军医大学附属大坪医院消化内科),王承党(福建医科大学附属第一医院消化内科),王吉耀(复旦大学附属中山医院消化内科),王江滨(吉林大学中日联谊医院消化内科),王俊平(山西省人民医院消化内科),王良静(浙江大学医学院附属第二医院消化内科),王蔚虹(北京大学第一医院消化内科),王小众(福建医科大学附属协和医院消化内科),王兴鹏(上海申康医院发展中心),王学红(青海大学附属医院消化内科),吴开春(空军军医大学第一附属医院消化内科),吴小平(中南大学湘雅二医院消化内科),肖英莲(中山大学附属第一医院消化内科),谢渭芬(海军军医大学第二附属医院消化内科),熊华(上海交通大学医学院附属仁济医院消化内科),许洪伟(山东省立医院消化内科),许鸿志(厦门大学附属中山医院消化内科),许乐(北京医院消化内科),杨仕明(陆军军医大学附属新桥医院消化内科),杨幼林(哈尔滨医科大学附属第一医院消化内科),杨云生(中国人民解放军总医院第一医学中心消化内科),游苏宁(中华医学会),于亚男(青岛大学附属医院消化内科),袁耀宗(上海交通大学医学院附属瑞金医院消化内科),曾维政(中国人民解放军西部战区总医院消化内科),翟惠虹(首都医科大学附属北京友谊医院消化分中心),张国新(南京医科大学第一附属医院消化内科),张开光(安徽省立医院消化内科),张晓岚(河北医科大学第二医院消化内科),张志广(天津医科大学第二医院消化内科),郑鹏远(郑州大学第五附属医院消化内科),周丽雅(北京大学第三医院消化内科),周永健(广州市第一人民医院消化内科),周永宁(兰州大学第一医院消化内科),祝荫(南昌大学第一附属医院消化内科),邹多武(上海交通大学医学院附属瑞金医院消化内科),左秀丽(山东大学齐鲁医院消化内科)
资料收集和整理(按姓氏汉语拼音排序):
曹海龙(天津医科大学总医院消化内科),陈敏(空军军医大学第一附属医院消化内科),高琴琰(上海交通大学医学院附属仁济医院消化内科),韩泽龙(南方医科大学南方医院消化内科),金鹏(中国人民解放军总医院第七医学中心消化内科),熊华(上海交通大学医学院附属仁济医院消化内科),许鸿志(厦门大学附属中山医院消化内科),于亚男(青岛大学附属医院消化内科),翟惠虹(首都医科大学附属北京友谊医院消化分中心),邹天慧(上海交通大学医学院附属仁济医院消化内科)

