稻田稗属杂草致病菌的分离与鉴定
张亚鑫,肖 婉,张 峥,韦佳佳,强 胜,陈世国
(南京农业大学杂草研究室,南京 210095)
稗属EchinochloaBeauv.杂草(以下简称稗草)广泛分布于国内外,是稻田的恶性杂草之一,其抗逆性强,与水稻争夺水分、养料,造成严重的经济损失。有研究表明,稻田地上部分总产量随着稗草密度的减少而增加,对稗草的防治力度每增加10%,每公顷稻田产量增加750 kg[1]。然而,稗草Echinochloa crusgalli的防除却是农业生产的一大难题,主要原因是稗草种类多,密度大,群落结构复杂,且与水稻伴生性强,加之长期连续使用同种或同类除草剂,导致稗草已对多种除草剂产生抗性。
生物除草剂是指利用自然界中的生物(包括动物、植物和微生物)或其组织、代谢产物来生产用于除草的生物制剂。根据美国环保署(Environmental Protection Agency,EPA)对生物农药的定义,可以将生物除草剂分为两大类:一类是直接利用完整生物体或者部分活体组织开发的制剂,称为生物除草剂,由于这类产品多数是利用微生物特别是真菌,故亦称为微生物除草剂或真菌除草剂;另一类是利用生物的次生代谢产物开发的制剂,称为生物源除草剂或者生物化学除草剂。近年来,微生物除草剂的成果尤为显著,截至2019年11月,全球已注册的微生物除草剂有十七种,主要集中在毛双孢属Lasiodiplodia、壳球孢菌属Macrophomina、茎点霉属Phoma、核盘菌属Sclerotinia、链格孢属Alternaria、刺盘孢菌属Colletotrichum、柄锈菌属Puccinia等[2]。
我国在生物除草剂研究领域起步较晚,与发达国家相比存在较大差距,但近年来在各级政府部门和科研机构的高度重视下,已建立起了较完善的生物除草剂研究技术体系,其中马唐-画眉草弯孢Curvularia eragrostidis、稗草-新月弯孢C. lunata、稗草-禾长蠕孢菌Helminthosporium gramineumf. sp.echinochloa、稗草-蟋蟀草平脐蠕孢菌Bipolaris eleusines、加拿大一枝黄花-齐整小核菌Sclerotium rolfsii、空心莲子草-假隔链格孢菌Alternanthera phyloxeroides和紫茎泽兰-链格孢菌A. alternata等菌-草体系研究取得的进展,已经形成了一批具有自主知识产权的生物除草剂产品和技术成果[3]。
稗草作为稻田的主要杂草,稻田除草剂的开发也以稗草为主要目标。国内外研究者纷纷对专性寄生稗草的病原菌进行研究,希望从中找到微生物除稗剂的候选目标菌,已采集到的被认为很有希望的稗草生防潜力菌有尖角长蠕孢菌H. monocerasDrechsl、刺盘孢菌C. graminicola、新月弯孢、链格孢菌、稗内脐蠕孢菌Drechslera monoceras、尖角突脐蠕孢菌Exserohilum monoceras和禾长蠕孢菌等,为了得到更适合开发为生物除草剂的菌株,研究者们尝试运用细胞融合、基因工程等手段改良现有菌种,段桂芳[4]利用物理诱变和化学诱变获得产孢量高的内脐蠕孢突变菌株,并尝试将其原生质体与新月弯孢的原生质体融合以获得更理想的菌株,但二者融合的频率较低,需要进一步探索;赵航[5]通过细胞融合技术成功获得新月弯孢与尖角突脐蠕孢的融合子,且该融合子的生长速度和孢子产量等生物学特性介于两亲株之间,其对稗草根长的抑制效果显著高于新月弯孢菌,与尖角突脐蠕孢的效果相当。张正波[6]使用低浓度聚乙二醇甘氨酸溶液将新月弯孢菌与禾长蠕孢菌的原生质体融合,获得4株产毒素量提高的融合子,并确定了融合子CM1-037粗毒素的 10%微乳剂剂型配方,大田试验表明,该制剂与低剂量化学除草剂(苄嘧磺隆+二氯喹啉酸)复合使用对稗草和鸭舌草的防治效果达到80%以上。虽然微生物除稗剂已取得一些进展,但目前市场上暂未有相应的商品化除稗剂,所以稗草病原菌的分离及鉴定仍是一项基础且重要的工作。
为发掘可用于防除稻田稗草的生防菌,本研究以采集自江苏、广西、贵州三省的感病稗草为样本,从中分离筛选出致病力较强的优势菌株,利用形态学特征和分子生物学鉴定技术确定其种类。该研究进一步扩大了稗草致病菌的生物资源,为开发稻田生物除草剂提供了资源储备。
1 材料与方法
1.1 试验材料
稗草病原样本采集:于2019年9月及2020年11月在江苏、广西、贵州三地共采集77份感病稗草样品(表1),健康稗草离体叶片均采自南京农业大学白马基地。
表1 样品采集信息Table 1 Information of samples
1.2 稗草病原菌的分离
将采集的稗草病原样本拍照记录发病情况并镜检,参照方中达[7]所述的组织分离法分离病原菌,剪取病叶的病健交界处5 mm×5 mm大小的叶片,依次用75%酒精、2%次氯酸钠和75%酒精进行表面消毒,每次处理时间为30 s。然后,无菌水处理3次后接种于PSA培养基(土豆200 g,蔗糖20 g,琼脂粉15 g,去离子水定容至1 L)中央,置于28 ℃真菌培养箱倒置培养,每隔12 h观察一次,一旦有菌丝长出就马上转接到新的PSA培养基中。经过单孢分离后获得纯化菌株。
采集健康的稗草叶片,剪取叶片中部用于离体致病性测试,用无菌水冲洗叶段3次后置于白瓷盘(35 cm×45 cm)中,白瓷盘底部铺设两层无菌水润湿的定性滤纸,叶片截断处用无菌水润湿的无菌脱脂棉保湿。纯化的真菌接种于PSA培养基上,于28 ℃黑暗培养3~5 d,在超净工作台上用打孔器从菌落边缘白色菌丝圈处打取菌块(直径5 mm),将菌块接种于稗草叶片正面近中部,以接种无菌PSA培养基琼脂块的稗草叶片为空白对照,用保鲜膜覆盖白瓷盘,置于28 ℃、12 h光暗交替培养箱(E-36HO, PERCIVAL公司,美国)培养4 d。拍照记录叶片病斑特征,测量病斑长度,每个处理3个重复。选取病斑直径大于15 mm的优势菌株保存在PSA斜面上,倒入灭菌石蜡,置于4 ℃冰箱保藏。所有分离得到的致病菌经过离体致病性测试,将保存的优势菌株进行形态学鉴定和分子生物学鉴定。
1.3 病原菌的鉴定
1.3.1 形态学鉴定 10株优势菌株接种于PSA培养基(土豆200 g,蔗糖20 g,琼脂粉15 g,去离子水定容至1 L)中,28 ℃黑暗培养5 d后记录菌落形态。光学显微镜(ZEISS Axio imager M2)下观察菌丝、分生孢子和分生孢子梗等形态特征并拍照。
镜检:用移液枪吸取200 μL温度约为70 ℃的水琼脂培养基(琼脂粉20 g,去离子水定容至1 L)于一块灭菌载玻片上,迅速均匀涂布,使其冷却凝固为大小约为15 mm×15 mm,厚度约为2~3 mm的琼脂方块,再吸取200 μL温度约为70 ℃的稗草汁液培养基(30 g新鲜稗草叶片的汁液,琼脂粉20 g,去离子水定容至1 L)于另一块灭菌载玻片上,具体操作同上。用接种针挑取少量菌丝分别接种于水琼脂培养基和稗草汁液培养基形成的琼脂块中央,将载玻片放入用润湿脱脂棉保湿的培养皿中,28 ℃黑暗培养4~5 d后,黑光灯(20 W,波长365 nm)照射3~5 d。用光学显微镜(ZEISS Axio imager M2)观察菌丝、分生孢子和分生孢子梗等形态特征并拍照,根据《中国真菌志》初步确定病原菌的分类学地位。
1.3.2 分子生物学鉴定 采用BW-GD2416 Fungal gDNA Isolation Kit(杭州倍沃科技有限公司,中国)试剂盒提取病原菌基因组DNA。核糖体DNA内部转录间隔区基因(Internal transcribed spacer,ITS)、甘油醛-3-磷酸脱氢酶基因(Glyceraldehyde-3-phosphate dehydrogenase,GAPDH)和翻译延伸因子(Elongation factor 1-alpha,EF-1α)基因被用作分子标记。以通用引物 ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)/ITS4(5′-TCCTCCGCTTATTGATATGC-3′)特异性扩增ITS基因序列。菌株 JSJY-26-2 通过引物 GPD1(5′-CAAC GGCTTCGGTCGCATTG-3′)和 GPD2(5′-GCCAAGCAGTTGGTTGTGC-3′)特异性扩增GAPDH基因序列、引物 EF1-728F(5′-CATCGAGAAGTTCGAGAAGG-3′)和 EF1-986R(5′-TACTTGAAGGAACCCTTA CC-3′)特异性扩增EF-1α基因序列进行鉴定。25 μL PCR 扩增体系为:2×Hieff®PCR Master Mix(With Dye)(翌圣生物科技(上海)有限公司,中国)12.5 μL,上下游引物各1 μL,1 μL模板DNA,9.5 μL ddH2O。PCR反应条件为:94 ℃预变性5 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min,共30个循环;72 ℃延伸10 min,4 ℃保温。扩增后进行琼脂糖凝胶电泳检测,PCR产物送生物公司进行测序并拼接(生工生物工程(上海)股份有限公司)。将测序得到的基因序列在NCBI中进行BLAST比对,根据比对结果,从GenBank数据库中下载同源性较高的序列或已知菌种序列,用MEGA 7.0中neighbor-joining方法构建系统发育进化树。
2 结果与分析
2.1 稗草病原菌采集、分离与致病性检测
从江苏、贵州、广西三地采集的77份样品,用组织分离法分离得到116株菌。用直径5 mm的打孔器打取菌落边缘菌块,接种到寄主稗草上,病斑直径大于15 mm的有10株,其中,有5株来自江苏省南京市建邺区,有3株来自江苏省南京市溧水区,有2株来自广西省柳州市鹿寨县。
2.2 稗草病原菌形态学鉴定
2.2.1 菌株GXLZ-4-2的菌落及菌体形态 该菌株分离自广西省柳州市鹿寨县的一株感病稗草,病叶呈紫褐色病斑。将该菌株回接到离体健康稗草叶片上,呈紫褐色病斑,随着时间的增加,进一步扩大呈成片黑褐色病斑(图1A);在PSA培养基上菌落呈灰绿色,外围有白色菌丝圈,绒毛状,背面呈黑色,外围淡黄色菌丝圈(图1B);分生孢子梗直或弯曲,深褐色,顶部色浅,长度可达400 μm,产孢节稀疏(图1C);分生孢子褐色,长纺锤形,近中部最宽,向两端变尖,有的在基部稍呈缢缩状,多数具 7~8个假隔膜,孢子长70~130 μm,宽13~20 μm,脐部明显突出(图1D)。根据形态学特征,将分离的病原菌初步鉴定为尖角突脐蠕孢。
2.2.2 菌株GXLZ-7-2的菌落及菌体形态 该菌株分离自广西省柳州市鹿寨县的一株感病稗草,病叶呈紫褐色梭形病斑。将该菌株回接到健康的离体稗草叶片上,呈褐色病斑,随着时间的增加病斑进一步扩大(图1E);在 PSA培养基上菌落呈绿色,外围白色菌丝圈,背面浅绿色,外围呈淡黄色菌丝圈,菌丝绒毛状(图1F);分生孢子梗黑褐色,具隔膜,有分支(图1G);分生孢子簇生,直立或略弯,中间略宽,两端钝圆,具5~8个(多数6个)假隔膜,颜色不一,由浅褐色至深褐色,长40~80 μm,宽10~15 μm(图1H)。根据形态学特征,将分离的病原菌初步鉴定为双色平脐蠕孢B. bicolor。

图1 接种GXLZ-4-2和GXLZ-7-2的叶片发病症状及病原菌的形态特征(标尺:25 μm)Fig. 1 Symptoms of GXLZ-4-2 and GXLZ-7-2 strains and morphological characteristics of pathogens (scale bar: 25 μm)
2.2.3 菌株JSJY-23-1的菌落及菌体形态 该菌株分离自江苏省南京市建邺区采集的一株感病稗草,感病叶片呈褐色轮状病斑。将该菌株回接到健康的离体稗草叶片上,初期呈现红褐色病斑,随着时间的推移,逐步变成大片且深褐色病斑(图2A);在PSA培养基上菌落呈灰绿色,外围有白色菌丝圈,背面呈黑褐色,外围呈黄色菌丝圈,菌丝绒毛状(图2B);菌丝呈褐色,有隔膜,分生孢子梗褐色,顶端颜色稍浅,单生,部分有分枝(图 2C);分生孢子顶生,褐色,顶端颜色较浅,倒棍棒形或近圆柱形,略弯曲,表面光滑,大多具6个假隔膜,长60~130 μm,宽10~15 μm(图2D)。根据形态学特征,将分离的病原菌初步鉴定为稻平脐蠕孢B.oryzae。
2.2.4 菌株JSJY-24-3的菌落及菌体形态 该菌株分离自江苏省南京市建邺区的感病稗草,感病叶片呈红褐色病斑。将该菌株回接到健康的离体稗草叶片上,呈红褐色病斑,后期形成大片的红褐色病斑,边缘黄褐色(图2E);在PSA培养基上菌落呈灰黑色,边缘有白色菌丝圈,背面灰黑色,菌丝绒毛状(图2F);菌丝黑褐色,有隔膜,分生孢子梗黑褐色,顶部屈膝状弯曲(图2G);分生孢子黑褐色,呈棒状,长60~180 μm,宽7~15 μm(图2H)。根据形态学特征,将分离的病原菌初步鉴定为禾长蠕孢菌Setosphaeria.rostrata。
图2 接种JSJY-23-1和JSJY-24-3的叶片发病症状及病原菌的形态特征(标尺:25 μm)Fig. 2 Symptoms of JSJY-23-1 and JSJY-24-3 strains and morphological characteristics of pathogens (scale bar: 25 μm)
2.2.5 菌株JSJY-33-9的菌落及菌体形态 该菌株分离自江苏省南京市建邺区的一株感病稗草,病叶呈棕褐色病斑。将该菌株回接到健康的离体稗草叶片上,病斑初期呈褐色,后期呈大片黄褐色病斑(图3A);在PSA培养基上菌落分圈明显,内圈呈深灰色,由内向外颜色依次变浅,背面内圈为黑褐色,外圈黄褐色,最外圈白色,呈致密绒毛状(图 3B);菌丝褐色,具隔膜,分生孢子梗褐色,具隔膜,大多有分支,孢子梗顶端簇生分生孢子(图3C);分生孢子短棒状,具3~5个假隔膜(3个居多),颜色不一,由浅褐色至褐色,长20~38 μm,宽5~11 μm(图3D)。根据形态学特征,将分离的病原菌初步鉴定为澳大利亚弯孢C.australiensis。
图3 接种JSJY-33-9和JSJY-37-9的叶片发病症状及病原菌的形态特征(标尺:25 μm)Fig. 3 Symptoms of JSJY-33-9 and JSJY-37-9 strains and morphological characteristics of pathogens (scale bar: 25 μm)
2.2.6 菌株JSJY-37-9的菌落及菌体形态 该菌株分离自江苏省南京市建邺区的一株感病稗草,病叶呈红褐色梭形病斑。将该菌株回接到健康的离体稗草叶片上,初期病斑呈红褐色,随着时间的增加呈大片褐色病斑(图3E);在PSA培养基上菌落呈橄榄绿色,背面黑色,菌丝稀薄(图3F);菌丝黑褐色,有隔膜,分生孢子梗黑褐色,具隔膜,偶有分支,顶部屈膝状弯曲(图3G);分生孢子黄褐色,颜色均一,梭形,5~10个假隔膜,以6~8个为常见,长70~130 μm,宽13~18 μm,脐部明显突出(图3H)。根据形态学特征,将分离的病原菌初步鉴定为梭形突脐蠕孢E.fusiforme。
2.2.7 菌株JSJY-26-2的菌落及菌体形态 该菌株分离自江苏省南京市建邺区的一株感病稗草,感病叶片呈红色病斑。将该菌株回接到健康的离体稗草叶片上,初期呈褐色病斑,随着时间的增加,呈大片黑褐色病斑(图4A);在PSA培养基上菌落呈灰白色,背面分圈明显,由外至内黄褐色至黑褐色,菌丝毯状(图4B);菌丝黄褐色,有隔膜,在稗草汁液培养基上黑光灯照射3~5 d产生分生孢子器,分生孢子器近球形,黄褐色,直径50~70 μm(图4C);分生孢子卵圆形,无隔膜,直径1.5~3 μm(图4D)。根据形态学特征,将分离的病原菌初步鉴定为亚隔孢壳属Didymella真菌。
2.2.8 菌株JSLS-7-4的菌落及菌体形态 该菌株分离自江苏省南京市溧水区的一株感病稗草,病叶呈黑色病斑。将该菌株回接到健康的离体稗草叶片上,初期呈黄褐色病斑,随着时间的增加病斑呈大片黄褐色(图4E);在PSA培养基上菌落呈浅绿色,外围有白色菌丝圈,背面黑褐色,菌丝致密绒毛状(图4F);菌丝黑褐色,有隔膜(图4G);在稗草汁液培养基上黑光灯照射3~5 d产生黑色葡萄状厚垣孢子,单个厚垣孢子直径12~19 μm(图4H)。根据形态学特征,将分离的病原菌初步鉴定为亚隔孢壳属真菌D. americana。
图4 接种JSJY-26-2和JSLS-7-4的叶片发病症状及病原菌的形态特征(标尺:25 μm)Fig. 4 Symptoms of JSJY-26-2 and JSJY-7-4 strains and morphological characteristics of pathogens (scale bar: 25 μm)
2.2.9 菌株JSLS-3-4的菌落及菌体形态 该菌株分离自江苏省南京市溧水区的感病稗草,稗草病叶呈紫褐色病斑。将该菌株回接到健康的离体稗草叶片上,初期病斑呈黑褐色,随着时间的增加,呈大片的黑色病斑,周围呈黄褐色(图5A);在PSA培养基上菌落呈黑褐色,背面呈黑色,外围淡黄色菌丝圈,菌丝绒毛状(图5B);菌丝褐色,具隔膜,分生孢子梗产孢点凸起(图5C);分生孢子具3个隔膜,隔膜颜色较深,自基部数至第3个细胞最大,分生孢子呈弯曲状,孢子两端颜色较浅,分生孢子长18~25 μm,宽7~12 μm(图5D)。根据形态学特征,将分离的病原菌初步鉴定为新月弯孢。
2.2.10 菌株JSLS-3-9的菌落及菌体形态 该菌株分离自江苏省南京市溧水区的一株感病稗草上,病叶呈紫褐色病斑。将该菌株回接到健康的离体稗草叶片上,初期呈红褐色病斑,后期呈大片红褐色病斑且边缘为黄褐色(图5E);在PSA培养基上菌落分圈明显,内圈呈灰色,外圈呈红褐色,最外圈呈白色菌丝圈,背面内圈呈黑色,外圈呈红色,菌丝致密绒毛状(图5F);分生孢子器近球形,黑色,直径径50~70 μm(图5G);分生孢子椭圆形,直径3~5 μm,无隔膜(图5H)。根据形态学特征,将分离的病原菌初步鉴定为高粱附球菌Epicoccum.sorghinum。
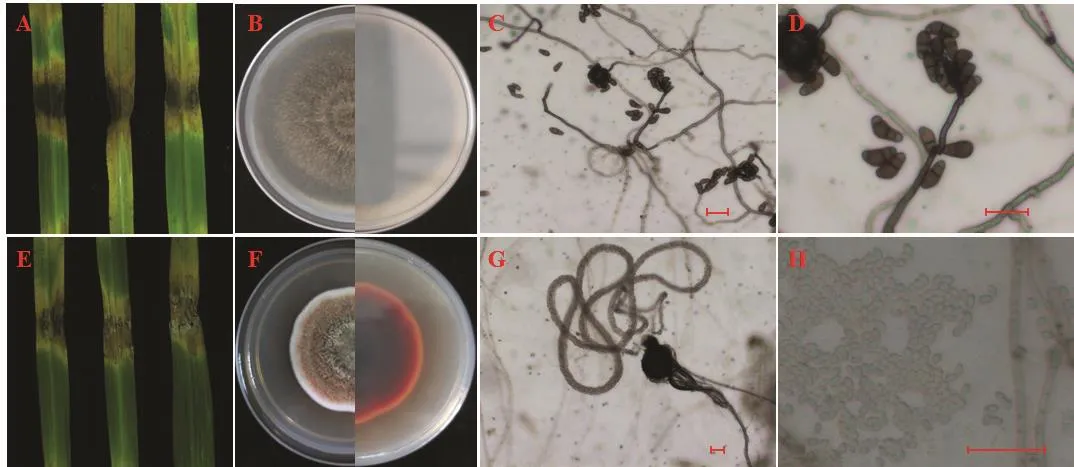
图5 接种JSLS-3-4和JSLS-3-9的叶片发病症状及病原菌的形态特征(标尺:25 μm)Fig. 5 Symptoms of JSLS-3-4 and JSLS-3-9 strains and morphological characteristics of pathogens (scale bar: 25 μm)
2.3 分子生物学鉴定
利用ITS1克隆目的DNA片段,测序结果在NCBI上进行比对,从结果中下载同源性较高的序列(变种除外)构建系统进化树(图6)。测序结果表明,GXLZ-7-2的测序结果与GenBank上双色平脐蠕孢(Accession No. MF490804.1)的ITS核酸序列同源性最高,达到98.5%,且在进化树上与双色平脐蠕孢聚在一大支上,支持率为91%;JSJY-23-1的测序结果与GenBank上稻平脐蠕孢(Accession No. MT605002.1)的ITS核酸序列同源性最高,达到99.82%,且在进化树上与稻平脐蠕孢聚在一大支上,支持率为 99%;JSJY-33-9的测序结果与GenBank上澳大利亚弯孢(Accession No. MN173135.1)的ITS核酸序列同源性最高,达到 100%,且在进化树上与澳大利亚弯孢聚在一大支上,支持率为 99%;JSLS-3-4的测序结果与GenBank上新月弯孢(Accession No. KU877620.1)的ITS核酸序列同源性最高,达到99.82%,且在进化树上与新月弯孢聚在一大支上,支持率为100%;JSJY-24-3的测序结果与GenBank上禾长蠕孢菌(Accession No. KP340114.1)的ITS核酸序列同源性最高,达到100%,且在进化树上与禾长蠕孢菌聚在一大支上,支持率为100%;GXLZ-4-2的测序结果与GenBank上尖角突脐蠕孢(Accession No. LT837473.1)的ITS核酸序列同源性最高,达到96.89%,且在进化树上与尖角突脐蠕孢聚在一大支上,支持率为99%;JSJY-37-9测序结果与GenBank上梭形突脐蠕孢(Accession No. LT837456.1)的ITS核酸序列同源性最高,达到100%,且在进化树上与梭形突脐蠕孢聚在一大支上,支持率为100%;JSLS-3-9的测序结果与GenBank上高粱附球菌(Accession No. MK841419)的ITS核酸序列同源性最高,达到100%,且在进化树上与高粱附球菌聚在一大支上,支持率为99%;JSLS-7-4测序结果与GenBank上亚隔孢壳属D.americana(Accession No.MK495981.1)的ITS核酸序列同源性最高,达到100%,且在进化树上与亚隔孢壳属D.americana聚在一大支上,支持率为 100%。由此可以进一步判定 GXLZ-7-2为双色平脐蠕孢;JSJY-23-1为稻平脐蠕孢;JSJY-33-9为澳大利亚弯孢;JSLS-3-4为新月弯孢;JSJY-24-3为禾长蠕孢菌;GXLZ-4-2为尖角突脐蠕孢;JSJY-37-9为梭形突脐蠕孢;JSLS-3-9为高粱附球菌;JSLS-7-4为亚隔孢壳属D. americana。
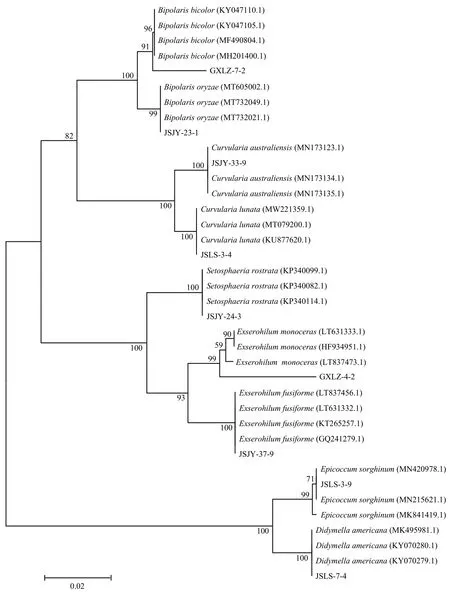
图6 基于ITS序列构建9株优势菌株的系统发育树Fig. 6 Phylogenetic tree of nine dominant strains based on ITS sequence
对于菌株JSJY-26-2使用ITS序列不能很好地鉴定到种,利用EF1-728F/EF1-986R和GPD1/GPD2引物克隆目的DNA片段,测序结果在NCBI上进行比对,从结果中下载同源性较高的序列(变种除外)构建系统进化树,测序结果表明,JSJY-26-2与GenBank上亚隔孢壳属D.americana(Accession No. MN554764.1)以及亚隔孢壳属D.pinodella(Accession No. MN554375.1)的EF-1α核酸序列同源性较高,分别达到86.51%和85.86%,基于EF-1α序列构建的菌株系统发育树结果显示与亚隔孢壳属D. pinodella和亚隔孢壳属D.americana同聚为一支,支持率为87%(图7A);JSJY-26-2与GenBank上亚隔孢壳属D.pinodella(Accession No. MK532379.1)的GAPDH核酸序列同源性较高,达90.52%,基于GAPDH序列构建的菌株系统发育树结果显示与亚隔孢壳属D.pinodella同聚为一支,支持率为98%(图7B)。因此,依据两对引物的结果判定菌株JSJY-26-2为亚隔孢壳属D.pinodella。
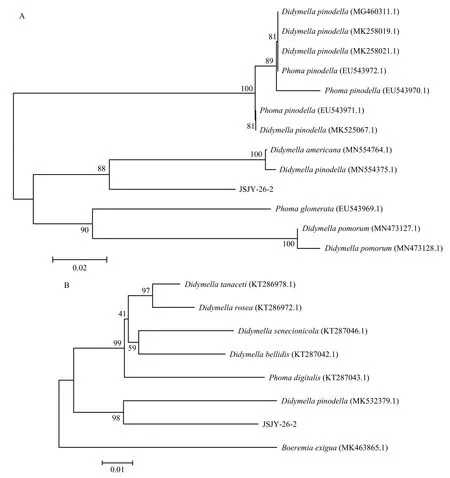
图7 基于EF-1α(A)和GAPDH(B)序列构建菌株JSLS-26-2的系统发育树Fig. 7 Phylogenetic tree of strain JSJY-26-2 based on EF-1α (A) and GAPDH (B) sequences
3 讨论
稗草作为稻田的恶性杂草,在不同种植模式的稻田中均会出现,严重影响水稻的品质和产量。目前对于稗草的防除主要利用化学除草剂,然而,一些老的化学除草剂的逐步淘汰,开发、注册新除草剂成本高昂,以及抗除草剂稗草的出现使人们寻求防除稗草的新策略-生物除草剂。我国地大物博,微生物资源十分丰富,开发真菌除草剂前景广阔,因此丰富稗草病原菌资源十分必要。
目前,国内已分离到的稗草致病菌有新月弯孢、画眉草弯孢、橙黄树座霉菌Dendrodochium aurantiacum、紫附球菌E.purpurascens、棒弯孢C.clavata[8]、链格孢菌、尖角突脐蠕孢、稗内脐蠕孢[9]、禾长蠕孢稗草专化型[10]、尖角长蠕孢菌[11]、麦根腐平脐蠕孢B. sorokiniana、薏苡平脐蠕孢B.coicis[12]、露湿漆斑菌Myrothecium roridum[13]、密实链格孢A.compacta、出芽短梗霉Aureobasidium pullulans、澳大利亚平脐蠕孢B.australiens、同形平脐蠕孢B.homomorphus、玉米小斑病菌B.maydis、间型弯孢霉C.intermedia、梭形突脐蠕孢、嘴凸突脐蠕孢E.rostratum、稻黑孢球菌Nigrospora oryzae[14]、尖孢枝孢菌Cladosporium oxysporum[15]、黑附球霉菌E.nigrum、纸皮思霉有性型Leptasphaeruline chartarum、刺盘孢属、茎点霉属[16],其中露湿漆斑菌、禾长蠕孢稗草专化型、新月弯孢菌菌株J15(2)、链格孢菌、尖角突脐蠕孢菌和稗内脐蠕孢菌已被列为稗草生防菌,具有进一步开发为生物除草剂的可能。
自然界有着丰富的生防微生物资源,只有极少数被发现和利用。所以新病原菌的采集、分离、鉴定和评价仍然是一项必要工作。本研究共分离得到 10株对稗草具有强致病力的优势菌株,并结合已有的相关报道来对这10株菌的作物安全问题进行初步评估。
新月弯孢、禾长蠕孢菌和尖角突脐蠕孢三者均为被研究得较系统的稗草生防潜力菌。新月弯孢霉菌是禾本科常见致病菌,目前已从稗草、马唐中分离得到过,在一定条件下,可对玉米、水稻、辣椒等作物造成危害。张欣芳等[17]的研究表明新月弯孢的致病性强弱与其遗传背景具有相关性,所以,不同遗传背景的新月弯孢的寄主范围和致病力强弱有所不同。倪汉文等[18]从稗草上分离得到新月弯孢菌株 B6,其对稗草产生强烈的致病性,且对水稻的安全性极高,田间试验表明,浓度为5×106孢子/mL的孢子悬浮液对稗草鲜重的抑制率高达90%。赵杏利[14]从稗草分离得到的新月弯孢菌株对稗草和马唐的致病性较弱。韦韬等[19]研究发现,新月弯孢J15杀草谱较窄,仅对稗草有致病作用,且对水稻安全,与精噁唑禾草灵、二氯喹啉酸混用可明显降低两种除草剂的用量。尖角突脐蠕孢可造成稗草叶枯病,国外研究者已对其寄主范围进行了研究,结果表明尖角突脐蠕孢仅对玉米这一重要经济作物有轻度感染,对稗属植物均有很强的致病性[20]。黄世文等[21]研究结果表明尖角突脐蠕孢菌在改良 Fries培养液中的发酵滤液对稗草根生长的抑制率高达82.6%。黄世文[10]首次从稗草上分离得到禾长蠕孢菌,并确定其为稻田稗草生防潜力菌,已初步开发出两种微生物除草剂,一个是以孢子悬浮剂为主要成分的“克稗霉l号”;另一个是以稗草基质为主要原料的固体培养基生产的孢子制成的粉剂“克稗霉2号”,田间试验表明,克稗霉能有效防除稗草,在一定范围内,防除效果随浓度的增加而增大。因此,新月弯孢、尖角突脐蠕孢、禾长蠕孢菌具有成为开发为防除稻田稗草的生物除草剂的可能。
稻平脐蠕孢和梭形突脐蠕孢为稗草常见致病菌,但研究的并不深入。稻平脐蠕孢可导致水稻[22]和茭白胡麻叶斑病[23],但有将其作为生防潜力菌的报道。张猛等[24]从河南采集的马唐病叶上分离得到稻平脐蠕孢菌株,致病性分析结果表明,其是一种有望用于田间杂草生物防治的潜在真菌资源。耿锐梅等[25]从李氏禾上分离得到稻平脐蠕孢和稻平脐蠕孢有性型,二者均对李氏禾有很强的致病力,且对水稻、玉米、黄瓜及番茄等主要作物安全,可用于防治李氏禾。韩川[26]从稻田杂草中分离的稻平脐蠕孢菌株L5对稗草有较强的致病性,对水稻等主要农作物均不致病,具有进一步开发为稻田生物除草剂的潜力。因此,该菌株具有成为稻田稗草生防菌的可能性。梭形突脐蠕孢的寄主为禾本科植物,已在稗草、荩草、马唐、狗尾草、牛筋草上相继报道过[14-16,27]。赵杏利等[15]分别从马唐和牛筋草上分离到两株梭形突脐蠕孢,并进行了致病性测试。结果表明,从牛筋草上分离的菌株能引起稗草中度发病。何伟等[16]从稗草上分离得到3株梭形突脐蠕孢菌株,其中有2株对稗草有较强的致病力,但对水稻的安全性未知。因此,梭形突脐蠕孢对水稻的安全性有待进一步测试,能否作为稻田稗草生防菌有待进一步评估。
澳大利亚弯孢霉地理分布和寄主范围十分广泛,已报道在印度、伊拉克、巴基斯坦、埃及、智利、泰国和中国等地引起阿拉伯胶树、花生、小豆、番茄、马铃薯、玉米、高粱、三叶草和西印度竹芋等植物病害。该菌虽有除草潜力,但会引起禾本科作物叶疫(斑)病和种子腐烂病,给农业经济造成巨大损失[28]。因此,澳大利亚弯孢霉开发为防除稻田稗草的生物除草剂的可能性较低。
双色平脐蠕孢在国内外的多种植物中被分离得到,如泰国的牛筋草[29]和巴西的小麦[30]等。陈世国等[31]从茶园的牛筋草上分离得到一株双色平脐蠕孢SYNJC-2-2,作物安全性测试表明,该菌株可用于防控牛筋草、狗尾草、葇枝莠竹等禾本科杂草,在棉花、油菜、芝麻、烟草、 蔬菜等作物田、茶园和中药园中可安全使用,表明该菌株具有开发为防除牛筋草等禾本科杂草生物除草剂的潜力。但是,一些研究表明双色平脐蠕孢菌可分泌4种毒素cochlioquinone A、cochlioquinone B、stemphone和isocochlioquinone A,且这4种毒素可以抑制水稻等植物的根系生长[32]。因此,双色平脐蠕孢开发为防除稻田稗草的生物除草剂的可能性较低。
高梁附球菌是热带和亚热带地区普遍存在的病原菌。其最早在高粱叶中发现,液体培养时可分泌6种毒素抑制高粱根系生长,影响高粱产量[33],随后在玉米上分离得到,对禾本科作物造成危害[34]。但其产生的次级代谢产物具有一定的应用价值,高梁附球菌分泌的细交链孢菌酮酸(Tenuazonic aid,TeA)具有除草的作用。田间试验结果表明,细交链孢菌酮酸在棉田中对马唐和反枝苋这两种主要杂草具有较好的防除效果,且对棉花无影响,是一种优秀的棉田除草剂[35]。因此,该菌开发为防除稻田稗草的生物除草剂的可能性较低,但可对其产生的次级代谢产物进行开发利用。
亚隔孢壳属是与狭义茎点霉属有关联的有性型属[36]。一些茎点霉属真菌具有生物防治的潜力,草茎点霉P.herbarum、短小茎点霉P.exigua和巨口茎点霉P. macrostoma作为生物除草剂被开发应用于防治蒲公英、铁线莲等阔叶类杂草。因此,亚隔孢壳属真菌也具有发展成为生物除草剂的可能。亚隔孢壳属D.americana为首次从稗草上分离得到的病原物,国外有研究者在利马豆[37]中分离得到,国内研究者发现其可引发玉米茎腐病[38],对其他作物的安全性未知。因此,其是否能作为稻田稗草生防菌还有待进一步研究。亚隔孢壳属D.pinodella为第一次从稗草上分离得到的病原物,俄罗斯学者在丝路蓟上分离得到[39],在我国作为内生真菌在砂生槐上分离得到[40]。因此,其能否成为稻田稗草生防菌还有待评估。
综上所述,本研究分离得到的澳大利亚弯孢、双色平脐蠕孢、高粱附球菌、亚隔孢壳属D.american和亚隔孢壳属D.pinodella均为国内首次从稗草中分离得到,丰富了我国稗草病原菌生物资源。从作物安全性考虑,本研究分离得到的 10株优势菌株中高粱附球菌、双色平脐蠕孢和澳大利亚弯孢可造成禾本科作物的严重病害,开发为防除稻田稗草的生物除草剂的可能性较低;梭形突脐蠕孢、亚隔孢壳属D.americana和亚隔孢壳属D.pinodella对水稻的安全性未知,是否具有发展成为防除稻田稗草的生物除草剂的可能还有待评估,新月弯孢、尖角突脐蠕孢、禾长蠕孢菌、稻平脐蠕孢能有效地防除稗草且对水稻等主要作物安全,有望研发为防除稻田稗草的生物除草剂。

