石墨相氮化碳在重金属吸附中的应用*
洪 亮,杭 贵,汪 斌, 张 慧,蔡 亚
(江苏理工学院化学与环境工程学院,江苏 常州 213001)
重金属污染会造成植物枯萎、大气污染、水体中生物的死亡,若进入人体,则会对人体造成伤害,严重时可导致死亡[1-3]。废水中重金属污染由于其生物累积性、高毒性、易致癌[4]等特点,受到了国内外学者的广泛关注。铜等重金属离子是废水中典型的重金属污染物,主要来源于镀件洗涤、钢铁厂酸洗等[5]生产过程。
目前,若干种技术用于处理废水中重金属,例如吸附法,中和法、离子交换法、硫化法等。其中吸附法具有适用范围广、反应速度快、去除效率高、环境友好[6]等特点。目前吸附材料有活性炭、沸石、壳聚糖及其衍生物。其中,石墨相氮化碳材料具有良好的化学稳定性、较好的生物兼容性、较高的硬度[7-8],并且该材料平均孔径小,孔道结构更集中,孔隙率高,在吸附水中重金属离子方面显示了良好的潜力[9]。
Zhu等[10]对三聚氰胺直接焙烧得到氮化碳,利用该材料吸附Pb2+,制备的氮化碳对Pb2+最大吸附量为7.4 mg/g。王化东[11]则以三聚氰胺为原料,氯化锂为致孔剂制备多孔氮化碳并用于吸附Pb2+,吸附量最高可达28.6 mg/g。Beygli等[12]以羟基磷灰石改性氮化碳粉末并利用其吸附Cu2+,吸附量最高可达74.5 mg/g。
从以上分析中可以看出,石墨相氮化碳具有良好的金属离子吸附性能,并且可以通过不同升温速率或结合其他物质改变其吸附金属离子容量。本文以热改性法对石墨相氮化碳进行改性,用于水中Cu2+的吸附研究。
1 实 验
1.1 材 料
三聚氰胺(C3H6N6,AR)、硫脲(Urea,AR)由上海凌峰化学试剂有限公司提供;三水合二乙基二硫代氨基甲酸钠(铜试剂,AR)、三水合硝酸铜(Cu(NO3)2·3H2O,AR)由国药集团化学试剂有限公司提供;本实验采用的其他化学试剂由市场采购且为分析纯;实验用水为蒸馏水。
1.2 热改性氮化碳的制备
将硫脲放置在带盖坩埚中,然后将坩埚置于马弗炉在室温下以10 ℃/min的升温速率调节温度至520 ℃,并保温4 h,然后冷却至室温得到石墨相氮化碳(g-C3N4);对g-C3N4进行热改性,将其放置在带盖坩埚中,置于马弗炉中以10 ℃/min的升温速率调节温度至520 ℃,并保温10 h,然后冷却至室温得热改性氮化碳(g-C3N4-M)[13]。
1.3 材料表征
X射线粉末衍射(XRD)测试在荷兰帕纳科X’PERT POWDER型X射线衍射仪上进行,电流为40 mA,电压为40 kV,扫描范围为10°~90°;SEM图像测试在日本JEM-2100型扫描型电子显微镜进行,加速电压为200 kV;氮气吸脱附测试在美国康塔2MP型全自动多站比表面和孔隙度分析仪上进行,采用BET方程计算样品的比表面积,采用BJH方法计算孔径分布曲线;FT-IR光谱测试在美国IR200型红外光谱仪进行,采用KBr压片,光谱范围500~3500 cm-1,分辨率0.8 cm-1。
1.4 氮化碳吸附影响因素研究
将15 mg的g-C3N4或g-C3N4-M置于双层水浴烧杯中,加入40 mL Cu2+溶液,用稀硝酸溶液或NaOH溶液调节金属离子溶液初始pH值。在磁力搅拌作用下考察吸附因素溶液pH值(2.0~7.0),吸附温度(10~30 ℃),金属离子浓度(Cu2+:80~480 mg/L),吸附时间(0~24 h)对石墨相氮化碳吸附金属离子的影响。吸附一段时间取上清液,离心后用酶标仪测定吸光度,对于Cu2+浓度的测定,设置测定波长为450 nm, Cu2+采用二乙基二硫代氨基甲酸钠(铜离子试剂)染色[14]。
吸附量计算公式为:
(1)
1.5 吸附动力学实验
取400 mg/L的Cu2+溶液40 mL与15 mg石墨相氮化碳材料混合置于双层水浴烧杯中,调节溶液pH为5,控制温度为30 ℃,磁力搅拌进行Cu2+的吸附,在0~24 h取上清液,离心后用酶标仪测定吸光度,计算吸附量。采用拟二阶动力学模型[15]对吸附过程进行拟合。
(2)
1.6 石墨相氮化碳材料对重金属离子的脱附再生实验
将吸附饱和的氮化碳置于双层水浴烧杯中并往其中加入一定体积的pH=2的硝酸,控制温度在30 ℃,磁力搅拌2 h进行重金属离子的脱附,真空干燥后对脱附后的氮化碳重复进行吸附实验,考察其再生性能。
2 实验结果与讨论
2.1 石墨相氮化碳结构表征
2.1.1 XRD表征
图1是石墨相氮化碳(g-C3N4)和热改性的石墨相氮化碳(g- C3N4-M)XRD图。从图中可以看出,氮化碳有两个峰值,分别为2θ=13.6°和2θ=27.4°,分别对应于氮化碳层间堆积和层内堆积产生的衍射峰[16],表明氮化碳为层堆积石墨相,热改性未改变其晶体结构。

图1 石墨相氮化碳的XRD图
2.1.2 氮化碳的FT-IR表征
对g-C3N4和g-C3N4-M所带官能团进行傅里叶变换红外光谱测试。由图2可以看出热改性前后,氮化碳均具有本身特征峰,808 cm-1为三嗪单元的典型的特征峰,1319 cm-1、1386 cm-1和1472 cm-1为典型的C=N以及C-N杂环的伸缩振动峰,3165 cm-1为N-H的伸缩振动峰,该分析结果与文献记载一致[17]。

图2 氮化碳红外光谱
2.1.3 石墨相氮化碳的形貌分析
图3展示了g-C3N4和g-C3N4-M的SEM图。从图3可以看出,所制备的石墨相氮化碳均多孔片状堆叠的表面形貌,且热改性未改变其表面形貌。

图3 石墨相氮化碳的SEM图
2.1.4 石墨相氮化碳的BET分析
图4(a)表示g-C3N4和g-C3N4-M的孔径分布图。由图4可见石墨相氮化碳材料孔径分布集中,从表1中可以看出,g-C3N4和g-C3N4-M的孔径分别为2.58 nm和2.88 nm。图4(b)表示用不同原料制备的纳米片状氮化碳材料的N2吸附-脱附曲线图。从图4中可以看出在相对压力为0.1~0.9范围内具有明显的回滞环,表明所制备的石墨相氮化碳均是介孔材料[18]。由表1可知,g-C3N4和g-C3N4-M的比表面积分别为129.210 m2·g-1和153.109 m2·g-1。与未热改性的g-C3N4比较,g-C3N4-M的比表面积、孔容和孔径得到一定的提升。


图4 石墨相氮化碳BJH孔径分布(a)和N2吸附-脱附等温线(b)

表1 石墨相氮化碳孔径、比表面积以及孔容数据
2.2 石墨相氮化碳吸附Cu2+影响因素实验
2.2.1 溶液pH对Cu2+吸附的影响
溶液中的pH对吸附剂吸附性能有着很大的影响,它不但会影响重金属离子在水溶液中的存在形态,也会影响吸附剂表面的性质。在吸附剂15 mg,吸附温度30 ℃,吸附时间1 h,40 mL含Cu2+的初始浓度分别为200 mg/L进行pH影响实验。由图5(a)和5(b)中可以看出,在pH为2~5范围内,随着pH的升高,氮化碳表面电荷由正变为负,静电吸附作用带来吸附量的增加,而在pH为5~7范围内,随着pH的继续升高,溶液中的金属离子会以氢氧化物的形式存在,吸附量逐渐减少。g-C3N4对Cu2+最大吸附量分别为78.5 mg/g;g-C3N4-M对Cu2+最大吸附量分别为83.7 mg/g。因此本实验确定溶液pH值为5。
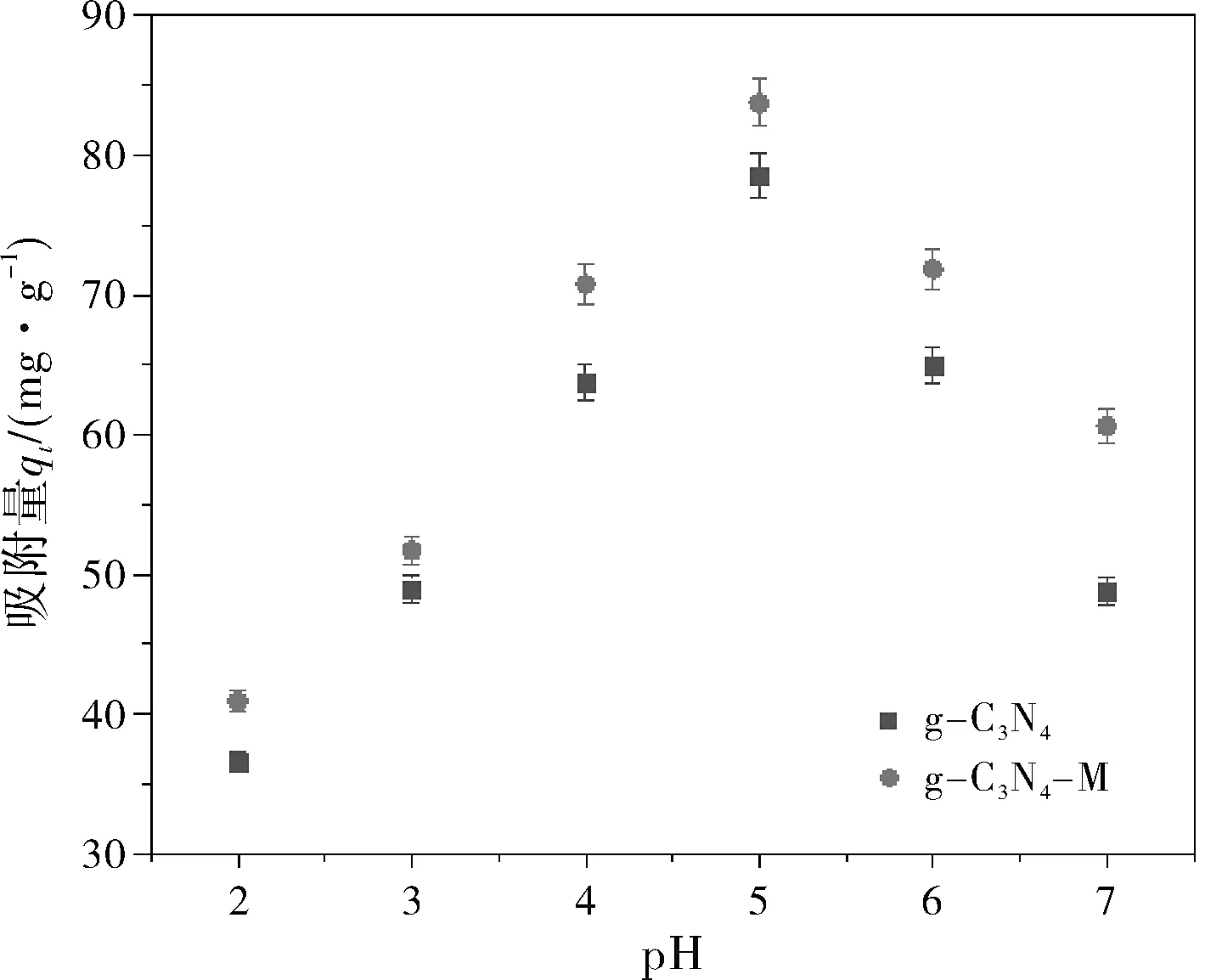
图5 pH对石墨相氮化碳吸附金属离子的影响
2.2.2 温度对Cu2+吸附的影响
在吸附剂15 mg,溶液pH为5,吸附时间1 h,40 mL含Cu2+的初始浓度为200 mg/L进行温度影响实验。在氮化碳上的吸附随温度和时间的变化如图6(a)和6(b)所示。在10~30 ℃温度范围内,随温度的升高,Cu2+在氮化碳上的吸附量逐渐增加,达到最大吸附量,而当温度继续上升时,吸附量则呈现下降趋势。这是由于起初温度较低时氮化碳分子运动缓慢,随着温度的升高,分子运动加快,此时吸附速率大于脱附速率,吸附量总体呈现上升趋势,而温度继续升高时,分子运动继续加剧,此时吸附速率低于脱附速率,吸附量总体上呈现下降趋势,所以氮化碳吸附重金属的最佳温度为303 K。
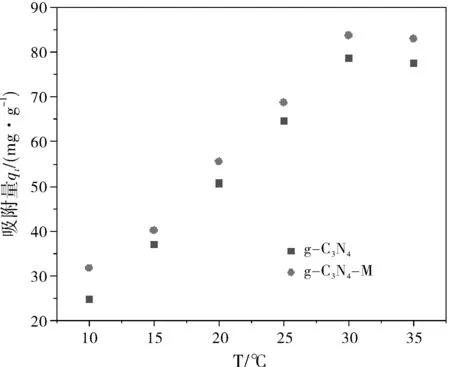
图6 温度对金属离子在石墨相氮化碳吸附的影响
2.2.3 初始离子浓度对Cu2+吸附的影响
在有效吸附量不确定的情况下,为了降低成本,确定适宜重金属离子浓度显得尤其必要。在吸附剂15 mg,溶液pH为5,吸附时间1 h,吸附温度为30 ℃,40 mL含金属离子溶液。如图7所示,在Cu2+溶液浓度为80~480 mg/L范围内,随着浓度的升高,吸附量逐渐增加。从图7中可以看出,当金属离子继续增加时,吸附量增加不明显。因此实验确定Cu2+的初始浓度分别为400 mg/L。
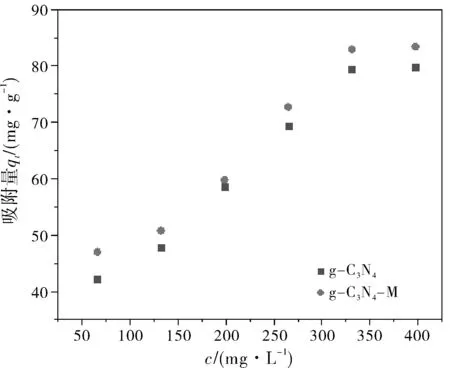
图7 溶液浓度对金属离子在石墨相氮化碳吸附的影响
2.2.4 吸附时间对Cu2+吸附的影响
从图8(a)和8(b)中可以看出,吸附时间达到9 h后,吸附量变化不大,因此最佳吸附时间是9 h。

图8 吸附时间对金属离子在石墨相氮化碳吸附的影响
从以上吸附因素影响分析中可以看出,热改性的石墨相氮化碳(g-C3N4-M)比未改性的石墨相氮化碳(g-C3N4)有更好的金属离子吸附性能,在15 mgg-C3N4-M和40 mL Cu2+浓度为400 mg/L,吸附温度30 ℃,吸附时间为9 h,g-C3N4-M对Cu2+的吸附量达到最大,为136.7 mg/g。
2.3 吸附动力学研究
在上面吸附因素研究中可以看出,热改性的氮化碳(g-C3N4-M)具有良好的吸附性能。在下面研究中,以g-C3N4-M为研究对象,考察金属离子的吸附动力学和等温吸附过程。由图9拟二阶吸附动力学图以及表2拟合动力学参数表可以发现,g-C3N4-M对Cu2+吸附动力学曲线R2值接近1,说明Cu2+在g-C3N4-M上的吸附遵循拟二阶动力学模型,吸附过程主要以化学吸附为主[19],且Cu2+平衡时理论吸附量为144.7 mg/g,与实验结果非常接近。

图9 氮化碳对金属离子的吸附动力学图

表2 改性石墨相氮化碳吸附金属离子动力学数据
2.4 g-C3N4-M的重复吸附实验
从图10可以发现,在循环使用9次后g-C3N4-M对Cu2+的最佳吸附量从136.7 mg/g降低到121.2 mg/g。以上结果表明,g-C3N4-M有良好的重复使用性。

图10 氮化碳再生性能
3 结 论
(1)热改性方法主要利用马弗炉中少量氧气对石墨相氮化碳进行氧刻蚀,提升石墨相氮化碳的孔容、孔径和比表面积,热改性的石墨相氮化碳孔径有2.88 nm、孔容0.582 cm3·g-1以及比表面积153.1 m2·g-1。
(2)热改性石墨相氮化碳对Cu2+的最佳吸附量为136.7 mg/g。且经过9次吸附-解吸过程后对Cu2+、的吸附量仍达到121.2 mg/g,具有良好的重复使用性能。
(3)热改性石墨相氮化碳对Cu2+的吸附行为遵循拟二阶动力学。

