2020年度输血医学科研新进展
贺敏威 孙苏静 周欠欠 王小慧 詹林盛
2020年是特殊的一年,新冠肺炎的大流行对全球血液安全保障造成了巨大的挑战,同样对输血医学科研进展产生一定程度的影响。但总体上看,本年度国内外输血领域依然取得了诸多代表性的研究新进展,特别是新冠肺炎恢复期血浆治疗、新冠肺炎病毒与血液安全等研究取得了显著的进展。除了Transfusion等输血医学专业期刊外,本年度在Nature、Blood、PNAS、JAMA、NEJM等国际主流期刊发表了一系列输血医学重要科研成果(图1)。我国输血领域专家也在JAMA、Nature Communications、Science Advances等国际主流期刊发表了重要研究进展,同时我国输血同行在Transfusion、Vox Sang等表1所列的输血医学专业期刊发表论文79篇,总数超过往年,显示我国科研工作者在输血医学领域取得的研究成果数量和质量稳中有进。本文就2020年度新冠病毒与输血医学相关研究、输血医学基础研究、输血医学相关前沿交叉技术研究、临床输血等方面的部分新进展作一简要概述。

图1 输血医学领域部分代表性论著
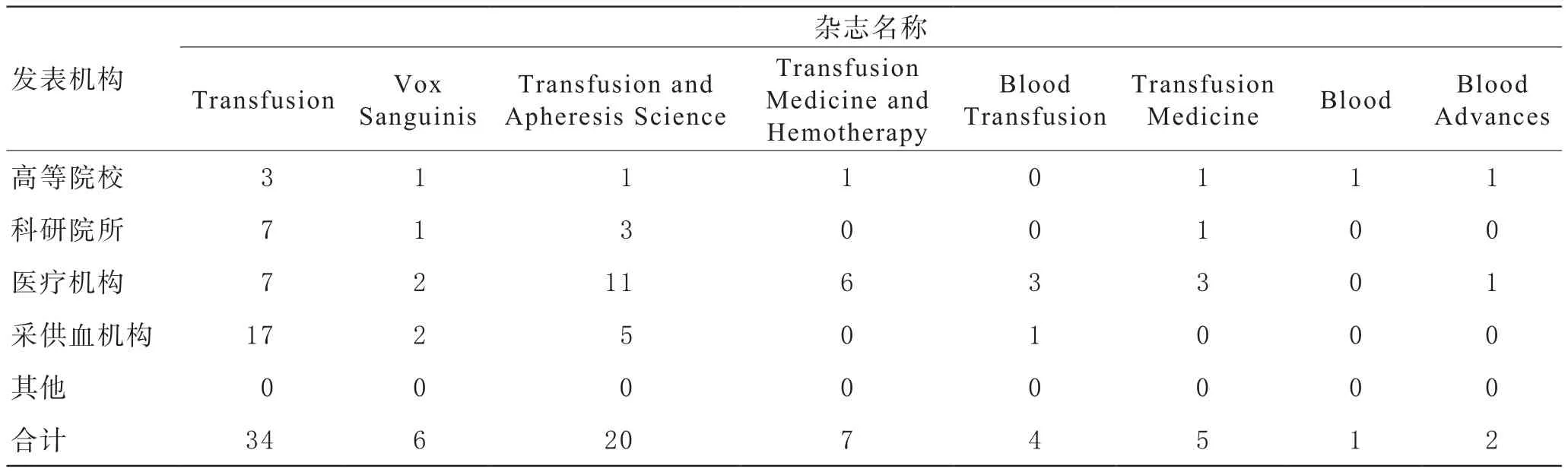
表1 2020年我国科研团队在国外主要输血专业期刊发表论文情况
1 新冠肺炎的康复期血浆治疗 中国医学科学院输血研究所刘忠团队探讨了恢复期血浆疗效治疗危重症新型冠状病毒肺炎(COVID-19)患者的临床效果。2020年6月3日,该成果发表在JAMA上。研究发现,对于重症/危重症的新冠的患者,同时接受标准治疗和血浆输注治疗的患者与仅采用标准治疗的患者临床症状改善时间上并无明显差异。但接受过血浆治疗的患者在24、48或72 h病毒阳性率明显降低,说明康复期血浆治疗提高了患者的抗病毒能力[1]。CASADEVALL团队重点关注新冠肺炎的康复期血浆治疗的安全性问题,该研究对5000例重症或危重症新冠患者输注康复期血浆后的状况进行了研究,结果显示患者接受康复期血浆治疗未出现超出预期的不良作用,其研究结果发表在J Clin Invest上[2]。东部战区总医院团队分析了1568例新冠肺炎患者的临床、实验室和影像学特征,其中138例患者接受恢复期血浆治疗,发现利用恢复期血浆治疗能够显著改善重型和危重型新冠患者的临床症状和死亡率,也认为新冠康复期血浆治疗是安全的,该成果发表在Blood上[3]。FDA已经批准了对症状严重或威胁生命的患者紧急使用康复期血浆的方法。在疫苗最终面世前,输注康复期血浆治疗是可采用的以抗体为基础的治疗方法。目前对这种治疗方法的作用机理和精确的治疗成分的了解有限,还需要进一步深入开展标准化供体选择、康复期血浆质量控制和康复期血浆输注适应症的依据等方面的研究,以期制订康复期血浆治疗更细致、更规范的标准。
2 输血医学基础研究
2.1 同种异体输血免疫反应研究:Rhesus(Rh)是一个重要的血型系统。抗RhD免疫球蛋白(RhIg)的使用已极大地减少了新生儿溶血的发生,但现仍有抗-D抗原的同种异体免疫反应案例发生,说明现在对RhIg作用机制的认识还不全面。HENDRICKSON团队在Blood上发表相关文章,该研究证明KEL转基因小鼠是一个能模拟RhD抗原并适用于研究RhIg作用机制的模型[4]。即使在已经使用KELIg(抗KEL多克隆抗体)进行免疫预防的小鼠中,poly(I∶C)处理仍然可以造成KEL抗原诱导的红细胞同种异体免疫反应,直接使用IFN-α处理也可以造成同样的现象。这些实验结果说明当怀孕妇女在罹患I型干扰素相关炎性疾病,例如类风湿性关节炎或红斑狼疮时,即便是使用了RhIg免疫预防,仍然有很高的几率发生同种异体免疫反应。
2.2 血液储存不良效应的机制研究:红细胞或血小板在储存过程中会发生一些理化性质的变化。储存血液中存在红细胞/血小板来源的细胞外囊泡(EV)积累,这些生物活性成分可能会给受血者造成未知的影响。特别是储存损伤诱导的红细胞衍生微泡(RBCMVs)可通过支持凝血酶原复合物的组装来促进凝血,也有报道称RBC-MVs通过固有途径启动凝血。为了阐明RBC-MVs诱导的凝血激活机制,研究人员在缓冲系统中评估了储存损伤诱导的RBC-MVs激活内源性凝血途径中的每个酶原的能力。同时,还采用凝血酶生成试验评估了RBC-MVs在血浆中启动凝血的能力。结果提示RBC-MVs同时激活FⅫ和前激肽释放酶,通过两条独立的途径激活FⅨ,即经典的FⅫa-FⅪ-FⅨ途径和激肽释放酶直接激活途径。该成果发表在Blood上[5]。
多伦多大学KUEBLER团队也在Blood发表了储存血小板来源的细胞外囊泡(PEV)的不良效应,该研究证实储存血小板来源的PEV通过促进神经酰胺表达和降低S1P的产生导致输血相关急性肺损伤(TRALI)的发生;而抑制神经酰胺的形成、补充S1P或洗涤储存血小板都可以降低TRALI的发生率[6]。
储存条件之外,献血者红细胞本身抗储存损伤能力也很重要。哥伦比亚大学HOD团队在J Clin Invest发文,证明葡萄糖-6-磷酸脱氢酶(G6PD)缺陷者捐献的红细胞无法达到FDA要求的储存后质量要求,表现为携氧能力减弱、PTR值下降等[7]。G6PD是磷酸戊糖途径的限速酶,这个途径产生的NADPH参与红细胞的抗氧化途径,NADPH缺乏导致了红细胞抗氧化应激能力下降。
2.3 红细胞与血小板体内清除机制研究:衰老红细胞仅能在体内被巨噬细胞所吞噬,在体外无法观察到类似现象,说明脾脏结构在衰老红细胞清除过程中发挥重要的作用,但脾脏巨噬细胞吞噬衰老红细胞的具体细节并不清楚。BRUGGEN团队在Blood发表“Hemolysis in the spleen drives erythrocyte turnover”,对脾脏巨噬细胞及被脾脏结构隔离的红细胞进行了研究,发现衰老红细胞laminin-α5被特异性激活并暴露于脾脏组织,导致红细胞的裂解,脾脏组织中存在大量以这种途径失去血红蛋白的红细胞残体,红细胞残体被红髓中的巨噬细胞识别和吞噬清除[8]。
通常认为去唾液酸化的衰老血小板在肝脏中通过Ashwell-Morell受体(AMR)被移除出血液循环。也有研究发现抗血小板膜表面整合素(GPIbα)抗体被激活后,唾液酸苷酶-1转位至膜表面使血小板去唾液酸化,通过AMR受体被清除。本年度P. KUBES团队在J Exp Med上发表成果,通过高分辨率双激光旋转盘活体显微镜(SD-IVM),发现大部分去唾液酸化的衰老血小板在肝Kupffer细胞上聚集,少数血小板聚集于内皮细胞,随后被这两种细胞摄取清除。缺失Kupffer细胞,血液循环中衰老的血小板无法被清除。单独AMR缺失对于血小板的摄取影响有限,但AMR和巨噬细胞半乳糖凝集素(MGL)同时缺失,则几乎完全阻断了Kupffer细胞对去唾液酸化血小板的摄取,说明了MGL在血小板清除过程中发挥关键作用[9]。
在免疫性血小板减少症患者(ITP)中,自身抗体结合血小板后会导致血小板在脾脏中清除,自身抗体也可以导致补体介导/去唾液酸化介导的血小板清除。KANAJI团队在Blood发表了“Mechanisms of anti-GPIbα antibody-induced thrombocytopenia in mice”,该研究通过应用两种免疫介导血小板减少症的小鼠模型,对ITP血小板清除加速和血小板生成受损机制进行了研究。结果提示,决定血小板清除的因素不仅包括抗血小板抗体类别,还包括抗体的注射途径和循环浓度。高浓度抗血小板抗体导致血小板的激活/去唾液酸化/聚集,从而使血小板被肝脏巨噬细胞或肝细胞清除;多次少量的抗血小板抗体则导致血小板被脾脏中巨噬细胞清除,说明血小板被清除途径具有多样性[10]。
2.4 血小板可通过释放微囊泡参与自身调控机制研究:血小板是调控凝血和止血的重要血液成分,它由巨核细胞的胞质剥离而成,而巨核细胞的源头则是造血干细胞。对于造血干细胞的更新,自然离不开造血微环境。造血微环境对造血干细胞的维持、激活和分化至关重要。本年度Nature Commun发表了军事科学院军事医学研究院卫生勤务与血液研究所的最新研究成果,该研究通过大量实验证实,活化的血小板通过释放微囊泡靶向造血干/祖细胞,并将其中大量包裹的miR-1915-3p传递到靶细胞中去,正反馈调节巨核细胞和血小板的生成,从而补充消耗的血小板数量[11]。
3 输血医学相关前沿交叉领域研究
3.1 高龄献血者血液代谢产物安全性研究:2020年8月19日,威尔康奈尔医学院JOHN BLENIS教授实验室在Nature杂志发表了题为“Age-induced accumulation of methylmalonic acid promotes tumour progression”的文章,该研究基于代谢组学发现丙酸代谢的副产物甲基丙二酸(MMA)在老年供血者(≥60岁)的血清中含量上升,而MMA可以通过促进TGF-β信号通路,诱导转录因子SOX4的表达,从而引发转录重编程促进癌细胞的侵袭和转移。揭示了MMA是衰老和肿瘤发展之间的代谢联系纽带[12]。肿瘤患者治疗过程中可能需要输血,但如果输注的血液中MMA的浓度较高,可能不利于患者的病情。这项研究提出了高龄献血者血液质量安全性的问题,同时也引出MMA等有潜在危害的代谢产物是否有必要成为血液安全的检测项目,如何从血液中去除这类物质等问题,也许是一个潜在有价值的血液安全研究新方向。
3.2 血液置换治疗的新应用:血液置换是一种血液净化治疗方法,当病人血液中存在大量免疫炎症因子、氧化应激产物、自身免疫性抗体及复合物时,就需要通过血浆置换来缓解病情。本年度SIMPKINS团队在Nat Commun上发表研究成果,发现使用年轻小鼠血液部分置换中风小鼠血液后,中风的症状明显减轻,大脑的梗死面积和神经功能损伤程度明显改善。在中风后,大脑损伤导致一些物质透过血脑屏障释放进入血液,引起免疫系统的激活。通过血液置换可以明显降低这些物质在血液中的浓度。同时血液替换可以移除活化的白细胞,从而减少中风后细胞因子、趋化因子和蛋白酶等物质的浓度。进一步研究发现蛋白酶MMP9是血脑屏障完整性被破坏的重要原因,因此靶向中性粒细胞和巨噬细胞来源的MMP9可能是血液替换治疗中风的关键因素[13]。该研究提示血液置换可能有更多的新应用适应证值得探索。
3.3 红细胞表面抗原改造研究:RhD是一个锚定于磷脂双分子层内的细胞膜骨架蛋白,通过酶促反应等方法直接去除细胞膜上的RhD抗原会影响红细胞膜的完整性,对红细胞的功能造成很大影响。基因工程对RhD进行改造则可能引入基因突变等其它隐患,这些问题使得上述方法无法真正获得成功改造的红细胞。2020年3月20号,浙江大学转化医学研究院在Science Advances上发表了题为“Surface-anchored framework for generating RhD-epitope stealth red blood cells”的文章。通过细胞膜锚定分子在红细胞表面设计和构建三维的多聚唾液酸-酪胺水凝胶网络,实现了“通用熊猫血”的人工构建和安全输血。该化学框架在几乎不影响红细胞膜流动性及免疫原性的情况下实现对红细胞表面RhD抗原的完全掩盖,使得RhD+红细胞转变为RhD-。其中唾液酸可以隐藏红细胞表面的抗原,所以这些红细胞可以在实验动物血液循环中存留很长时间而不诱导产生抗体。这种细胞膜表面锚定交联框架对于ABO血型也是有效的,所以这种方法可以实现将A或B型/RhD+的红细胞转变为广谱通用型的O型/RhD-红细胞[14]。这项工作为输血医学界提供了一种新的思路,具有应用于临床输血的潜在价值。
3.4 红细胞类抗原呈递功能研究:衰老的红细胞可以携带吸附在红细胞膜上的抗原肽,在脾脏中以非炎性途径被吞噬细胞吞噬,以此对抗原产生耐受性应答。红细胞可以通过静电吸引捕获循环系统中的免疫复合物和细菌,通过细胞氧化作用杀死细菌后,将其组分呈现于细胞膜上并将其交给肝脏中的Kupffer细胞或脾脏中的抗原呈递细胞(APC)。利用红细胞可以在脾脏中呈递抗原的能力,SAMIR MITRAGOTRI等在PNAS发表“Erythrocyte-driven immunization via biomimicry of their natural antigen-presenting function”,旨在开发仿生策略来促进机体产生针对特定抗原的细胞和体液免疫反应。结果显示,使用红细胞递送至脾脏的纳米颗粒可诱导更强的抗原抗体反应及记忆T细胞效应,显著增强抗肿瘤免疫反应。该研究表明红细胞驱动的免疫靶向治疗(EDIT)可作为增强全身免疫力的有效策略之一,拓展了红细胞的应用范畴[15]。
4 临床输血研究 本年度临床输血研究也取得诸多研究进展,本文仅列举了几篇发表于NEJM及JAMA的代表性研究工作。
加拿大麦克马斯特大学MICHAEL WALSH团队取得一项新成果。他们研究了血浆置换和糖皮质激素治疗严重ANCA相关性血管炎的疗效。这一研究成果发表在2020年2月13日出版的NEJM。该研究提示对于严重ANCA相关性血管炎患者,血浆置换并不能降低死亡或ESKD的发生率,糖皮质激素减量治疗亦不优于标准剂量方案[16]。
NEJM还发表了评估红细胞成熟剂Reblozyl(luspatercept)治疗β地中海贫血的关键Ⅲ期BELIEVE研究。结果显示Reblozyl治疗组患者输血负担显著降低。Reblozyl是首个获FDA批准治疗β地中海贫血相关贫血的药物,同时是首个也是唯一一个获得批准的红细胞成熟剂。通过促进红细胞发育后期阶段的成熟,以减少患者红细胞输注的需求,代表了新一类的疗法。需要指出的是,Reblozyl在需要立即纠正贫血的患者中不适用于作为红细胞输注的替代品[17]。
对于出生时体重小于1000克的婴儿,临床上通常进行红细胞输注治疗,但输血量的多少目前尚无充分的研究。先前有研究表明,较低的输血量似乎与认知障碍风险相关。本年度JAMA发表“红细胞输注量与极低体重新生儿不良预后风险”相关论文,研究人员考察了低体重新生儿红细胞输血量与死亡或残疾的相关性,研究的主要终点为24个月时死亡或残疾(任何认知缺陷、脑瘫或严重的视觉或听觉障碍),次要终点为早产并发症和生长发育情况。研究认为,对于出生体重小于1000克的婴儿中,红细胞输注量与患儿24个月时死亡或残疾风险无显著相关性[18]。
5 展望 输血医学既是一门古老的学科,同时也是一门新兴交叉学科。 单细胞组学、纳米生物技术、多模态跨尺度成像技术、人工智能等新兴前沿技术的不断涌现,为输血医学的发展提供了强大的动力。针对血液从供血者“血管”到受血者“血管”全链条环节中,制约输血医学发展的基础性科学问题,期待通过组合多种前沿技术,深度解析成分血液、血液制品及代用品的精细结构与功能,深入探讨供血者遗传、环境、药物等因素对红细胞、血小板、血浆组分结构和功能的影响;揭示血液低温储存损伤的分子机制,融合与生成多组学数据,挖掘血细胞低温损伤生物标志物,研发新型血液保存剂及血液低温保存技术;揭示储存或衰老血细胞体内转归清除代谢的动力学特征,阐明血液输注引发输血不良反应发生发展规律及调控机制,制定输血不良反应防治措施;开展临床输血救治新理论、新技术与新方案研究。同时通过学科交叉,开展工程化多功能血细胞及新型输血细胞治疗等新技术研究,进一步拓展输血医学前沿技术的研发和临床应用范畴。
利益冲突 所有作者均声明不存在利益冲突

