甲壳素脱乙酰酶的研究进展
郭依依,蔡 俊*
(湖北工业大学 生物工程与食品学院,湖北 武汉 430068)
甲壳素(C8H13O5N)n又称几丁质,是存在于各类甲壳动物的外壳及真菌细胞壁中的一种难溶的N-乙酰-D-葡萄糖胺聚合物,其高度延伸的氢键半晶结构使其难以溶于一般的稀酸稀碱及有机溶剂,这极大限制了甲壳素的应用[1-2]。当脱乙酰度达到50%时,甲壳素的溶解性能大大增强,当脱乙酰度达到55%及以上时,则为壳聚糖。壳聚糖分子易于进行化学修饰且溶解性能好,广泛应用于轻工业、美容业、农业及生物医学等领域[1-3]。
目前壳聚糖的制备方法主要为化学法,物理法。化学法是在高温条件下、利用强酸或强碱来脱去甲壳素的乙酰基,不仅能耗高,污染环境、且得到的产品不稳定(乙酰度不均匀,分子量变化大,乙酰基所在位置不固定),已逐渐被摒弃;物理法是通过辐射作用使甲壳素分子内的化学键发生断裂而降解,有微波辐射和超声辐射等,产物是分子量较宽的复杂混合物[3-4]。而利用甲壳素脱乙酰酶(chitin deacetylase,CDA)(E.C.3.5.1.41)处理甲壳素能够获得高品质的壳聚糖,且反应过程绿色环保,因此寻找到高质量CDA或产CDA菌株迫在眉睫。本文对CDA研究进展进行了综述,以期为今后的研究提供参考。
1 甲壳素脱乙酰酶的概述
1.1 理化性质
不同来源的CDA在分子质量、细胞内的存在位置、最适温度及pH值等方面存在较大差异[5-12]。部分微生物来源的CDA相关的理化性质见表1。目前自然界中发现的CDA均为糖蛋白,通常分布于细胞质、周质空间或分泌到细胞外中;分子质量为50~150 kDa;最适pH值在4.5~9.0;等电点多在2.5~5.0;最适温度多为50 ℃;该酶对甲壳素低聚糖有活性,对结晶态的甲壳素底物没有活性;不同种类或不同浓度的金属离子对CDA活性的影响不同,如低浓度的Ca2+、Mn2+、K+对来源于红球菌的CDA的酶活起促进作用,但随着浓度的升高逐渐呈抑制作用;CDA催化脱乙酰过程中会释放出乙酸或乙酸盐,因此受乙酸抑制的CDA不适合应用于工业化脱乙酰。
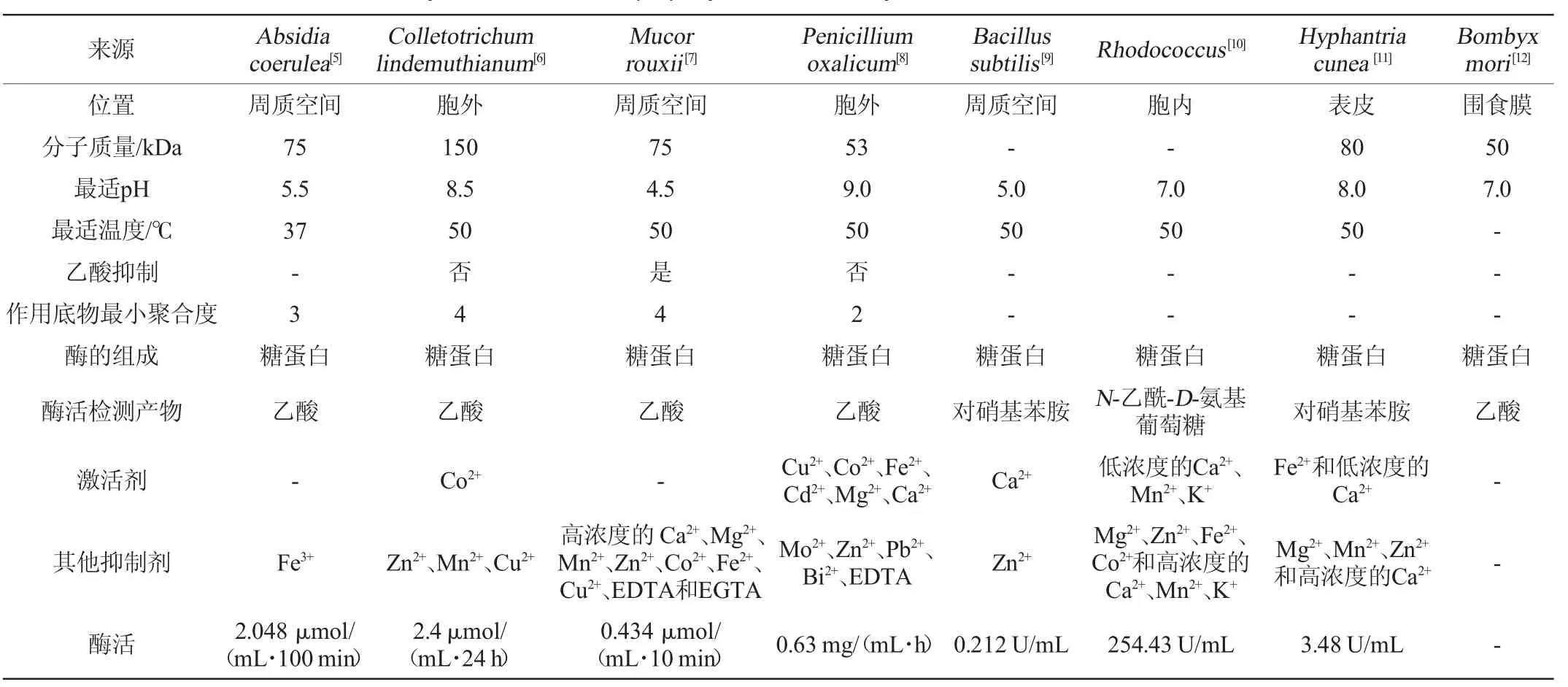
表1 部分微生物来源的甲壳素脱乙酰酶的理化性质Table 1 Physical and chemical property of chitin deacetylase from some microbial sources
1.2 分类
CDA是一种专一性的用于甲壳素脱去乙酰基的糖酯酶。它和乙酰木聚糖酯酶(EC 3.1.1.72)、壳寡糖脱乙酰酶(EC 3.5.1.-)、肽聚糖脱乙酰酶(EC 3.5.1.-)和β-1,6-葡聚糖脱乙酰酶(EC 3.5.1-)等同属糖酯酶4家族(carbohydrate esterase family 4,CE4)[13]。CE4家族酶的特点是:它们均可攻击糖链分子上的酰胺键(非肽键),但具有不同的底物偏好性;它们都具有结瘤因子脱乙酰酶蛋白(deacetylase protein of nodular factor,NodB)同源结构域(特征为(β/α)8桶折叠,即核心是7个或8个平行的β链,外周围被α螺旋包围形成扭曲的β桶。β桶装饰的一系列环构成了大部分碳水化合物的结合口袋)[14-15]。该区域通常由五个保守的基序定义:基序1(TFDD),由两个连续的天冬氨酸残基组成,可结合金属配体。基序2 H(S/T)xxH中的丝氨酸(serine,Ser)或苏氨酸(threonine,Thr)残基与第二个组氨酸(histidine,His)形成氢键以稳定活性位点的局部构象。此外,来自基序1的天冬氨酸(aspartic acid,Asp)和基序2中的两个His残基共同构成了His-His-Asp金属结合三联体。基序3(RxPY)和基序4(DxxD(W/Y))共同构成活性位点凹槽。基序5I(V/I)LxHD为底物结合口袋。图1将不同来源的CE4酶进行序列比对验证了这一点,此外这5个基序的空间位置通过图2的蛋白晶体结构模型表示;都为金属依赖性水解酶,具有Zn2+和Co2+作为最常见的金属配体[16-17]。
CDA也属于甲壳素酶系,甲壳素酶系是作用于甲壳素及其相关衍生物的酶的总称,主要成员有甲壳素脱乙酰酶和甲壳素酶,CDA与甲壳素相关酶系联用,可得到一系列具有生理活性的多糖产品[18]。如图3所示,从作用底物聚合度n来看,甲壳二糖酶作用范围最窄,其次为N-乙酰-β-葡萄糖胺酶、甲壳素酶,壳聚糖酶和CDA范围最广,n≥2的底物均可作用;从作用化学键来看,只有CDA可专一性脱去底物的乙酰基,得到壳聚糖及其他具有生理活性的寡聚体,其他酶则作用于糖苷键,使分子链断裂,此功能往往可被溶菌酶、纤维素酶、蛋白酶和脂肪酶等其他非专一性酶类代替。

图1 甲壳素脱乙酰酶催化域的多重序列比对结果Fig.1 Alignment results of multiple sequence of chitin deacetylase catalytic domains
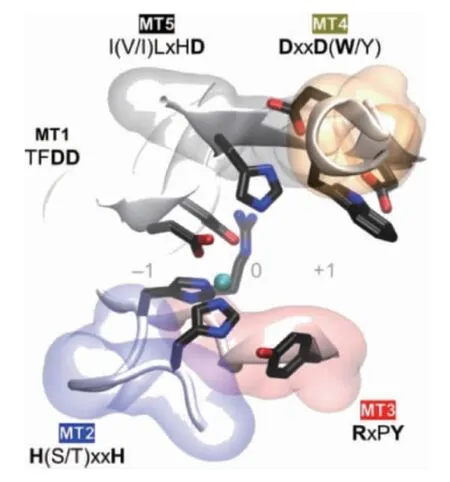
图2 基序1~5的空间位置在蛋白晶体结构模型中的体现Fig.2 Reflection of spatial position of motif 1-5 in the crystal structure model of protein
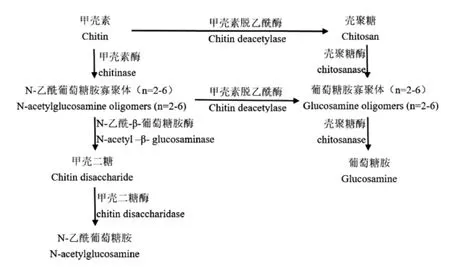
图3 甲壳素酶系作用关系图Fig.3 Relation diagram of action of chitin-related enzymes
1.3 来源及生理学作用
CDA在真菌(如鲁氏毛霉(Mucor rouxii)、蓝色犁头霉(Absidia coerulea)、构巢曲霉(Aspergillus nidulans)、豆刺盘孢(Colletotrichumlindemuthianum)、米根霉(Rhizopusoryzae)、总状毛霉(Mucor racemosus)、黑根霉(Rhizopus nigricans)、短柄梨孢帚霉(Scopulariopsis brevicaulis)、金龟子绿僵菌(Metarhizium anisopliae)、单胞锈菌属(Uromyces)及啤酒酵母(Saccharomyces cerevisiae)等),细菌(如肠炎弧菌(Vibrio alginolyticus)、枯草芽孢杆菌(Bacillus subtilis)和红球菌(Rhodococcus)等),某些节肢动物(昆虫纲和甲壳纲,如Locusta migratoria、Hyphantria cunea、Exopalaemon carinicauda和Penaeus monodon等)中均有发现[5-12,19-21]。不同来源或相同来源不同基因编码的CDA在作用时间、空间和效果上差异很大。CDA通过催化产生组成某些生物体的结构物质壳聚糖和与分子识别有关(如细胞信号传导和形态发生,充当免疫应答诱导子和宿主-病原体介体)的小分子寡聚体来发挥其生理学作用。下面从不同的来源具体阐述。
真菌:某些接合菌中,CDA与甲壳素合酶结合紧密。CDA攻击后者产生的尚未形成晶态结构的新生甲壳素,得到合成细胞壁、孢子壁和某些营养结构中的壳聚糖[22];某些分泌到胞外的CDA则在真菌自溶过程中发挥作用。它们协同甲壳素内切酶(endochintinase)E.C.3.2.1.14水解细胞壁中的甲壳素,瓦解细胞壁结构[5];真菌病原体的植物防御逃脱机制也与CDA的功能密切相关,真菌病原体在入侵植物后,其细胞壁上的甲壳素会被宿主识别作为入侵信号,并迅速触发抗性反应产生特异性抗体,而此时真菌会分泌一种内源性CDA,通过改变细胞壁甲壳素的脱乙酰度(degree of deacetylation,DD)使之无法被特异性受体进一步识别从而逃避植物的防御机制;类似的,一些昆虫病原真菌的CDA具有修饰昆虫表皮甲壳素使其易于渗透以及改变自身细胞壁以抵御昆虫甲壳素酶的侵袭的双重作用[14,23-24]。
细菌:细菌中,CDA存在于细胞内或细胞外,分泌到胞外的CDA通常参与环境中甲壳素的降解,如某些海洋细菌[25]。某些可使昆虫致病的细菌也会分泌出CDA作用于昆虫外壳或营养器官,使其理化性质发生改变从而实现侵染[26];存在于细菌细胞内的CDA通常与分子识别有关,如根瘤菌和豆科植物的识别及结瘤过程中,根瘤菌吸附到寄主根毛上,然后由侵染线侵入寄主后诱发根瘤。在这个过程中,CDA与N-乙酰氨基葡萄糖转移酶以及酰基转移酶等共同参与了结瘤因子(nodular factor,NF)的合成,这类因子可诱导宿主植物根毛卷曲和膨胀以便于根瘤菌的入侵[27]。
节肢动物:CDA在昆虫的整个生长发育过程中都起着重要作用,如器官的形成、表皮甲壳素的修饰、正确蜕皮、诱导幼虫转化成蛹等,机体通过编码CDA来软化组织,实现生长发育。研究发现昆虫针对不同的组织细胞(表皮细胞、胸肌细胞、肠内壁细胞等),可以编码不同类群的CDA蛋白,从而调节自身生长[11-12,28];同时CDA还参与某些甲壳类动物的免疫机制,推测其机理是甲壳类动物遭到侵染时,体内CDA大量合成的壳聚糖(多阳离子聚合物)可与病原菌细胞表面的生物大分子带负电的侧链相互作用,形成聚合物或直接进入其细胞核,与DNA结合,影响mRNA和蛋白质的合成来抑制病原菌的生长[20-21]。
1.4 作用机理
CDA为典型的金属依赖性水解酶,其催化机制为金属辅助的酸/碱催化[17,29]。下面以VCC CDA催化甲壳二糖为例,探讨CDA催化脱乙酰的一般过程。如图4所示,催化过程中Zn2+、Asp40的羧基和His97和His101的咪唑基是催化作用所必需的。首先,活化水分子的亲核氧原子攻击底物羰基碳原子,同时D39作为广义碱,从Zn2+-结合水吸取一个质子,形成一个带负电荷四面体过渡态中间物,通过Zn2+和His97、His101带正电荷的侧链的静电相互作用给以稳定。然后His295的咪唑基作为通用酸提供一个质子给底物的-NH基,C-N键随之断裂得到游离胺,并释放出乙酸盐[30]。
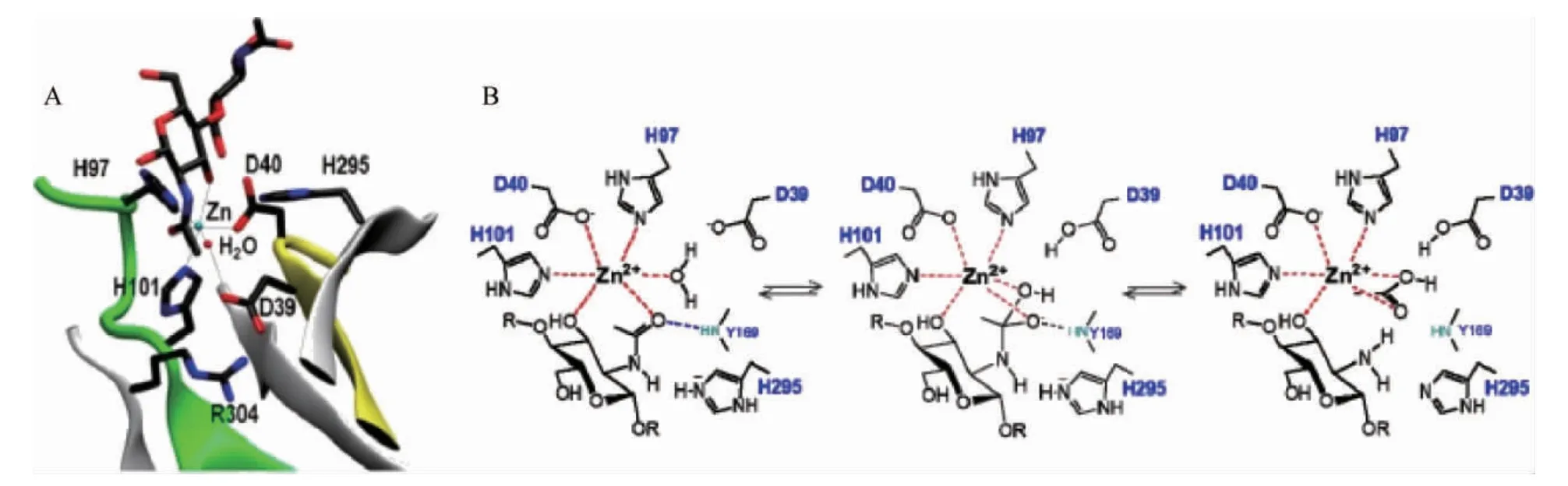
图4 VcCDA·DP2络合物中活性位点残基的X射线结构图(A)及CE4脱乙酰酶的金属辅助通用酸碱机制作用过程(B)Fig.4 X-ray structure diagram of active site residues in VcCDA·DP2 complex (A) and metal-assisted general acid-base mechanism process of CE4 deacetylase (B)
不同来源的CDA在催化过程中表现出不同的脱乙酰模式(deacetylation pattern,PA),即多重攻击、多链和单链机制[31]。多重攻击在毛霉中最为常见,CDA的作用过程大致如下:首先,酶随机结合到底物分子链的任一序列上,然后以结合部位的非还原端为起点,沿着该链脱去乙酰基,水解完毕后,与底物解离,然后结合到另一条底物分子链上,开始新一轮的水解[7]。多链机制和多重攻击类似,CDA随机攻击某一序列的任意位点,但是每次只能脱去一个乙酰基便与底物解离。单链机制是CDA酶识别底物的某一固定位点,然后与底物结合进行连续的脱乙酰化过程。总的来说,多重攻击和多链机制为多位点作用,多重攻击和单链机制可连续进行乙酰化。这三种不同的脱乙酰模式往往会得到两类产物,无择优攻击的多链机制会产生单元随机分布的二元杂多糖,即N-乙酰氨基葡萄糖(N-acetylglucosamine,GlcNAc)和氨基葡萄糖(Glucosamine,GlcNH2)单元交替分布,而可连续脱乙酰的的多重攻击机制和单链机制会产生嵌段共聚物,即以GlcNAc和GlcNH2为单元的聚合物链段交替分布[32]。
CDA对不同的底物其催化效果与速率有所差异。以甲壳素为例,天然甲壳素分子结构致密,由一根长链上的氨基与相邻长链上的羰基之间形成氢键而聚合。其分子聚合度(degree of polymerization,DA)、脱乙酰度和结晶度都会影响CDA脱乙酰效果。通常CDA对于分子质量较小,脱乙酰度高,结晶度低的可溶性底物酶活更高[33]。
2 甲壳素脱乙酰酶菌的生产
2.1 产甲壳素脱乙酰酶菌株的选育
CDA菌株的选育主要有三种途径:自然筛选、诱变育种和构建基因工程菌。CDA的自然来源很丰富,但天然获得的CDA酶存在很多问题:野生型微生物产酶量低,粗酶液杂质多,且多为胞内酶,不易分离纯化。并且某些物种能够编码的不同的CDA,其在功能和作用机制上都存在差异(如作用位点、攻击方式、所得产物等),难以应用于高端酶市场[5-10,19]。通过诱变选育产CDA菌株,虽然可以提高酶的产量,但诱变菌株通常情况下是不稳定的[34]。目前这些不足均可以通过基因工程技术解决,首先通过基因工程手段可以将各种来源,从细菌到真核生物的CDA基因进行表达研究,通过一系列的基因改造获得酶学特性和产量稳定的CDA,融合组氨酸标签(histidine-tag,His-Tag)以及谷胱甘肽S转移酶标签(glutathione S-transferase-tag,GST-tag)便于CDA的纯化,甚至将CDA与壳聚糖酶融合表达,提高其应用性能。
工程菌成功构建例子较多,目前已在多种宿主中进行表达,但多为大肠杆菌,而且用大肠杆菌表达时,常常会陷入包涵体表达的问题,所以需要挑选合适的载体,例如融合GST和麦芽糖结合蛋白(maltose binding protein,MBP)等,利于蛋白折叠;或使用分泌性表达载体[14,22,26]。同时由于CDA的来源广,所以在跨种族进行表达时,需要注意密码子通用性的问题。如某些生物中的编码氨基酸的密码子,可能在大肠杆菌中为终止密码子,如蜜蜂螺原体Spiroplasma melliferumCH-1的CDA基因中编码色氨基酸的密码子在大肠杆菌中为终止子[35],所以必要时需要通过定点突变技术进行改造,同时在遇到密码子偏好性的问题导致蛋白表达量低时,针对大肠杆菌的密码子优化时必不可少。酵母菌也是常用的表达宿主之一,酵母菌拥有完整的分泌表达体系,能够促使异源蛋白正确折叠,并分泌至胞外,其酵母表达系统具有糖基化的作用,不仅能提高异源蛋白的稳定性,同时对其酶活提升也会有所帮助可能提高(有研究表明CDA为糖蛋白)。昆虫表达系统是目前新兴的表达系统,具有对外源蛋白折叠修饰的功能,且能表达具有内含子的外源基因,其在表达昆虫来源的CDA时具有天然的优势,孙晓彤等先后利用毕赤酵母和昆虫细胞表达甜菜夜蛾的CDA1(spodoptera exigua CDA1,SeCDA1)并在昆虫细胞表达系统中获得较好的表达效果,相比毕赤酵母提升了0.39倍[35],同样的,研究人员在表达家蚕CDA1(Bombyx moriCDA1、BmCDA1)、美国白蛾CDA1(Hyphantria cuneaCDA1,HcCDA1)、HcCDA2等昆虫的CDA基因时也发现了昆虫细胞表达系统的优异性能[11-12]。而由于昆虫细胞培养条件严苛,成本昂贵,并不适用于当下大规模生产,但却是今后表达CDA最具潜力的表达系统。
2.2 甲壳素脱乙酰酶的分离纯化
CDA的分离纯化方法根据酶蛋白存在的位置和生产菌株是否为基因工程菌而有所不同。分泌到胞外的CDA酶可直接从发酵上清液中提取。若发酵上清液中无酶活,且用表面活性剂清洗菌体后仍然不显活性,则可初步断定该CDA为胞内酶(可采用免疫荧光技术和免疫胶体金标记法进行准确的细胞定位)[5,7,36]。由于野生型微生物中的CDA往往分布在细胞内(细胞壁、细胞周质空间等),导致CDA在纯化上的困难,寻找到合理的破碎细胞方法极为关键,一般有机械法(捣碎、研磨、匀浆)、物理法(温差、压差、超声)和生物化学法(化学试剂渗透、自溶、酶解)以及复合处理法。前处理之后,采用硫酸铵沉淀法和超滤法将粗酶液浓缩和粗分离,以除去核酸、多糖等杂质。细分级过程中,天然甲壳素脱乙酰酶蛋白多采用层析法,常用的有离子交换层析与亲和层析[5-8]。而重组甲壳素脱乙酰酶蛋白,通常人为加上了融合标签,因此分离纯化步骤比天然的简化很多。如融合了His-tag的重组酶,能够利用镍柱亲和层析快速纯化[37]。
3 展望
CDA有着丰富的生物来源和独特的生理学作用,围绕着CDA酶可以开发出多种功能。目前用CDA取代NaOH热碱法生产壳聚糖已是大势所趋,某些CDA还可以生产特定的寡糖产品。如来源于Mucor rouxii的CDA可生产还原端具有一个乙酰基的甲壳寡糖[7];Colletotrichum lindemuthianum中的CDA可催化脱乙酰反应的逆反应,在壳聚二糖的非还原端加上一个乙酰基得到β-D-GlcNAc-(1-4)-GlcN或得到具有3个乙酰基的壳聚四糖[6]。此外,CDA参与合成构成真菌细胞壁的重要结构物质壳聚糖,且在昆虫的生长发育过程中发挥着重要作用,是理想的抗真菌药物和昆虫防治的作用靶点,但是CDA的工业化应用在短期内仍难以实现。自然选育的野生CDA菌株所产酶多为胞内酶,不易分离纯化,基因工程手段得到的菌株则多产没有活性的包涵体,而且目前最为迫切的一个问题就是,无论是天然CDA还是重组CDA都难以降解具有致密晶体结构的天然甲壳素。尝试从菌株的选育、酶蛋白的修饰和底物的改造三方面着手来解决问题:①考虑到海洋中大量含天然甲壳素的虾蟹壳等物质被微生物降解,海洋生物具备产催化难溶底物CDA的潜力;②选用昆虫细胞作为表达系统,获得酶活力高且直接分泌到胞外的CDA酶,并对其进行蛋白质分子的修饰与改造;③在用CDA催化底物之前,对天然甲壳素进行预处理破坏其晶态结构,对后续降解至关重要,酶法预处理将会是一个大的趋势。如预先用多糖裂解单加氧酶(lytic polysaccharide monooxygenase,LPMO)氧化裂解甲壳素原纤维表面上的糖链,暴露出晶体内部的乙酰基,能大大加快CDA后续的脱乙酰进程[38]。此外,由于CDA和一些相关的CE4酶均对壳寡糖(chitosan oligosaccharide,COS)表现出催化活性,且作用机理相似,现有的以乙酰苯胺和壳寡糖等为底物的酶活测定方法可能无法区别这些酶。因此,某种新发现的具有催化脱乙酰活力的酶是否为CDA还需加以甄别,可从三方面进行:①从来源与生理学作用初步推测,如存在于细菌周质空间中与细菌细胞壁(含肽聚糖)合成相关,很可能为肽聚糖脱乙酰酶[39]。分泌到细胞外用于分解代谢植物细胞壁(含木聚糖)的极有可能为乙酰木聚糖酯酶[40]。②根据其底物偏好性,检测其对不同底物的催化活力加以证实。③将该酶的基因序列与已报道的多种CDA基因进行序列比对,甚至结晶得到蛋白质晶体与已上传的蛋白质数据库(protein database,PDB)结构比较进一步验证。CDA的应用潜能无可替代,但需要做的还有很多,如规范CDA的酶活测定方式,深入了解更多的CDA蛋白分子结构等。

