扶正抗癌汤含药血清调节EMT 进程抑制人卵巢癌HO-8910PM 细胞转移及侵袭作用的研究
田 璐
(辽宁中医药大学附属医院妇产科,沈阳 110032)
卵巢癌为女性生殖器官常见恶性肿瘤,发病率排在女性各类肿瘤的第3 位,而致死率高居第1 位,严重威胁女性生命健康[1-2]。 由于卵巢癌缺少有效准确的早期诊断方法,加之发病隐匿,导致确诊患者中约70%~80%已为晚期,失去了手术治疗的最佳时期[3]。 化疗为晚期卵巢癌的主要治疗手段,虽然可暂时缓解病情,但存在严重的毒副作用、耐药及高复发率等缺点[4]。 卵巢癌的转移及侵袭是导致治疗失败和死亡的首要原因,如何抑制卵巢癌的转移及侵袭对提高患者的治愈率和生存率至关重要[5]。
传统中药由于具有多靶点、多途径、疗效确切及低毒副作用等优势,在卵巢癌的治疗领域逐渐引起了人们的关注[6-7]。 扶正抗癌汤为辽宁中医药大学附属医院院内制剂,已广泛应用于非小细胞肺癌等多种肿瘤的治疗,取得了很好的临床疗效[8]。 然而关于扶正抗癌汤对肿瘤细胞转移及侵袭作用的研究报道较少。 因此,本研究以人卵巢癌HO-8910PM 细胞为研究对象,主要观察扶正抗癌汤含药血清对HO-8910PM 细胞转移及侵袭的作用,并进一步探讨其能否通过调节TGF-β1/Smad3 通路及影响上皮间质转化(EMT)进程起到抗卵巢癌转移及侵袭的作用。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
SPF 级SD 大鼠,雄性48 只,体重200 ~220 g,6~8 周龄,购于沈阳茂华生物科技有限公司[SCXK(辽)2017-0001]。 SD 大鼠饲养于辽宁中医药大学实验动物中心[SYXK(辽)2019-0004];本实验获我校实验动物伦理委员会审批(21000092018069),按照实验动物使用的3R 原则给予人道关怀。
1.1.2 实验细胞
人卵巢癌HO-8910PM 细胞,购于上海美轩生物科技公司。
1.2 主要试剂与仪器
扶正抗癌汤由红人参25 g、白术10 g、甘草10 g、半夏15 g、浙贝母15 g、枳壳15 g、陈皮15 g、半枝莲10 g、白花舌草50 g、竹茹20 g、茯苓20 g 及生姜5 g 组成;经2 次水煎后,合并药液,并浓缩至含生药2 g/mL 药液,过滤,分装灭菌。 胎牛血清、DMEM、胰蛋白酶,美国Mediatech 公司;Matrigel 胶,美国BD公司;Transwell 小室,美国康宁公司;纤维连接蛋白(FN)酶联免疫吸附法(ELISA)检测试剂盒,上海酶联生物公司;TRIzol、逆转录试剂盒及实时定量PCR检测试剂盒,日本TaKaRa 公司;转移生长因子-β1(TGF-β1)、磷酸化Smad 同源物蛋白3(p-Smad3)多克隆抗体,美国Cell Signaling 公司;甘油醛-3-磷酸脱氢酶(GAPDH)多克隆抗体,北京金杉中桥生物公司。 超净工作台(型号:SW-CJ1FD,苏州净化设备公司);CO2培养箱(型号:3111,美国Thermo 公司);倒置相差显微镜(型号:DFC259,德国Leica 公司);多功能酶标仪(型号:ELX808,美国BioTek 公司);实时定量PCR 系统(型号:7500,美国ABI 公司);蛋白电泳仪(型号:DYCZ-24EN,北京六一仪器厂)。
1.3 实验方法
1.3.1 制备含药血清
将48 只SD 大鼠随机分为正常组及扶正抗癌汤低、中、高剂量组,12 只/组;依据人与大鼠剂量换算方法,以标准质量/人的体重×6.3 为高剂量(18.9 g/(kg⋅d))组,在此基础上稀释1 倍(9.45 g/(kg⋅d))为中剂量组,稀释2 倍为低剂量(4.725 g/(kg⋅d))组,灌胃给药,每天1 次;正常组灌胃等体积蒸馏水,给药体积为1 mL/100 g,共持续7 d。 末次灌胃给药后2 h,经后股动脉采血,分离血清;在56℃条件下将补体灭活,用0.22 μm 无菌滤膜过滤,分装于离心管中在低温冰箱中保存备用。
1.3.2 细胞培养
用含10%胎牛血清的DMEM 培养基对HO-8910PM 细胞进行培养,培养条件为5% CO2、37℃;使用胰蛋白酶(0.25%)消化细胞及传代,至对数生长期时用于后续实验研究。
1.3.3 划痕实验检测HO-8910PM 细胞转移能力
在6 孔培养板中接种对数生长期的HO-8910PM 细胞,用含10%胎牛血清的DMEM 培养基进行培养,待24 h 细胞贴壁后,倒掉培养基;PBS 漂洗后,用无菌的移液器枪头沿中轴轻轻划线。 PBS漂洗,加入DMEM 培养基(分别含10%正常组大鼠血清及10%低、中、高剂量扶正抗癌汤组大鼠含药血清),继续培养24 h,拍照。 通过给药前与给药后的划痕宽度,计算细胞相对迁移率,细胞相对迁移率(%)=(1~24 h 划痕宽度/0 h 划痕宽度)× 100%
1.3.4 Transwell 实验检测HO-8910PM 细胞侵袭能力
将稀释好的Matrigel 胶加入到Transwell 小室中,37℃下于CO2培养箱中放置1 h,将多余培养基弃掉。 HO-8910PM 细胞培养至对数生长期,离心后用无血清培养基重悬,并调整密度为每毫升1×106个,取200 μL 细胞悬液加入到Transwell 上室中;下室加入700 μL DMEM 培养基(分别含10%正常组大鼠血清及10%低、中、高剂量扶正抗癌汤组大鼠含药血清),继续培养24 h。 将多余培养液弃掉,经4%多聚甲醛固定,并用结晶紫染色0.5 h。 显微镜下拍照,并计数细胞穿膜个数。
1.2.2 q-PCR检测 将患者的组织标本分成二份,一份在液氮下磨碎,并用TRIzol 试剂盒提取RNA,检测RNA在波长260 和280 nm 处的光密(D)值(使用紫外分光光度仪),逆转录成为 cDNA 后,再通过引物进行PCR的扩增,测引物序列[6-7]。
1.3.5 ELISA 实验检测HO-8910PM 细胞上清液FN 蛋白表达
HO-8910PM 细胞在DMEM 培养基(分别含10%正常组大鼠血清及10%低、中、高剂量扶正抗癌汤组大鼠含药血清)培养12 h、24 h 及48 h 后,离心,收集各组细胞上清液。 参考FN 检测试剂盒中的操作步骤,通过ELISA 实验检测细胞上清液FN蛋白表达。
1.3.6 实时定量PCR 实验检测HO-8910PM 细胞E-Cadherin、vimentin 及N-Cadherin mRNA 表达
HO-8910PM 细胞用DMEM 培养基(分别含10%正常组大鼠血清及10%低、中、高剂量扶正抗癌汤组大鼠含药血清)培养24 h 后,离心,收集各组细胞。 TRIzol 法提取总RNA,逆转录试剂盒逆转录为cDNA,实时定量PCR 引物由大连宝生物公司合成。E-cadherin 引物:上游5 '-GACACTGGTGCCATTTCC AC-3',下游5'-AGTTCGAGGTTCTGGTATGGG-3';vimentin 引物:上游5'-AGGCAAAGCAGGAGTCCA CT-3',下游5'-CGTTCCAGGGACTCATTGGT-3';Ncadherin 引 物: 上 游5'-GCAACGACGGGTTAGTC ACC-3',下游5'-GACACGGTTGCAGTTGACTGAG-3';GAPDH 引物:上游5'-GCACAGTCAAGGCTG AGAATG-3', 下 游 5 '-ATGGTGGTGAAGACGCC AGTA-3'。 实时定量PCR 反应体系为:上、下游引物各1 μL,2×SYBR Green Mix 10 μL,蒸馏水6 μL,cDNA 2 μL,总反应体积20 μL。 以GAPDH 作为内参基因,通过2-△△Ct法,检测各组HO-8910PM 细胞E-Cadherin、vimentin 及N-Cadherin mRNA 的表达。
1.3.7 Western blot 实验检测HO-8910PM 细胞TGF-β1、p-Smad3 蛋白表达
HO-8910PM 细胞处理方法同“1.3.6”。 细胞总蛋白使用RIPA 裂解液提取,按照BCA 试剂说明书检测细胞蛋白含量。 每个上样孔加20 μg 蛋白样品,10% SDS-PAGE 分离,湿法转膜,5%脱脂奶粉封闭。 分别加入TGF-β1、p-Smad3 抗体,稀释比例为1∶2500,4℃孵育过夜;TBST 溶液漂洗3 次后,加入稀释好的二抗(1 ∶5000),4℃孵育1 h。 TBST 溶液漂洗,加入ECL 发光液显色,拍照,各组细胞光密度值用Image Lab 软件分析。
1.4 统计学方法
2 结果
2.1 扶正抗癌汤含药血清抑制HO-8910PM 细胞转移
2.2 扶正抗癌汤含药血清抑制HO-8910PM 细胞侵袭
本研究通过Transwell 实验检测了扶正抗癌汤含药血清对HO-8910PM 细胞侵袭能力的影响,结果见表2 及图2。 与正常组比较,低、中、高剂量扶正抗癌汤组含药血清处理HO-8910PM 细胞24 h后,HO-8910PM 细胞穿膜细胞数明显降低(P<0.01),且该作用具有剂量依赖性。
2.3 扶正抗癌汤含药血清对HO-8910PM 细胞FN蛋白表达的影响
FN 蛋白参与EMT 进程,在肿瘤细胞间的黏附、转移及侵袭中发挥重要作用,本研究采用ELISA 法检测了扶正抗癌汤含药血清对HO-8910PM 细胞FN蛋白表达的影响,结果见表3。 与正常组比较,低、中、高剂量扶正抗癌汤组含药血清处理HO-8910PM细胞12 h、24 h 和48 h 后,HO-8910PM 细胞在三个时间点的FN 蛋白表达均明显降低(P<0.05 或P<0.01),且该作用具有时间依赖性及剂量依赖性。
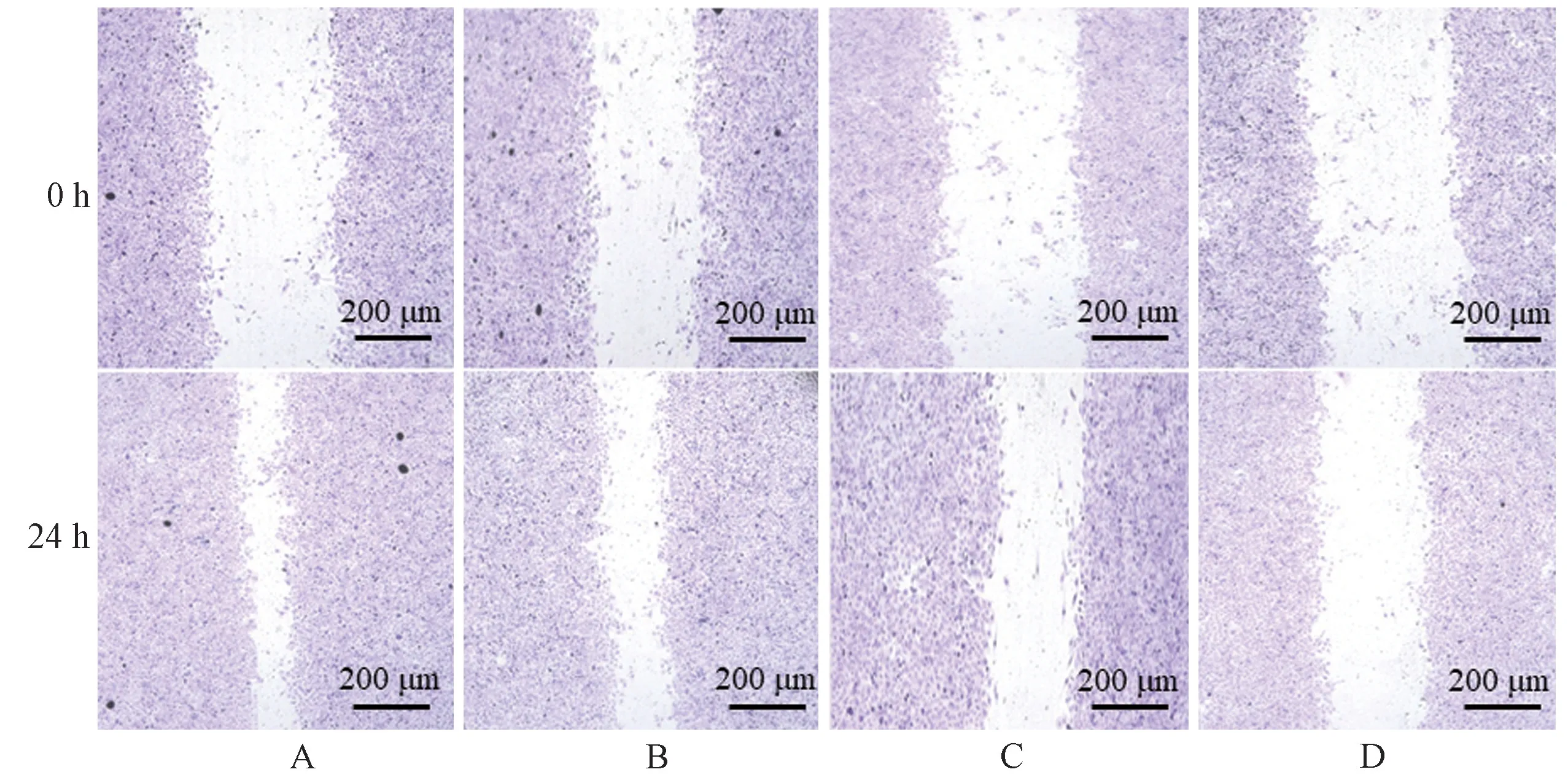
图1 扶正抗癌汤含药血清对HO-8910PM 细胞迁移率的影响Note.A, Normal group.B~D, 4.725, 9.45, 18.9 g/(kg⋅d) FZKAT drug serum groups.Figure 1 Effect of FZKAT drug serum on migration rate of HO-8910PM cells
表1 扶正抗癌汤含药血清对HO-8910PM 细胞迁移率的影响( ,n=5)Table 1 Effect of FZKAT drug serum on migration rate of HO-8910PM cells

表1 扶正抗癌汤含药血清对HO-8910PM 细胞迁移率的影响( ,n=5)Table 1 Effect of FZKAT drug serum on migration rate of HO-8910PM cells
注:与正常组比较,**P<0.01。Note.Compared with the normal group, **P<0.01.
?
表2 扶正抗癌汤含药血清对HO-8910PM 细胞侵袭能力的影响(,n=5)Table 2 Effect of FZKAT drug serum on invasion of HO-8910PM cells

表2 扶正抗癌汤含药血清对HO-8910PM 细胞侵袭能力的影响(,n=5)Table 2 Effect of FZKAT drug serum on invasion of HO-8910PM cells
注:与正常组比较,**P<0.01。Note.Compared with the normal group, **P<0.01.
组别Groups剂量(g/(kg⋅d))Dose穿膜细胞数(个)Wear membrane cell count (number)正常组Normal group 0 154.55±18.02扶正抗癌汤低剂量组FZKAT drug serum low dose group 4.725 105.48±12.67**扶正抗癌汤中剂量组FZKAT drug serum medium dose group 9.450 67.92±8.46**扶正抗癌汤高剂量组FZKAT drug serum high dose group 18.900 48.37±5.13**

图2 扶正抗癌汤含药血清对HO-8910PM细胞侵袭能力的影响Note.A, Normal group.B ~D, 4.725, 9.45, 18.9 g/(kg⋅d))FZKAT drug serum groups.Figure 2 Effect of FZKAT drug serum on invasion of HO-8910PM cells
2.4 扶正抗癌汤含药血清对HO-8910PM 细胞ECadherin、vimentin 及N-Cadherin mRNA 表达的影响
EMT 进程在细胞水平上以间质特性增强,上皮特性丧失为主要特征,在分子水平上表现为vimentin 和N-cadherin 表达增加,而E-cadherin 表达减少。 本研究采用实时定量PCR 法检测了扶正抗癌汤含药血清对HO-8910PM 细胞E-Cadherin、vimentin 及N-Cadherin mRNA 表达的影响,结果见表4。 与正常组比较,低、中、高剂量扶正抗癌汤组含药血清处理HO-8910PM 细胞24 h 后,HO-8910PM 细胞E-cadherin mRNA 表达增加(P<0.01),而vimentin 和N-cadherin mRNA 表达减少(P<0.01)。
2.5 扶正抗癌汤含药血清对HO-8910PM 细胞TGF -β1/Smad3 通路的影响
TGF-β1/Smad3 通路在EMT 发生和肿瘤细胞转移、侵袭过程起着重要调控作用,本研究采用Western blot实验检测了扶正抗癌汤含药血对HO-8910PM 细胞TGF-β1 及p-Smad3 蛋白表达的影响,结果见图3 及表5。 与正常组比较,低、中、高剂量扶正抗癌汤组含药血清处理HO-8910PM 细胞24 h后,HO-8910PM 细胞TGF-β1、p-Smad3 蛋白表达显著减少,差异具有统计学意义(P<0.01)。
表3 扶正抗癌汤含药血清对HO-8910PM 细胞FN 蛋白表达的影响( ,n=5)Table 3 Effect of FZKAT drug serum on FN expression of HO-8910PM cells

表3 扶正抗癌汤含药血清对HO-8910PM 细胞FN 蛋白表达的影响( ,n=5)Table 3 Effect of FZKAT drug serum on FN expression of HO-8910PM cells
注:与正常组比较,*P<0.05,**P<0.01。Note.Compared with the normal group, *P<0.05, **P<0.01.
组别Groups剂量(g/(kg⋅d))Dose纤维连接蛋白(ng/mL)Fibronectin 12 h 24 h 48 h正常组Normal group 0 72.36±8.64 73.12±8.46 71.82±7.23扶正抗癌汤低剂量组FZKAT drug serum low dose group 4.725 63.94±7.20* 59.69±6.87** 54.87±6.76**扶正抗癌汤中剂量组FZKAT drug serum medium dose group 9.450 61.38±7.79** 52.51±5.04** 40.23±5.37**扶正抗癌汤高剂量组FZKAT drug serum high dose group 18.900 55.53±6.05** 41.40±6.38** 33.41±5.22**
表4 扶正抗癌汤含药血清对HO-8910PM 细胞E-Cadherin、vimentin 及N-Cadherin mRNA 表达的影响(,n=5)Table 4 Effect of FZKAT drug serum on E-Cadherin, vimentin and N-Cadherin mRNA expressions of HO-8910PM cells
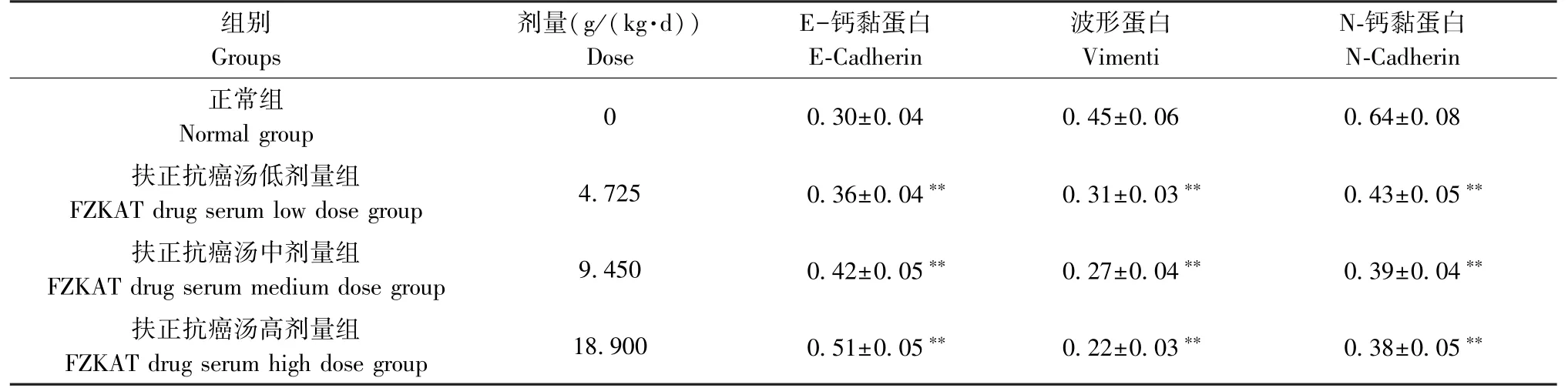
表4 扶正抗癌汤含药血清对HO-8910PM 细胞E-Cadherin、vimentin 及N-Cadherin mRNA 表达的影响(,n=5)Table 4 Effect of FZKAT drug serum on E-Cadherin, vimentin and N-Cadherin mRNA expressions of HO-8910PM cells
注:与正常组比较,**P<0.01。Note.Compared with the normal group, **P<0.01.
组别Groups剂量(g/(kg⋅d))Dose E-钙黏蛋白E-Cadherin波形蛋白Vimenti N-钙黏蛋白N-Cadherin正常组Normal group 0 0.30±0.04 0.45±0.06 0.64±0.08扶正抗癌汤低剂量组FZKAT drug serum low dose group 4.725 0.36±0.04** 0.31±0.03** 0.43±0.05**扶正抗癌汤中剂量组FZKAT drug serum medium dose group 9.450 0.42±0.05** 0.27±0.04** 0.39±0.04**扶正抗癌汤高剂量组FZKAT drug serum high dose group 18.900 0.51±0.05** 0.22±0.03** 0.38±0.05**
3 讨论
EMT 是指由上皮细胞向间质细胞转化的现象,其在卵巢癌、骨肉瘤、胰腺癌、结肠癌、肺癌及乳腺癌等多种肿瘤的转移及侵袭中起着关键性作用[9-10]。 FN 蛋白广泛存在于细胞外液、细胞表面及结缔组织中,是细胞外基质的重要组成成分,参与细胞的粘附、迁移及分化;在EMT 进程中FN 表达升高,进而促进肿瘤细胞的转移及侵袭[11]。 Ecadherin 表达减少,vimentin 和N-cadherin 表达增加是肿瘤细胞发生EMT 的重要证据。 E-Cadherin 参与维持上皮组织完整性和细胞极性,广泛存在于上皮组织中,当肿瘤细胞E-Cadherin 表达下调时,可引起侵袭性生长,导致肿瘤细胞的远端转移[12]。Vimentin 主要负责维持细胞骨架的完整性,为间充质来源细胞中的一种中间纤丝蛋白,vimentin 高表达标志着EMT 进程及肿瘤细胞转移、侵袭的发生[13]。 N-cadherin 参与细胞黏附、细胞的信号转导、细胞识别及细胞运动等生物学过程,其表达量与肿瘤的转移及侵袭程度呈正相关性[14]。
TGF-β1/Smad3 通路在肿瘤细胞的增殖、凋亡、EMT 进程及转移、侵袭中发挥着重要作用[15]。TGF-β1 存在于多种细胞中,具有抑制免疫监视、刺激细胞增殖、分化、迁移及促进炎症因子表达等作用[16]。 研究发现[17],在恶性肿瘤细胞中TGF-β1 表达量增加,进而与p-Smad3 形成复合物并一同进入细胞核内,介导EMT 进程,引发肿瘤细胞的转移、侵袭过程。 阻碍TGF-β1/Smad3 通路活化,影响EMT进程是抑制肿瘤细胞转移、侵袭的关键[18]。 研究发现[19],白藜芦醇可以阻断TGF-β1/Smad3 信号通路转导,抑制人肺癌A549 细胞的增殖及EMT 进程,减少A549 细胞的转移及侵袭。 血根碱也可以干预TGF-β1/Smad 信号通路,抑制卵巢癌A2780/Taxol细胞的生长及转移[20]。
本研究结果发现,与正常组比较,低、中、高剂量扶正抗癌汤组含药血清处理HO-8910PM 细胞后,迁移率及穿膜细胞数均明显降低,提示扶正抗癌汤具有抑制人卵巢癌HO-8910PM 细胞转移及侵袭的作用;同时,vimentin、N-cadherin mRNA 表达及FN、TGF-β1、p-Smad3 蛋白表达也明显降低,而Ecadherin mRNA 表达增加,表明扶正抗癌汤抑制人卵巢癌HO-8910PM 细胞转移及侵袭的作用与阻碍TGF-β1/Smad3 通路活化,进而调节EMT 进程有关。
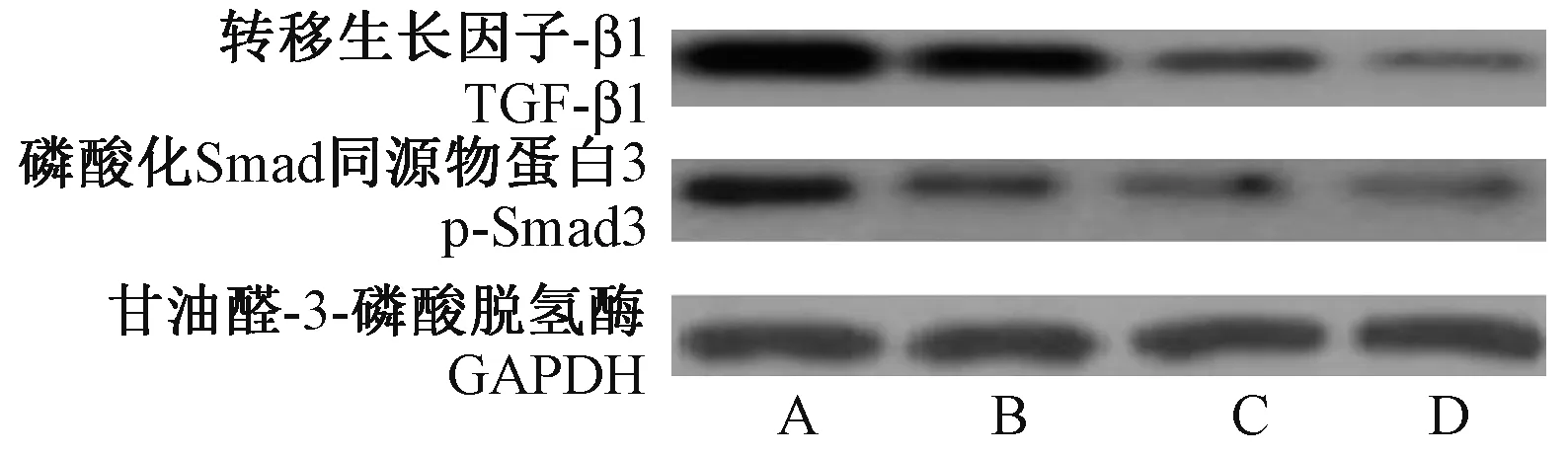
图3 扶正抗癌汤含药血清对HO-8910PM细胞TGF-β1/Smad3 通路的影响Note.A, Normal group.B ~D, 4.725, 9.45, 18.9 g/(kg⋅d)) FZKAT drug serum groups.Figure 3 Effect of FZKAT drug serum on TGF-β1 and p-Smad3 protein expressions of HO-8910PM cells
表5 扶正抗癌汤含药血清对HO-8910PM 细胞TGF-β1、p-Smad3 蛋白表达的影响(,n=5)Table 5 Effect of FZKAT drug serum on TGF-β1 and p-Smad3 protein expressions of HO-8910PM cells

表5 扶正抗癌汤含药血清对HO-8910PM 细胞TGF-β1、p-Smad3 蛋白表达的影响(,n=5)Table 5 Effect of FZKAT drug serum on TGF-β1 and p-Smad3 protein expressions of HO-8910PM cells
注:与正常组比较,**P<0.01。Note.Compared with the normal group, **P<0.01.
组别Groups剂量(g/(kg⋅d))Dose转移生长因子-β1/甘油醛-3-磷酸脱氢酶TGF-β1/GAPDH磷酸化Smad 同源物蛋白3/甘油醛-3-磷酸脱氢酶p-Smad3/GAPDH正常组Normal group 0 1.43±0.17 0.95±0.11扶正抗癌汤低剂量组FZKAT drug serum low dose group 4.725 1.14±0.12** 0.34±0.04**扶正抗癌汤中剂量组FZKAT drug serum medium dose group 9.450 0.42±0.05** 0.23±0.03**扶正抗癌汤高剂量组FZKAT drug serum high dose group 18.900 0.30±0.04** 0.19±0.02**

