PD-1敲除及GPC3修饰的嵌合抗原受体T细胞治疗肝癌的实验研究
姜舒,王冰,郭霞,张芸,谢亮,罗朝霞,刘赢滢
·论著·
PD-1敲除及GPC3修饰的嵌合抗原受体T细胞治疗肝癌的实验研究
姜舒,王冰,郭霞,张芸,谢亮,罗朝霞,刘赢滢
518000 深圳市茵冠生物科技有限公司(姜舒、王冰、张芸、谢亮、罗朝霞、刘赢滢);518000 深圳,南方医科大学深圳医院(郭霞)
构建程序死亡受体 1(PD-1)敲除及磷脂酰肌醇蛋白多糖-3(GPC3)修饰的嵌合抗原受体 T 细胞(GPC3-PD1gRNA-CART cells),研究其对肝癌细胞株 HepG2 的体外杀伤作用,以及其对肝癌动物模型的体内抗肿瘤作用。制备 GPC3-PD1gRNA-CART 细胞,用流式细胞仪检测 PD-1、GPC3 CAR 的表达情况。体外实验中,设立不同的效靶比(1:1、2:1、4:1),用 LDH 法测定刀豆蛋白刺激后的 GPC3-PD1gRNA-CART 细胞体外对 HepG2 细胞株的杀伤率,检测刀豆蛋白刺激后的 GPC3-PD1gRNA-CART 细胞和 HepG2 细胞株共孵育 18 h 后的细胞培养上清液中 IFN-γ 的释放水平。设置受刀豆蛋白 A 刺激的和未受刀豆蛋白 A 刺激的 GPC3 修饰的 CART 细胞(GPC3 CART cells)作为对照组。于重度免疫缺陷小鼠(NDG 小鼠)皮下注射 HepG2 细胞建立肝癌动物模型,观察 GPC3-PD1gRNA-CART 细胞体内抑瘤作用。实验分为模型组、实验组(GPC3-PD1gRNA-CART 组、GPC3 CART组),模型组和实验组通过皮下注射 1 × 106个 HepG2 细胞造模,在肿瘤长径达 3 mm 后实验组经尾静脉注射5 × 106个 GPC3-PD1gRNA-CART 细胞或 GPC3 CART 细胞,模型组经尾静脉注射 0.9% NaCl,每周注射 1 次,共 3 周,注射体积均为 0.2 ml。每隔 2 天观测肿瘤体积情况,治疗 3 周后取皮下肿瘤组织,HE 染色检测肿瘤组织情况。流式细胞术分析结果显示,GPC3 CAR 表达率为 98.8%。GPC3 CART 细胞 PD-1 的表达率为 11.1%,经刀豆蛋白 A 刺激后,PD-1 的表达率上升至 92.1%,而 GPC3-PD1gRNA-CART 细胞的 PD-1 表达率仅为 60%,证实了 PD-1 有效敲除。当效靶比为1:1、2:1、4:1 时,随着效靶比的增加,刀豆蛋白刺激后的 GPC3-PD1gRNA-CART细胞对 HepG2 的杀伤效果和 IFN-γ 的释放水平也随着效靶比的增加而增加。相同效靶比的情况下,刀豆蛋白 A 刺激后的 GPC3-PD1gRNA-CART 细胞对 HepG2 细胞的杀伤效果显著高于刀豆蛋白 A 刺激后的 GPC3 CART 细胞对 HepG2 细胞的杀伤效果(< 0.05),且刀豆蛋白 A 刺激后的 GPC3-PD1gRNA-CART 细胞和 HepG2 细胞共孵育后 IFN-γ 的释放水平也显著高于刀豆蛋白 A 刺激后的 GPC3 CART 细胞和 HepG2 细胞共孵育后 IFN-γ 的释放水平(< 0.05),证明 PD-1 的敲除可以逆转 CART 细胞的功能抑制。治疗 3 周后 GPC3-PD1gRNA-CART 组抑瘤率为 87.30%,与 GPC3 CART 组(69.03%)和模型组相比均有显著性差异(< 0.05)。肿瘤组织 HE 染色检测结果显示,相比模型组,实验组肿瘤细胞显著减少,GPC3-PD1gRNA-CART 组治疗效果优于 GPC3 CART 组。GPC3-PD1gRNA-CART 细胞可解决肿瘤逃逸问题,能于体内外高效靶向杀伤肿瘤细胞,为后续肝癌治疗提供技术基础。
肝癌; 嵌合抗原受体 T 淋巴细胞; 基因编辑
目前,我国肝癌的发病率约为 25.7/10 万,成为死亡率仅次于胃癌、肺癌的第三大恶性肿瘤,国内外肝癌患者五年生存率仅 21%,当前的治疗效果仍不尽如人意。
嵌合抗原受体 T 细胞(CART 细胞)技术近年来发展非常迅速,通过基因改造技术,效应 T 细胞的靶向性、杀伤活性和持久性均显著提高,在血液系统肿瘤的治疗上效果显著,然而针对实体瘤的治疗,因缺乏肿瘤特异性抗原、肿瘤抗原表达下调、免疫抑制微环境、肿瘤负荷大等因素,治疗效果仍存在不足。
规律性重复短回文序列簇(clustered regulatory interspaced short palindromic repeat,CRISPR)是一类独特的 DNA 串联重复序列,CRISPR 基因座由一个前导区(Leader)、多个短而高度保守的重复序列区(Repeat)和多个间隔序列区(Spacer)组成。CRISPR 相关基因(CRISPR-associated genes)称为 Cas 基因,Cas 一般位于 CRISPR 基因座附近。Cas9 是由 1409 个氨基酸组成的多结构域蛋白,含有 2 个核酸酶结构域:氨基端 RuvC-like 结构域及位于蛋白中间位置的 HNH 核酸酶结构域,HNH 核酸酶结构域可以切割与 CRISPR 转录产物(CRISPR-derived RNA,crRNA)互补配对的模板链,切割位点位于原型间隔序列毗邻基序(protospacer adjacent motif,PAM)上游 3 nt(nucleotide,核苷酸)处,RuvC-like 结构域可以对另一条链进行切割,切割位点位于 PAM 上游 3 ~ 8 nt 处。在 crRNA 与 tracrRNA(trans-activating crRNA)基因形成的双链 RNA 的指导下,Cas9 蛋白对靶位点进行切割。CRISPR/Cas 系统是细菌对噬菌体的长期抗争过程中进化产生的一种获得性免疫防御系统,普遍存在于细菌与古生菌中。目前,CRISPR/Cas9 系统已作为一种基因组编辑技术被广泛研究利用,该技术利用人工设计的向导 RNA(single-guide RNA,sgRNA)介导外源表达的 Cas9 蛋白与基因组靶点特异性结合,以实现对基因组 DNA 的特异性切割,切割后的基因组 DNA 通过非同源末端连接或同源重组的方式进行修复,从而实现基因的敲除、敲入等[1]。
程序死亡受体 1(PD-1)主要在激活的 T 细胞和 B 细胞中表达,功能是抑制细胞的激活,这是免疫系统的一种正常的自稳机制,因为过度的 T/B 细胞激活会引起自身免疫病。但是,肿瘤微环境会诱导浸润的 T 细胞高表达 PD-1 分子,其配体 PD-L1 在多种肿瘤细胞中均上调表达,它与 T细胞上的 PD-1 结合,抑制 T 细胞增殖和活化,使 T 细胞处于失活状态,最终诱导免疫逃逸[2]。截至目前,国内外已开展多项体内外实验研究,肿瘤类型涉及血液系统肿瘤和实体瘤,如多发性骨髓瘤、恶性胶质瘤、乳腺癌,均证实了 CRISPR/Cas9 系统敲除 PD-1 的 T 细胞对肿瘤细胞的杀伤作用更强大[3-6]。
阻断 PD-1/PD-L1 通路,可上调 T 细胞的生长和增殖,增强 T 细胞对肿瘤细胞的识别,激活其攻击和杀伤功能,通过调动人体自身的免疫功能实现抗肿瘤作用。鉴于上述 PD-1/PD-L1 通路的作用机制和肝癌的治疗现状,本研究通过构建 PD-1敲除及磷脂酰肌醇蛋白多糖-3(GPC3)修饰的CART(GPC3-PD1gRNA-CART)细胞,探索其应用于肝癌治疗的效果,为肝癌患者临床治疗方法提供技术基础。
1 材料与方法
1.1 材料
1.1.1 质粒、菌株和细胞株 慢病毒表达质粒空载体 pCDH、携带 CRISPR-Cas9 基因编辑系统的pAAV-U6-EF1α-Cas9 由本实验室保存;人肝癌细胞 HepG2、人胚肾细胞 293T 购自中国科学院干细胞库;Stbl4 感受态细胞购自北京博迈德基因技术有限公司。
1.1.2 动物 SPF 级 NDG 小鼠 30 只,雌性,5 周龄,购自百奥赛图(江苏)基因生物技术有限公司,动物许可证号 SCXK(苏)2016-0004。
1.1.3 试剂 OPTI-MEM 无血清培养基(31985-062)、Lipofectamine3000转染试剂(L3000015)购自美国Thermo Scientific 公司;胎牛血清(FBS,SV30087.03)、DMEM(SH30243.01)购自美国 Hyclone 公司;EndoFree 无内毒素质粒大提试剂盒(DP117)购自天根生化科技(北京)有限公司;苏木精-伊红(HE)染色试剂盒(C0105)购自上海碧云天生物技术有限公司;细胞毒性检测试剂盒(G1780)购自美国 Promega 公司;IFN-γ 试剂盒(1110002)购自深圳市达科为生物技术股份有限公司;淋巴细胞分离液(LTS1077)购自天津市灏洋生物制品科技有限责任公司;刀豆蛋白 A(C1139)购自北京金泰宏达生物科技有限公司;Anti-PD-1 Antibody-PE(10377-M140-P)购自北京义翘神州科技股份有限公司;XVIVO-10 培养基(04-418Q)购自瑞士 Lonza 公司。
1.1.4 仪器 生物安全柜(AB2-4S1-CN)购自新加坡 ESCO 公司;离心机(sorvall ST 40R)和CO2培养箱(3111)购自美国 Thermo Scientific 公司;荧光显微镜(XDS-1B)购自德国 Zeiss 公司;制备型超速离心机(OPTIMAL-80XP)购自美国 Beckman 公司。
1.2 方法
1.2.1 GPC3-PD1gRNA-CART 细胞制备和检测
1.2.1.1 慢病毒表达质粒 pCDH-GPC3 CAR-PD1 gRNA-Cas9 构建 靶向 PD-1 基因的两条互补寡聚核苷酸(PD-1_F:CACCGggccaggatggttcttaggt;PD-1_R:AAACacctaagaaccatcctggccC)[7]和 GPC3 CAR 基因均由苏州金唯智生物科技有限公司合成。寡聚核苷酸的退火及克隆到 pAAV-U6-EF1α-Cas9 载体按文献[8]进行,经测序符合预期。通过无缝连接方式将靶向 PD-1 基因的 CRISPR-Cas9 片段、GPC3 CAR 基因克隆到慢病毒载体,构建的慢病毒表达质粒 pCDH-GPC3 CAR-PD1 gRNA-Cas9 经测序符合预期。
1.2.1.2 pCDH-GPC3 CAR-PD1 gRNA-Cas9 包装 在 15 cm 培养皿中铺入 9 × 106个 293T 细胞,用含 10% FBS 的 DMEM 培养基在 37 ℃ 5% CO2培养箱中培养过夜。次日将 pCDH-GPC3 CAR-PD1 gRNA-Cas9 载体和包装质粒 pSPAX2、VSVG 依次按照 4:2:1 的比例加入 1 ml OPTI-MEM 无血清培养基中混匀,质粒总质量为 92.3 μg,将 3 倍质粒总质量的聚乙烯亚胺(polyethylenimine,PEI)加入另一管 1 ml OPTI-MEM 无血清培养基中混匀,两管液体分别室温孵育 3 min 后混合,旋涡混匀后的复合物室温孵育 20 min。将 293T 细胞培养液换成 37 ℃预热的 OPTI-MEM 无血清培养基(14 ml/皿),均匀滴入上述复合物,培养 4 ~ 6 h 后弃上清,加入30 ml 含 10% FBS 的 DMEM 培养基培养,分别于 48 h、96 h 收取病毒液,1300 r/min 离心 5 min,取上清,采用超速离心机 20 000 r/min离心 2 h,弃上清,用 PBS 重悬病毒并用 0.22 μm 滤器过滤,分装冻存于–80 ℃。
1.2.1.3 GPC3-PD1gRNA-CART 细胞制备和检测 制备含终浓度 5 μg/ml CD3 抗体、100 μg/ml RetroNectin 的生理盐水,以 1 ml/孔的用量加入六孔板,于细胞培养箱中孵育至少 4 h。取健康志愿者外周血,用 Ficoll 淋巴细胞分离液和密度梯度离心法分离得到 PBMC。采用 MACS 分选柱分离纯化 CD3+T 淋巴细胞,用含终浓度 5% FBS、1000 IU/ml IL-2、1000 IU/m IFN-γ 的 XVIVO-10 培养基重悬细胞并计数,按 2 × 106个/孔将细胞接种于包被好的六孔板,补加培养基至 2 ml。第二天加入终浓度 5 μg/ml 的聚凝胺及适量病毒液并混匀,将六孔板放入离心机中 1000 ×室温离心 30 min 后放入细胞培养箱中继续培养扩增,制备 GPC3-PD1gRNA-CART 细胞。采用流式细胞仪检测GPC3 CAR 表达情况。用 40 μg/ml 的刀豆蛋白 A 对 GPC3-PD1gRNA-CART 细胞刺激 72 h 后,采用流式细胞仪检测 PD-1 表达情况。设置受刀豆蛋白 A 刺激的和未受刺激的 GPC3 修饰的CART(GPC3 CART)细胞作为对照组。
1.2.2 GPC3-PD1gRNA-CART 细胞功能活性检测 收集 HepG2 细胞,调整细胞密度为 1 ×105个/ml,GPC3-PD1gRNA-CART 细胞使用终浓度为 40 μg/ml 的刀豆蛋白 A 刺激 72 h 后收集,调整细胞密度为 4 × 105个/ml,按效靶比 1:1、2:1、4:1 分别往 96 孔板加入 GPC3-PD1gRNA-CART 细胞和 HepG2 细胞,共孵育 18 h,每个效靶比设 3 个复孔。设置受刀豆蛋白 A 刺激的和未受刺激的 GPC3 CART 细胞作为对照组。按细胞毒性检测试剂盒和 IFN-γ 试剂盒说明操作,检测 LDH 释放量和 IFN-γ 水平。
1.2.3 分组和给药 按随机数字表法将 NDG 小鼠随机分为模型组、实验组(GPC3-PD1gRNA- CART 组、GPC3 CART 组),每组 10 只。模型组和实验组通过皮下注射 1 × 106个 HepG2 细胞造模,在肿瘤长径达 3 mm 后实验组经尾静脉注射5 × 106个 GPC3-PD1gRNA-CART 细胞或 GPC3 CART 细胞,模型组经尾静脉注射 0.9% NaCl,每周注射 1 次,共 3 周,注射体积均为 0.2 ml。
1.2.4 观察肿瘤生长情况和肿瘤组织检测 每2 天用卡尺测量肿瘤体积(V = 长径 × 短径2/2)[9],观察肿瘤生长情况,抑瘤率=(模型组体积 – 实验组体积)/模型组体积[10]。治疗 3 周后取皮下肿瘤组织,HE 染色检测肿瘤组织情况。
1.3 统计学处理
2 结果
2.1 GPC3-PD1gRNA-CART 细胞 GPC3 CAR、PD-1 检测结果
流式细胞术分析结果显示,GPC3 CAR 表达率为 98.8%(图 1A)。GPC3 CART 细胞 PD-1 的表达率为 11.1%,经刀豆蛋白 A 刺激后,PD-1 的表达率上升至 92.1%,而 GPC3-PD1gRNA-CART 细胞的PD-1 表达率仅为 60%(图 1B),证实了 PD-1 有效敲除。

A
Figure 1 Expression rates of GPC3 CAR and PD-1 tested by flow cytometry
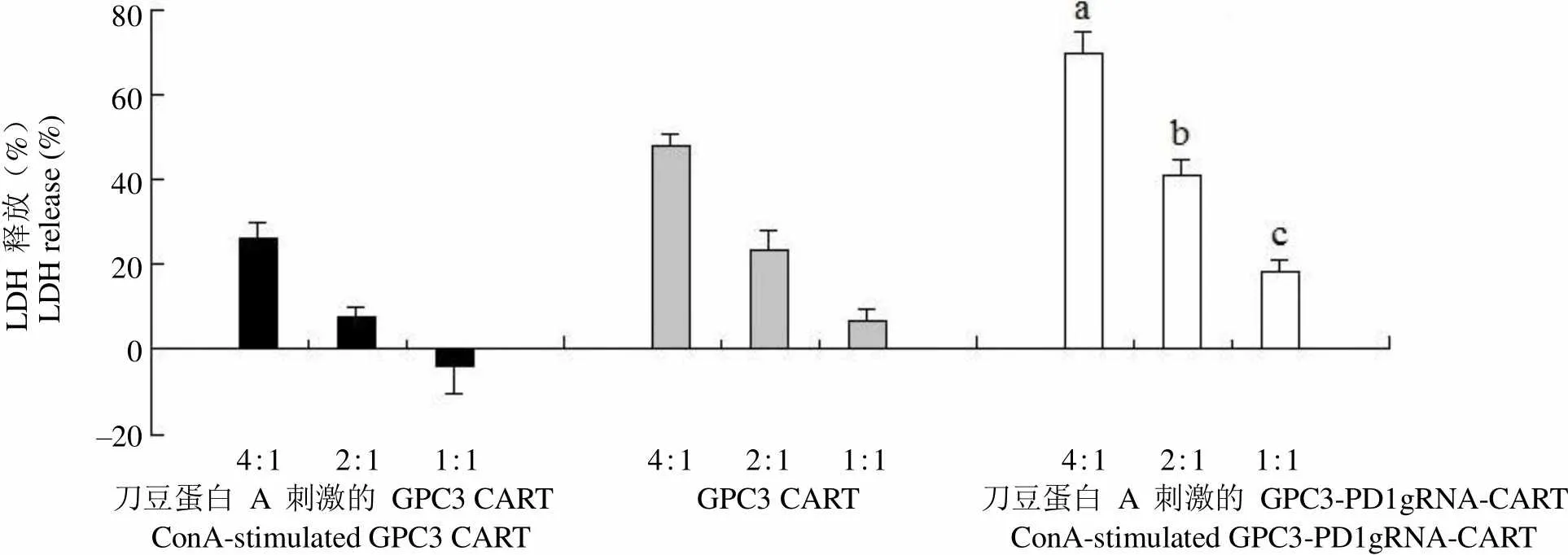
LDH 释放(%)LDH release (%)80 60 40 20 0 –20 4:1 2:1 1:1 4:1 2:1 1:1 4:1 2:1 1:1 刀豆蛋白 A 刺激的 GPC3 CART GPC3 CART 刀豆蛋白 A 刺激的 GPC3-PD1gRNA-CART ConA-stimulated GPC3 CART ConA-stimulated GPC3-PD1gRNA-CART
Figure 2 LDH release [a:< 0.001, compared with stimulated GPC3 CART (4:1) group; b:< 0.05, compared with stimulated GPC3 CART (2:1) group; c:= 0.004, compared with stimulated GPC3 CART (1:1) group]
2.2 GPC3-PD1gRNA-CART 细胞体外杀瘤效力评估
当效靶比为 1:1、2:1、4:1 时,随着效靶比的增加,刀豆蛋白刺激后的 GPC3-PD1gRNA-CART 细胞对 HepG2 的杀伤效果也随着提高,LDH 和 IFN-γ 的释放水平均随着效靶比的增加而增加。相同效靶比的情况下,刀豆蛋白 A 刺激后的 GPC3-PD1gRNA-CART 细胞对 HepG2 细胞的杀伤效果显著高于刀豆蛋白 A 刺激后的 GPC3 CART细胞对 HepG2 细胞的杀伤效果(< 0.05,图 2),且刀豆蛋白 A 刺激后的 GPC3-PD1gRNA-CART 细胞和 HepG2 细胞共孵育后 IFN-γ 的释放水平也显著高于刀豆蛋白 A 刺激后的 GPC3 CART 细胞和 HepG2 细胞共孵育后 IFN-γ 的释放水平(< 0.05,图 3),证明 PD-1 的敲除可以逆转 CART 细胞的功能抑制。
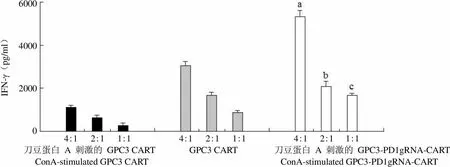
IFN-γ(pg/ml)6000 4000 2000 0 4:1 2:1 1:1 4:1 2:1 1:1 4:1 2:1 1:1 刀豆蛋白 A 刺激的 GPC3 CART GPC3 CART 刀豆蛋白 A 刺激的 GPC3-PD1gRNA-CART ConA-stimulated GPC3 CART ConA-stimulated GPC3-PD1gRNA-CART
Figure 3 IFN-γ level [a:< 0.001, compared with stimulated GPC3 CART (4:1) group; b:= 0.004, compared with stimulated GPC3 CART (2:1) group; c:< 0.001, compared with stimulated GPC3 CART (1:1) group]
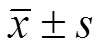
表 1 肿瘤体积情况(mm3,)
注:< 0.05,*与模型组相比,#与GPC3 CART 组相比。
Note:< 0.05,*compared with model group,#compared with GPC3 CART group.
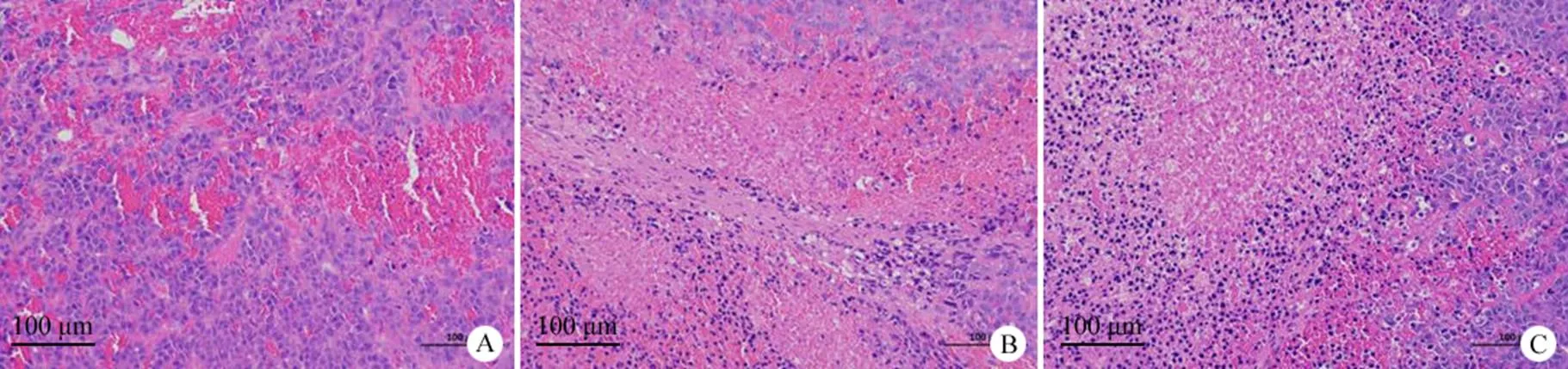
图 4 皮下肿瘤组织 HE 染色检测(× 200;A:模型组;B:GPC3 CART 组;C:GPC3-PD1gRNA-CART 组)
Figure 4 Subcutaneous tumor tissues stained by HE (× 200; A: Model group; B: GPC3 CART group; C: GPC3-PD1gRNA-CART group)
2.3 肿瘤体积
造模后第 5 天,模型组和实验组(GPC3- PD1gRNA-CART 组、GPC3 CART 组)可见明显肿块,治疗 3 周后,实验组肿瘤生长受到明显抑制,GPC3-PD1gRNA-CART 组抑瘤率为 87.30%,GPC3 CART 组抑瘤率为 69.03%,与模型组比较,差异有统计学意义(< 0.05),见表 1。
2.4 HE染色检测肿瘤组织情况
HE 染色可见模型组肿瘤细胞密集,较多新生血管,毛细血管淤血扩张,出血较多。与模型组相比,实验组可见肿瘤细胞片状坏死,坏死肿瘤细胞胞核固缩深染或碎裂溶解,出血减少,相比 GPC3 CART 组,GPC3-PD1gRNA-CART 组肿瘤细胞坏死程度更严重,出血更少,表明 GPC3-PD1gRNA-CART 细胞治疗效果优于 GPC3 CART 细胞,见图4。
3 讨论
免疫检查点分子属于免疫调节信号分子,可以抑制免疫系统过度反应,以保持自我耐受性。PD-1 分子在细胞毒性 T 细胞表面表达,其配体 PD-L1 主要表达于肿瘤细胞和肿瘤微环境中的细胞表面,PD-1 与 PD-L1 的结合可导致 T 细胞功能活性下降[11]。肿瘤细胞或肿瘤微环境可通过上述机制,逃避免疫系统的攻击[11-12]。敲除肿瘤特异性 T 细胞表面的免疫检查点分子,从而规避肿瘤逃逸的发生,提高肿瘤杀伤效果,在多项体内外研究中已被证实是有效的策略[13-18]。
鉴于 GPC3 CART 细胞 PD-1 的表达率为 11.1%,且 PD-1 在活化的 T 细胞、B 细胞和巨噬细胞的表面高表达[19-20]以及刀豆蛋白 A 对 T 细胞具有活化作用[21],为了更好地体现 PD-1 的敲除效率,采用刀豆蛋白 A 诱导刺激 CART 细胞活化增殖,经刀豆蛋白 A 刺激后,GPC3 CART 细胞PD-1 的表达率上升至 92.1%,而 GPC3-PD1gRNA- CART 细胞因敲除了 PD-1,其 PD-1 的表达率仅上升至 60%,相比刀豆蛋白 A 刺激的 GPC3 CART 组,PD-1 表达水平下降了 30% 以上,间接证实了 PD-1 有效敲除。
IFN-γ 是活化的 T 细胞、NK 细胞受刺激后产生的细胞因子,其可以增强免疫细胞对微生物、肿瘤细胞等的杀伤作用。在细胞培养中,细胞死亡数目与细胞培养上清液中 LDH 活性成正比,通过测定 LDH 活性可计算出效应细胞对靶细胞的杀伤百分率。为了进一步验证 GPC3-PD1gRNA-CART 细胞的功能活性,检测其对肿瘤细胞的杀伤效率及 IFN-γ 的释放水平。随着效靶比的增加,刀豆蛋白刺激后的 GPC3-PD1gRNA-CART 细胞对 HepG2 的杀伤效果也随着提高,LDH 释放量随着效靶比的增加而增加,IFN-γ 的释放水平也随着效靶比的增加而增加。刀豆蛋白 A 刺激后的 GPC3 CART 细胞发生了 T 细胞衰竭,T 细胞耗竭也伴随着抑制性受体(包括 PD-1、淋巴细胞激活基因 3 蛋白即 LAG3 等)的表达量和多样性逐渐增加,T 细胞功能活性显著下降[22-23]。例如,当效靶比为 4:1 时,未受刀豆蛋白 A 刺激的 GPC3 CART 细胞组 LDH 活性为(49.70 ± 1.53)%,IFN-γ 的释放水平为(3126.67 ± 110.15)pg/ml,刀豆蛋白 A 刺激的 GPC3 CART 细胞组 LDH 活性仅为(27.70 ± 2.52)%,IFN-γ 的释放水平为(1176.67 ± 25.17)pg/ml,而 GPC3-PD1gRNA-CART细胞因敲除了 PD-1,经刀豆蛋白 A 刺激后检测的 LDH 活性为(71.00 ± 3.61)%,IFN-γ 的释放水平为(5380.67 ± 235.38)pg/ml。以上实验结果证明 PD-1 的敲除可以逆转 CART 细胞的功能抑制。体内实验也进一步证实了 PD-1 敲除可有效解除 CART 细胞受到的功能抑制,有利于 CART 细胞发挥抗肿瘤作用。
以上实验结果与此前报道的 PD-1 信号通路在免疫抑制中的重要作用[24]一致,为进一步优化 CART 细胞、提高肿瘤细胞杀伤效果提供理论依据和实验基础。
[1] Rath D, Amlinger L, Rath A, et al. The CRISPR-Cas immune system: biology, mechanisms and applications. Biochimie, 2015, 117:119-128.
[2] Rosewell Shaw A, Suzuki M. Oncolytic viruses partner with T-cell therapy for solid tumor treatment. Front Immunol, 2018, 9:2103.
[3] Zhao Z, Shi L, Zhang W, et al. CRISPR knock out of programmed cell death protein 1 enhances anti-tumor activity of cytotoxic T lymphocytes. Oncotarget, 2017, 9(4):5208-5215.
[4] Nakazawa T, Natsume A, Nishimura F, et al. Effect of CRISPR/Cas9-mediated PD-1-disrupted primary human third-generation CAR-T cells targeting EGFRvIII on in vitro human glioblastoma cell growth. Cells, 2020, 9(4):998.
[5] Hu W, Zi Z, Jin Y, et al. CRISPR/Cas9-mediated PD-1 disruption enhances human mesothelin-targeted CAR T cell effector functions. Cancer Immunol Immunother, 2019, 68(3):365-377.
[6] Choi BD, Yu X, Castano AP, et al. CRISPR-Cas9 disruption of PD-1 enhances activity of universal EGFRvIII CAR T cells in a preclinical model of human glioblastoma. J Immunother Cancer, 2019, 7(1):304.
[7] Ren J, Liu X, Fang C, et al. Multiplex genome editing to generate universal CAR T cells resistant to PD1 inhibition. Clin Cancer Res, 2017, 23(9):2255-2266.
[8] Ran FA, Hsu PD, Wright J, et al. Genome engineering using the CRISPR-Cas9 system. Nat Protoc, 2013, 8(11):2281-2308.
[9] Gao J, Zhu XY, Shi QF, et al. Mechanism and inhibition of thalidomide combined with epirubicine on the growth of transplanted H22 hepatocellular carcinoma in mice. Chin J Clin Pharmacol, 2016, 32(2):170-173. (in Chinese)
高军, 祝小英, 石庆芳, 等. 沙利度胺联合表阿霉素对小鼠H22肝癌移植瘤的生长抑制研究. 中国临床药理学杂志, 2016, 32(2):170- 173.
[10] Wu JB, Zheng X, Hu JF, et al. Effect of calcitriol combinating cisplatin on the HEC-1-A transplantation tumor of athymic mouse. Chin J Clin Pharmacol, 2014, 30(6):540-542. (in Chinese)
吴建波, 郑秀, 胡继芬, 等. 骨化三醇联合顺铂对人子宫内膜癌细胞株HEC-1-A裸鼠移植瘤的作用. 中国临床药理学杂志, 2014, 30(6):540-542.
[11] Pardoll DM. The blockade of immune checkpoints in cancer immunotherapy. Nat Rev Cancer, 2012, 12(4):252-264.
[12] Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell, 2011, 144(5):646-674.
[13] Beane JD, Lee G, Zheng Z, et al. Clinical scale zinc finger nucleasemediated gene editing of PD-1 in tumor infiltrating lymphocytes for the treatment of metastatic melanoma. Mol Ther, 2015, 23(8):1380-1390.
[14] Su S, Hu B, Shao J, et al. CRISPR-Cas9 mediated efficient PD-1 disruption on human primary T cells from cancer patients. Sci Rep, 2016, 6:20070.
[15] Marotte L, Simon S, Vignard V, et al. Increased antitumor efficacy of PD-1-deficient melanoma-specific human lymphocytes. J Immunother Cancer, 2020, 8(1):e000311.
[16] Menger L, Sledzinska A, Bergerhoff K, et al. TALEN-mediated inactivation of PD-1 in tumor-reactive lymphocytes promotes intratumoral T-cell persistence and rejection of established tumors. Cancer Res, 2016, 76(8):2087-2093.
[17] Zhao Z, Shi L, Zhang W, et al. CRISPR knock out of programmed cell death protein 1 enhances anti-tumor activity of cytotoxic T lymphocytes. Oncotarget, 2017, 9(4):5208-5215.
[18] Lu S, Yang N, He J, et al. Generation of cancer-specific cytotoxic PD-1 T cells using liposome-encapsulated CRISPR/Cas system with dendritic/tumor fusion cells. J Biomed Nanotechnol, 2019, 15(3):593- 601.
[19] Postow MA, Callahan MK, Wolchok JD. Immune checkpoint blockade in cancer therapy. J Clin Oncol, 2015, 33(17):1974-1982.
[20] Kooshkaki O, Derakhshani A, Hosseinkhani N, et al. Combination of ipilimumab and nivolumab in cancers: from clinical practice to ongoing clinical trials. Int J Mol Sci, 2020, 21(12):4427.
[21] Zhou YQ, Weng XF, Dou R, et al. Betulin from Hedyotis hedyotidea ameliorates concanavalin A-induced and T cell-mediated autoimmune hepatitis in mice. Acta Pharmacol Sin, 2017, 38(2):201-210.
[22] Bouadma L, Wiedemann A, Patrier J, et al. Immune alterations in a patient with SARS-CoV-2-related acute respiratory distress syndrome. J Clin Immunol, 2020, 40(8):1082-1092.
[23] Ivanova DL, Krempels R, Denton SL, et al. NK cells negatively regulate CD8 T cells to promote immune exhaustion and chronic toxoplasma gondii infection. Front Cell Infect Microbiol, 2020, 10: 313.
[24] Vaddepally RK, Kharel P, Pandey R, et al. Review of indications of FDA-approved immune checkpoint Inhibitors per NCCN guidelines with the level of evidence. Cancers (Basel), 2020, 12(3):738.
Effect of PD-1 knockout and GPC3 modified chimeric antigen receptor T cells on liver cancer
JIANG Shu, WANG Bing, GUO Xia, ZHANG Yun, XIE Liang, LUO Zhao-xia, LIU Ying-ying
Shenzhen Wingor Biotechnology Co., Ltd, Shenzhen 518000, China (JIANG Shu, WANG Bing, ZHANG Yun, XIE Liang, LUO Zhao-xia, LIU Ying-ying); Shenzhen Hospital of Southern Medical University, Shenzhen 518000, China(GUO Xia)
To study the cytotoxicity of programmed cell death protein 1 (PD-1) knockout and glypican-3 (GPC3) modified chimeric antigen receptor T cells (GPC3-PD1gRNA-CART cells) on the human hepatoma cell line HepG2and the anti-tumor effect of GPC3-PD1gRNA-CART cells on the severe immunodeficiency mouse model of liver cancer.GPC3-PD1gRNA-CART cells were prepared and the expression of GPC3 CARs and PD-1 were analyzed by flow cytometry. Inexperiment, the cytotoxicity of GPC3-PD1gRNA-CART cells stimulated with concanavalin A (ConA) on HepG2 cells was observed by LDH assay, and interferon-γ (IFN-γ) level was tested by ELISA when co-culturing the GPC3-PD1gRNA-CART cells with HepG2 cells for 18 h at different effect/target ratios (4:1, 2:1, 1:1). GPC3 CART and ConA-stimulated GPC3 CART were set up as control. The severe immunodeficiency mice (NDG) subcutaneous tumor model was established to assess anti-tumor effect of the GPC3-PD1gRNA-CART cells. In the subcutaneous tumor model study, there were three groups: the model group and two experiment groups (GPC3-PD1gRNA-CART group and GPC3 CART group), which were received the subcutaneous injection of HepG2 cells (1 × 106). When the diameter of tumor tissue reached 3 mm, GPC3-PD1gRNA-CART, GPC3 CART and model groups were intravenously injected with 5 × 106GPC3-PD1gRNA-CART cells, 5 × 106GPC3 CART and 0.9% NaCl in 0.2 ml respectively, once a week for 3 weeks. The tumor volume was calculated at a 2-day interval and the pathological changes in the tumor tissues were observed for comparison.The GPC3 CAR expression rate of the GPC3-PD1gRNA-CART cells was more than 98.8%. The expression rate of PD-1 in GPC3 CART cells was 11.1%, which was increased to 92.1% after the stimulation with ConA, while the expression rate of PD-1 in GPC3-PD1gRNA-CART cells was only 60%, confirming the effective knockout of PD-1 gene. Inexperiments, the killing effect and IFN-γ level of GPC3-PD1gRNA-CART cells stimulated by ConA on HepG2 cells were gradually increased at the effect/target ratios of 1:1, 2:1 and 4:1. At the same effect/target ratio, the killing effect and the IFN-γ level of the GPC3-PD1gRNA-CART cells stimulated with ConA on HepG2 cells were significantly higher than that of the GPC3 CART cells stimulated by Con A (< 0.05), indicating that PD-1 gene knockout in CART could reverse the inhibitory function of CART cells. The results inexperiments showed that the tumor volumes in GPC3-PD1gRNA-CART group shrank 87.30%, and there was a significant difference when comparing with GPC3 CART group (69.03%) and the model group (< 0.05). The pathological changes of tumor tissues showed that the tumor area in the experiment groups was significantly decreased, and the effect of GPC3-PD1gRNA-CART group was better than GPC3 CART group.GPC3-PD1gRNA-CART cells can effectively kill liver cancer cellsand, providing a potential strategy for liver cancer therapy.
liver cancer; chimeric antigen receptor T cell; genome editing
ZHANG Yun, Email: zhangyun@wingor.net
深圳市战略新兴产业发展专项资金(JSGG201708161531 17109)
张芸,Email:zhangyun@wingor.net
2020-09-16
10.3969/j.issn.1673-713X.2021.01.004

