五指毛桃组织培养快繁体系的研究
陈英之 ,霍秀意 ,欧阳蒲月 ,2,甘凤琼 ,李良波 ,黄荣韶
(1.广西大学农学院,南宁 530004;2.广东食品药品职业学院,广州 510520;3.广西中医药大学药学院,南宁 530200)
五指毛桃(Ficushirtavahl)又称为五指牛奶、粗叶榕、土北芪及五爪龙等,是桑科榕属植物,具有活络舒筋、补肺健脾和行气利湿等功效,用于肺痨咳嗽、脾虚浮肿、盗汗、食少无力、月经不调、带下、水肿、产后无乳、风湿痹痛等症[1-3]。作为珍贵的药用植物资源,五指毛桃是多种中成药的原料,已广泛应用于临床治疗上。此外,五指毛桃还是药食同源的植物,可以制成一些汤料、保健饮品、速溶粉等保健产品。
近年来,对五指毛桃的报道主要集中在品种的考证、化学成分分析、药理活性等方面。组织培养方面,蒋林等[4]以五指毛桃茎节为外植体进行离体再生研究,黄赛等[5]以顶芽为外植体进行芽增殖培养研究。苏钰琴[6]以五指毛桃茎尖外植体,进行了初代培养、继代培养和生根培养试验。李林轩等[7]以叶片作为外植体,进行不同激素对比研究。陶瑜等[8]以新鲜五指毛桃种子为试验材料,比较了6-BA、NAA及2,4-表油菜素内酯(2,4-EBL)对其愈伤组织的诱导率及根发生率的影响。本试验通过在培养基中添加不同的细胞分裂素和生长素诱导五指毛桃种子萌发,以种子萌发率、不定芽增殖倍数、生根率、移栽成活率及组培苗的生长情况为指标来确定适合五指毛桃繁殖的培养基配方和移栽基质,建立五指毛桃组织培养快繁体系,为大规模生产、保护五指毛桃的种质资源、缓解五指毛桃供不应求的市场压力,同时为五指毛桃产业发展提供技术支撑;解决五指毛桃资源短缺制约产业发展的问题,实现对种质资源的优化和快速利用。
1 材料与方法
1.1 材料
五指毛桃种子采自广西南宁市邕宁区那楼镇广泽健康产业种植基地。将无病虫害、生长健壮且成熟的五指毛桃果实搓烂果肉,取出种子。
1.2 方法
1.2.1 种子处理 在超净工作台上,先用无菌水浸洗五指毛桃种子2次,每次浸洗2~3 min,浸洗时轻轻摇晃,再用75%乙醇浸洗30 s,无菌水冲洗3~4次,然后用0.1%HgCl2消毒12 min,用无菌水冲洗4次,置于无菌滤纸中晾干水分,接入培养基中。
1.2.2 接种 将消毒好的种子接入5种不同的培养基:以MS为培养基的基础上,分别添加不同浓度的椰汁(0%、10%、20%)、不添加椰汁且将MS的量减半、10%的椰汁+6-BA1.5+NAA0.2。培养基中均添加20 g/L蔗糖、6.0 g/L琼脂,pH调为5.8~6.0;培养基分装后,于121℃高压灭菌锅中灭菌30 min。
每瓶培养基接种5粒种子,在培养基上均匀分布,每个处理设2次重复。置于培养室中培养,培养室条件:温度25℃,日光灯照明,光照时间12 h/d,光照度为1 500~2 000 lx。每隔3 d观察1次,统计种子的萌发率和观察种苗的长势。
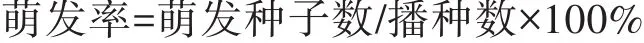
1.2.3 增殖培养 选取长势较好的五指毛桃种子萌发无菌苗,在超净工作台上用无菌手术刀将其切成1~2 cm的带腋芽的茎段,接种到不同的培养基配方中。
以MS为培养基的基础上,不添加任何植物生长调节剂、添加不同浓度的细胞分裂素6-BA(0.5、1.0、1.5 mg/L)和 NAA(0.3、0.6 mg/L)进行双因素试验,筛选出适合五指毛桃繁殖的培养基配方。每个处理5瓶,每瓶5个单芽。接种后置于培养室中培养,每隔3 d观察1次,统计组培瓶内五指毛桃的增殖芽数、观察苗的生长情况。
1.2.4 生根培养 选取生长良好的继代苗,剪成带腋芽的茎段或单芽,转入生根培养基。生根培养以1/2MS为培养基的基础上,不添加任何植物生长调节剂、添加0.3 mg/L NAA和不同浓度的IBA(1.0、1.5、2.0 mg/L)。每种处理接4瓶,每瓶5颗苗。接种后置于培养室中培养,每隔3 d观察1次,统计组培瓶内五指毛桃的生根率及根条数,观察各处理间组培苗的生长情况。
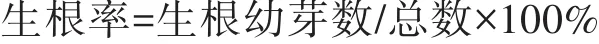
1.2.5 移栽试验 不同移栽基质以及组培苗在前期无菌条件下的生长情况影响着其成活率,为筛选出适合组培苗生长的基质,本试验将茎高达5~6 cm且具有4~5条根的组培苗移栽至6种经121℃灭菌30 min不同的基质(珍珠岩、蛭石、育苗基质、育苗基质∶珍珠岩(1∶1)、育苗基质∶蛭石(1∶1)、珍珠岩∶育苗基质∶蛭石(1∶1∶1)中,每种处理装10杯,每杯1株苗,比较移栽后苗的成活率和苗的生长情况。
2 结果与分析
2.1 无菌苗的培养
不同配方培养基对五指毛桃无菌种子萌发的影响结果见表1,种子萌发后的生长情况如图1所示。结合表1和图1可以看出,种子萌发率最高的培养基为处理1、处理2、处理3,萌发率均为70%,苗长势最好的培养基为处理2(即1/2MS);加入椰汁反而不利于种子萌发,当增加椰汁浓度时,种子的萌发率降低;同时加入椰汁、6-BA和NAA两种植物生长调节剂时,种子的萌发率最低,只有30%。由此可知,1/2 MS+20 g/L蔗糖+6.0 g/L琼脂为五指毛桃种子萌发最适的培养基。
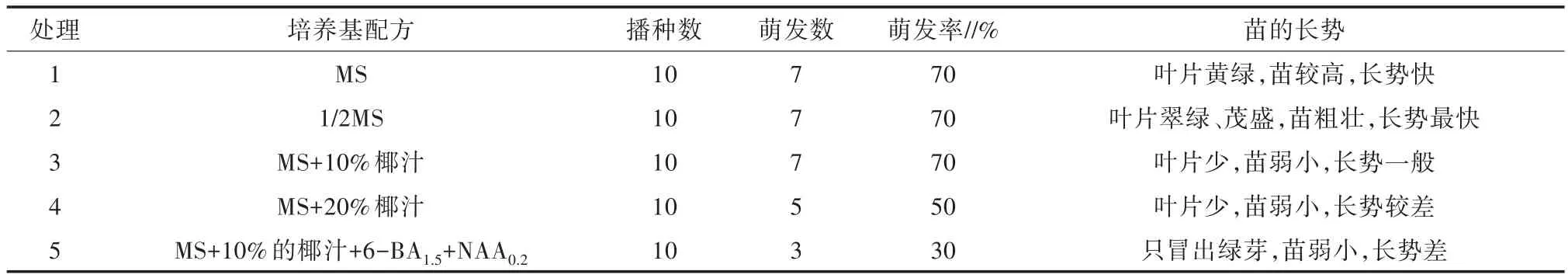
表1 培养基对五指毛桃种子萌发的影响
2.2 继代培养
不同处理间的增殖倍数和苗的生长情况见表2和表3,不同浓度的细胞分裂素和生长素所培养出来的五指毛桃组培苗的增殖情况如图2所示。结合表2和表3及图2可以看出,不添加任何植物生长调节剂时,五指毛桃的增殖倍数最高,可达到3.40;添加植物生长调节剂的情况下,当添加细胞分裂素6-BA 0.5 mg/L、生长素NAA 0.3 mg/L时芽增殖最多,增殖倍数为3.04;通过方差分析可知,NAA对五指毛桃增殖培养的重要性大于6-BA,6-BA不同浓度水平间的差异显著,NAA不同浓度水平间的差异极显著,而6-BA和NAA两种植物生长调节剂的交互作用对五指毛桃的增殖培养差异不显著。当6-BA的浓度不变,NAA浓度增加时,增殖倍数降低,且苗的长势较弱;当NAA的浓度不变,6-BA浓度增加时,增殖倍数也降低,但是降低的幅度相对较小,NAA的浓度变化对苗的增殖和长势影响较显著。当NAA浓度为0.6 mg/L时,愈伤组织较多,且苗出现褐化现象。由此可知,MS+20 g/L蔗糖+6.0 g/L琼脂为五指毛桃增殖最适的培养基,高浓度的6-BA和NAA不适合五指毛桃的增殖培养。

图1 五指毛桃种子在不同培养基中的生长情况比较
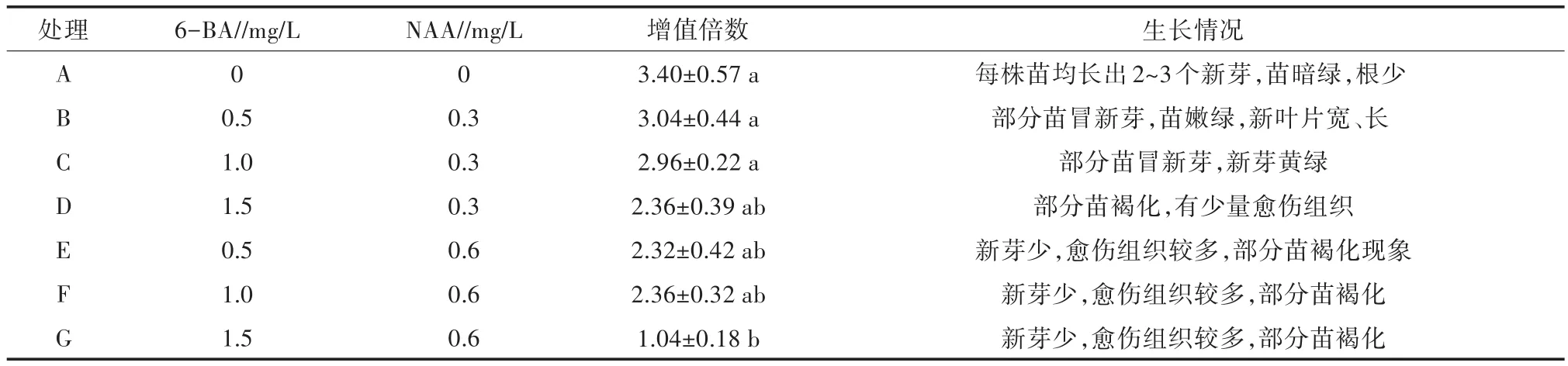
表2 不同浓度的生长调节剂组合对五指毛桃组培苗增殖的影响
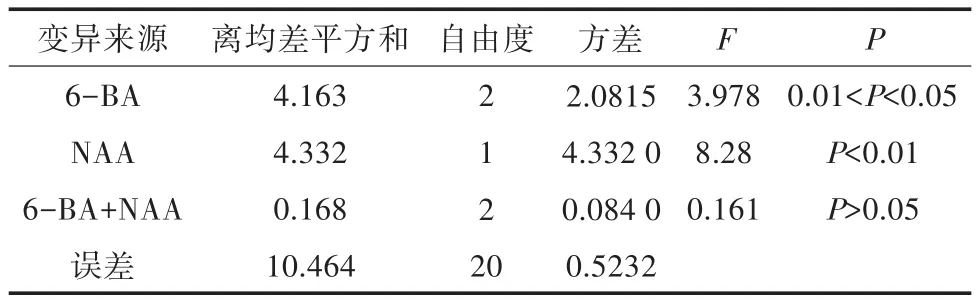
表3 不同培养基增殖培养方差分析

图2 不同培养基配方五指毛桃的增殖比较
2.3 生根培养
不同浓度的IBA对五指毛桃组培苗影响结果见表4和表5,生根情况如图3所示。结合表4、表5和图3可以看出,不添加任何植物生长调节剂(即1/2MS)的生根率最高,达到100%,其组培苗的长势也是最好的。当添加IBA和NAA时,增加IBA的浓度,生根率降低,且苗长势也会随IBA浓度的增大而变差。通过方差分析可知,IBA不同浓度水平对五指毛桃生根的影响差异显著,各处理的重复间无显著的差异性。由此可知,1/2MS+20 g/L蔗糖+6.0 g/L琼脂为五指毛桃生根最适的培养基,生根率达100%。
2.4 移栽
取茎高达5~6 cm且有4~5条根的组培苗(图4)移栽至不同的基质中。五指毛桃组培苗成活率结果见表6,五指毛桃组培苗移栽第1天和移栽后30 d苗的生长情况见图5和图6。结合图5和表6可以看出,五指毛桃成活率最高的移栽基质为珍珠岩,高达90%;成活率最低的基质为育苗基质;在育苗基质∶蛭石(1∶1)的移栽基质中,苗的长势最好。综合苗的质量情况,最适合五指毛桃移栽的基质为育苗基质:蛭石(1∶1)。
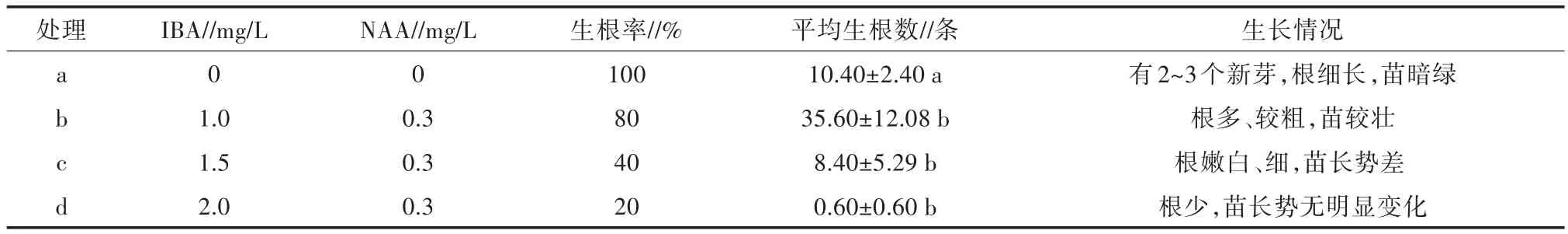
表4 不同浓度的IBA对五指毛桃生根的影响
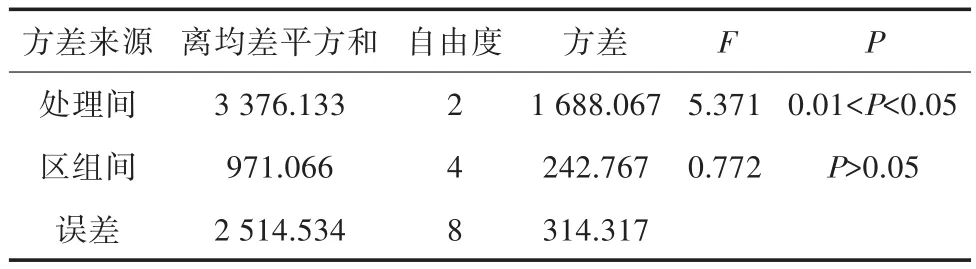
表5 生根培养基平均生根数的方差分析

图3 不同浓度的IBA对五指毛桃生根的影响
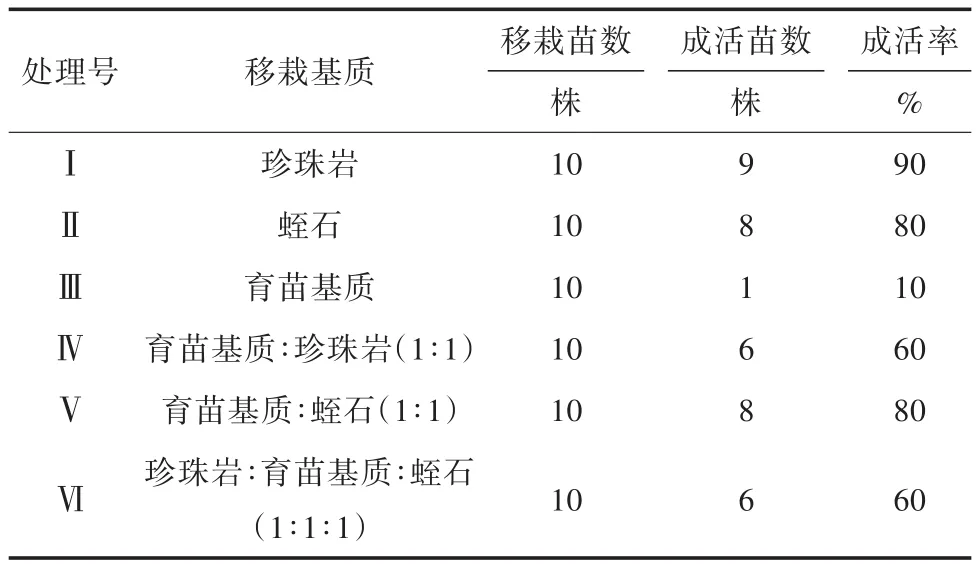
表6 不同移栽基质五指毛桃成活率

图4 移栽前的组培苗

图5 移栽第1天的组培苗

图6 移栽后30 d五指毛桃的生长情况比较
3 讨论
3.1 培养基添加物对五指毛桃种子萌发的影响
前人在植物组织培养的实践过程中发现,在培养基中添加一些适宜的天然附加物可以促进培养物的生长发育,常用的附加物有椰汁、番茄汁、土豆汁和香蕉泥等[9]。天然的椰汁中含有丰富的营养,在植物组织培养中得到了广泛的应用。
王楷等[10]研究表明,在培养基中添加10%的椰汁能提高白芨种子的萌发率,对原球茎的生长起到促进作用。孙玉芬[11]对兰属杂交种子无菌播种的试验研究发现,添加椰汁对种子萌发的效果反而较不添加的效果差。
本试验结果与王楷等[10]的研究结果不同,与孙玉芬[11]的研究结果相似。添加椰汁不利于五指毛桃种子的萌发,分析原因可能是椰汁对五指毛桃种子萌发无促进作用,过高浓度的椰汁抑制种子的萌发;也可能与椰汁中含有一些激素、氨基酸及酶等营养物质有关。
3.2 五指毛桃增殖培养组培苗的褐化现象
在植物组织培养过程中,许多组培苗会产生酚类物质,导致褐化现象的产生,木本植物的褐变现象较严重[12]。褐化现象不仅与植物自身有关,而且还与外植体的处理、培养条件及植物激素的使用等有关[13,14]。
蒋林等[4]进行探讨发现,影响五指毛桃褐变的因素包括培养环境的光照与温度条件、培养基的成分及植物体内的酚类物质。本试验结果表明,五指毛桃组培苗出现褐化现象可能与培养基中NAA的浓度有关,还可能与不同激素浓度影响着五指毛桃产生酚类物质的程度有关,试验结果与蒋林等[4]对五指毛桃组织培养中褐变的原因探讨结果相似。
3.3 IBA和NAA对五指毛桃生根的影响
IBA能促进细胞分化、根系增多及伸长[15],NAA可以促进细胞分裂和扩大,两种激素对五指毛桃的生根都有显著影响。在生根培养过程中,可单独使用IBA或NAA,也可两种激素同时配合使用,不同激素配比及浓度得到的生根效果不同。
本试验结果显示,同时添加IBA和NAA对五指毛桃生根的效果较不添加时的效果差,当不添加IBA和NAA时,五指毛桃组培苗的生根率最高,与李林轩等[7]报道的诱导五指毛桃生根最适培养基为1/2MS+1.0 mg/L IBA+0.3 mg/L NAA的结果不同。尹明华等[16]对黄独试管苗进行生根研究表明,适当浓度的NAA能促进生根;付文奇等[17]研究东方百合幼苗的根系生长,适宜的NAA和IBA配比能提高根系的活力,促进生长。本试验中,IBA和NAA对五指毛桃的生根未表现出促进作用。这可能与本试验设计的激素浓度范围不适合五指毛桃生根相关;也可能与五指毛桃自身在生长过程中产生的内源激素与所添加的外源激素相互作用有关。
3.4 不同基质对五指毛桃移栽的影响
移栽试验是检验组培苗能否适应田间环境的途径,而移栽成活率的高低又决定着组培苗能否实现产业化,不同移栽基质的移栽效果不同。李林轩等[7]研究结果显示,泥炭∶珍珠岩(1∶1)是五指毛桃移栽最好的基质,本试验结果与其研究结果有差异。本试验结果中,珍珠岩中五指毛桃的成活率最高,可能与珍珠岩的通气性好、杂菌极少有关;其苗的长势不佳,可能与珍珠岩中无养分有关。
在五指毛桃快速繁殖中以种子为外植体,在MS培养基上培养,不添加任何激素,就可以生长发育为带根的可移栽的幼苗,大大缩短了五指毛桃组培苗的培育时长,提高了快速繁殖的效率,为五指毛桃快繁体系的建立提供了新途径。

