抗冻蛋白的制备及对冷冻面筋蛋白的改良研究进展
(刘 玫 马 豪 梁 赢 张 晖郑学玲 李利民 刘 翀 段武奇
(河南工业大学粮油食品学院1,郑州 450001)
(江南大学食品学院2,无锡 214122)
(河南工业大学生物工程学院3,郑州 450001)
抗冻蛋白(antifreeze proteins,AFPs)是一类能够与冰晶结合,具有热滞活性、修饰冰晶形态及抑制冰晶重结晶等特性的活性蛋白[1]。基于此特性其能够很好改善冷冻食品的产品质量,减少冷冻对产品结构和性质的破坏[2,3],因此在冷冻食品领域具有广阔的应用前景。然而AFPs在生物体内的含量极低且提取纯化困难,这导致AFPs长期以来难以实现工业化生产,也未能在冷冻食品改良中发挥关键作用。因此,需要寻找合适的方法提高AFPs的产量,促进AFPs的应用和发展。
冷冻面团技术是提升面制品工业化水平的重要途径,但冷冻面团在冻藏过程中的品质劣变导致产品(如面包和馒头)出现醒发时间延长、体积变小、口感变差及货架期缩短等问题,这限制了速冻面制品的进一步发展[4,5]。小麦面筋蛋白作为面团的重要组成部分,具有独特的持水性、黏弹性和起泡性,对面团强度、延展性和持气性起到决定性作用,其品质优劣也直接决定了面制品的最终食用品质[6]。有研究表明冻藏过程中冰晶生长和重结晶会破坏面筋蛋白网络结构,使面筋蛋白分子解聚,二级结构发生变化,流变学特性改变,最终影响面团品质[7-9]。
因此,具有抑制冰晶重结晶特性的AFPs能够较好地改善冷冻面筋蛋白品质。但AFPs的工业化生产与应用还需要进一步的研究探索。本文综述了AFPs的生产现状及抗冻蛋白对冷冻面筋蛋白的改良研究,以期为AFPs在冷冻面制品中的应用提供参考。
1 抗冻蛋白(AFPs)
1.1 AFPs的特性
在越冬生物体内,AFPs能够降低冷冻胁迫对细胞的破坏作用,这源于其具有几个特性:1) 降低冰点。AFPs能降低溶液冰点,使得溶液冰点与熔点之间存在差值,这种特性称为热滞活性。一定范围内,热滞活性可以保持生物体细胞液处于不冻状态,避免冰晶形成对细胞膜的破坏作用。可根据热滞活性的不同将AFPs分为高热滞活性AFPs和中度热滞活性AFPs。昆虫类AFPs的热滞活性最高,能够降低溶液冰点6 ℃左右[10];鱼类AFPs的热滞活性次之;植物类AFPs的热滞活性较低,只有0.2~0.6 ℃[11]。2) 修饰冰晶形态。AFPs能够结合到冰晶表面,抑制冰晶生长,改变冰晶形态,减弱冰晶对细胞膜的机械破坏。通常,中度热滞活性AFPs可以结合到冰晶的棱柱面和/或棱锥面上使得冰晶呈现六棱锥形状,而高热滞活性AFPs除了可以结合到冰晶的棱柱面和/或棱锥面上之外,还可以结合到冰晶的基面上,从而使得冰晶形态似圆盘形状[12]。其冰晶形态示意图如图1所示。3) 抑制重结晶。重结晶指冰晶在已形成的晶体颗粒间的生长重分配,导致冰晶数量减少、颗粒增大。AFPs可以减缓冰晶结合速率,极低浓度下即可抑制冰晶重结晶[13]。植物类AFPs具有强抑制冰晶重结晶的能力[14]。4) 调节原生质体过冷状态。AFPs可以调节原生质体过冷状态,降低过冷点,增加冰晶成核率,形成大量小冰晶[15]。
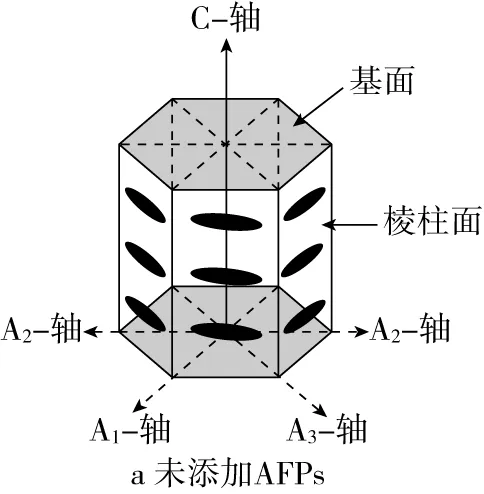
图1 冰晶形态示意图[24]
1.2 AFPs的生产现状
天然AFPs来源广泛,且结构各异。按其生物类别可分为植物类AFPs、鱼类AFPs、昆虫类AFPs、真菌及细菌AFPs等[16],如表1所示。它们的结构和抗冻活性差异较大,也不存在同源性基因序列,因此,天然AFPs具有多样性和复杂性[17]。

表1 天然AFPs的分类
这些天然来源的AFPs在生物体内的含量较少,从天然来源提取AFPs仍处于实验室规模的水平,制备得到的AFPs产量很低,且生物体内成分复杂,提取和纯化步骤繁琐,不同来源AFPs的提取方法也会有较大差异,成本高,不利于工业化生产,更难以满足研究和应用的需求[37]。
目前通过化学方法可以合成高纯度的AFPs[38],更有利于研究其结构-功能的构效关系。例如,Kong等[39]化学合成了昆虫AFP (相对分子质量为8 700)的短肽类似物,发现其具有修饰冰晶形态的能力;Pentelute等[40]利用化学合成的方法制备了雪跳蚤AFP类似物及对映异构体,发现均具有抑制冰晶重结晶的作用。但是化学合成方法成本太高,难以广泛应用。
构建异源表达体系可实现多种重组蛋白的生产。目前已利用大肠杆菌和毕赤酵母异源表达了多种重组抗冻蛋白(rAFPs),如表2所示。
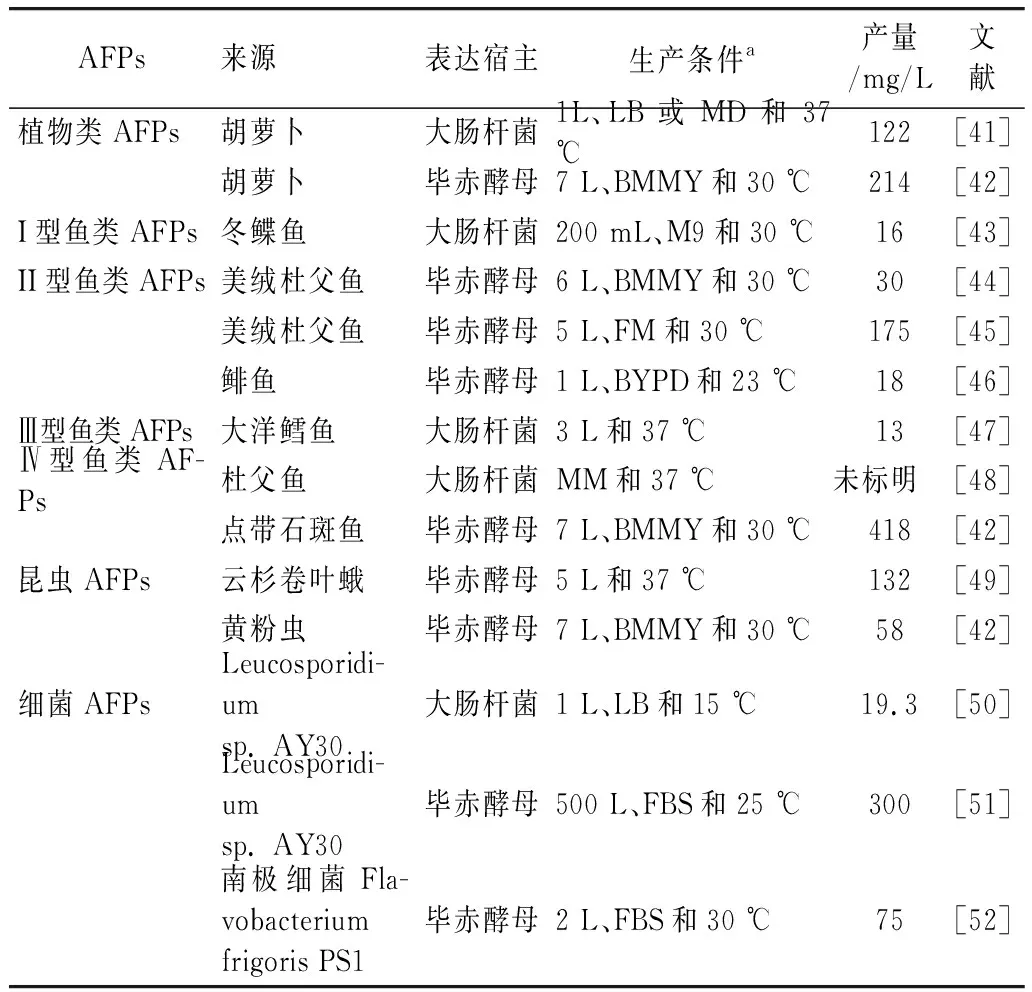
表2 AFPs在异源宿主中的表达
目前AFPs在大肠杆菌中异源表达产量可达136 mg/L,但鲜有报道其热滞活性[53]。大肠杆菌作为原核表达系统具有发酵时间短、生产成本低等优势[41],但是存在不足之处:1) 大肠杆菌产内毒素,不能用于食品中;2) 大肠杆菌胞内蛋白种类多,目的蛋白产量低,不利于后期纯化;3) 表达系统不具备蛋白翻译后修饰和加工的能力,所以不适用于真核蛋白的表达[54]。
毕赤酵母表达系统兼具原核和真核表达系统的优点,已迅速发展成为分子生物学领域广泛应用的表达系统之一,且毕赤酵母的安全等级为I级,由毕赤酵母生产的重组蛋白可应用于食品中[55]。研究表明利用毕赤酵母表达系统生产的目的蛋白易于分离纯化[56],且不存在内毒素残留[57],所得目的蛋白具有较好生物活性[58]。且毕赤酵母表达系统具有酿酒酵母系统的优点,可进行高密度发酵,易于进行工业化放大生产,提高rAFPs的产量[59]。因此,毕赤酵母表达系统在rAFPs的工业化生产方面具有广阔的应用前景。但是,从表2可以看出,目前研究最为广泛的鱼类AFPs在毕赤酵母中异源表达的最高产量也仅为418 mg/L。这说明目前毕赤酵母表达系统尚未解决AFPs高效生产的问题,这可能是AFPs的低表达水平和折叠问题[51]引起的。因此,利用毕赤酵母异源表达不同来源的AFPs仍具有研究必要性和较大的发展空间,对于实现不同特性rAFPs的规模化制备、开发rAFPs的应用价值及进一步探究AFPs的抗冻机制具有重要意义。
2 AFPs对冷冻面筋蛋白品质改良研究
冷冻面团由于其方便、快捷、卫生、利于连锁企业标准化生产等优势,具有很好的发展前景[4,5]。但冷冻面团在运输储藏过程中,温度波动引起的冰晶生长和重结晶会导致面团主要组分发生劣变[42],即面筋蛋白解聚,网络结构遭到破坏,导致面团持气能力降低[6];酵母活性降低,面团后期发酵能力不足[60,61];淀粉颗粒损伤,理化特性改变[62,63];水分迁移率增大,面团内部脱水严重[64],这最终导致面团及其制品品质劣变。酵母产气能力下降和面筋蛋白品质劣变是导致冷冻面团品质劣变的主要原因[6]。耐冻酵母的筛选在一定程度上解决了酵母活性降低的问题。对于面筋蛋白品质劣变问题,国内外学者也做了大量研究,包括使用亲水胶体、乳化剂、酶制剂、抗冻蛋白等改良剂改善其品质[65]。其中AFPs作为一种新型添加剂,具有很好的抑制冰晶重结晶效果,能够减轻冰晶对面筋蛋白的机械损伤,且能够降低体系的水分流动性,减弱冷冻引起的脱水。目前已经有较多研究报道了AFPs对冷冻面筋蛋白的影响。
2.1 天然AFPs对冷冻面筋蛋白的改良
目前 AFPs 在冷冻面筋蛋白中应用的报道主要集中于天然 AFPs 对冷冻面筋蛋白品质的改良研究。由于天然AFPs良好的冰晶调节特性,在冷冻及冻藏过程中能够减弱冰晶对面筋蛋白的破坏,从而能够有效改善冷冻面筋蛋白的组分、结构及功能特性。
2.1.1 AFPs对冷冻面筋蛋白组分的影响
小麦面筋蛋白由麦醇溶蛋白、麦谷蛋白、麦清蛋白和麦球蛋白组成,其中麦醇溶蛋白约占蛋白总量的50%,麦谷蛋白约占蛋白总量的35%~45%。麦谷蛋白和麦醇溶蛋白分别决定面团的黏弹性和延展性,对面筋网络结构、冷冻面团及其制品质量具有重大影响。而冻藏处理会导致湿面筋蛋白分子质量下降,其中ω-麦醇溶蛋白部分降解,麦谷蛋白HMW-GS全部降解,LMW-GS亚基组分有一定程度增加,表明冷冻处理破坏了维持HMW-GS和ω-麦醇溶蛋白结构的化学键,使蛋白质发生解聚和降解,而在加入AFPs后,冻藏导致面筋蛋白分子质量变化的现象有所减缓,这可能是由于AFPs抑制冰晶重结晶及修饰冰晶形态成规则的六边形状,使冰晶对蛋白网络的破坏力减弱,从而有效地为面筋蛋白提供抗冻保护作用[66,67]。
2.1.2 AFPs对冷冻面筋蛋白结构特性的影响
湿面筋蛋白在冻藏过程中,由于冰晶形成和重结晶效应所产生的大冰晶会对其产生机械破坏,导致面筋网络出现空洞破损,且随着冻藏时间的增加,空洞孔径增大,而在添加冰结构蛋白[67]、大麦籽粒AFP[23]、苜蓿叶AFP[66]、燕麦AFP[22]后,虽然也有孔洞产生,但其空洞较小且分布较均匀,表明AFPs能够抑制冰晶重结晶,使冷冻湿面筋蛋白内外可冻结水形成均匀且较小的冰晶,降低对湿面筋蛋白网络结构的破坏程度。随着冻藏时间的延长,面筋蛋白的二级结构也发生显著变化,α-螺旋含量下降,β-折叠含量增加,这可能是由于冻藏过程中冰晶重结晶,导致α-螺旋氢键弯曲,二硫键断裂,结构遭到破坏,产生新的小分子物质,这些小分子物质在共价键的作用下发生交联,从而加剧了β-折叠,而添加AFPs能够抑制冰晶重结晶,在一定程度上阻止水分子的迁移,减少冻藏处理对面筋蛋白二硫键和氢键的破坏,从而减小面筋蛋白分子结构的变化[66,68]。
2.1.3 AFPs对冷冻面筋蛋白功能特性的影响
面筋蛋白的流变学特性与面团及其制品品质密切相关。经冻融处理后,湿面筋蛋白的弹性模量和黏性模量逐渐下降,这可能是由于赋予面筋蛋白弹性的麦谷蛋白和赋予面筋蛋白延展性的麦醇溶蛋白,在冻藏过程中受到冰晶的机械破坏,发生解聚和降解,而添加AFPs能显著提高湿面筋蛋白冻藏过程中弹性模量和黏性模量,表明AFPs能够保护冷冻湿面筋蛋白,降低冰晶重结晶对面筋基质的机械破坏而导致的面筋组分的降解[22,23]。
冻融处理对小麦面筋蛋白的物理改性也会导致其持水性、持油性、乳化性和乳化稳定性等功能特性发生变化。在冻融过程中,由于冰晶的形成导致水分子与面筋蛋白的极性和非极性氨基酸的交联被破坏,使部分结合水被释放从而造成水分的分离,小冰晶不断聚集形成大冰晶,损伤面筋网络,导致面筋体系持水率下降及水分流失,可冻结水含量增加,而在添加AFPs后,能够有效减缓这种变化,AFPs与冰晶结合,抑制了冻藏过程中冰晶的生长和重结晶,减少了冰晶对面筋网络的破坏,阻止了水分从面筋网络中离析,从而有效保护了冷冻面筋蛋白的持水率[66,67,69]。小麦面筋蛋白的持油性在冻融过程中呈上升趋势,这可能是由于冰晶的作用导致面筋蛋白构象发生变化,疏水基团暴露程度升高,从而使面筋蛋白持油性升高,而添加AFPs能够抑制冰晶重结晶,减少疏水基团暴露,减缓持油性的上升[70]。蛋白质的乳化性和乳化稳定性对食品品质也有一定影响。一般,蛋白质溶解性越好,乳化性也越好,而冻融处理后小麦面筋蛋白变性加剧,溶解度降低,从而使小麦面筋蛋白乳化性降低,但变性使其亲水-亲油平衡性更好,从而使小麦面筋蛋白乳化稳定性更好,而加入AFPs可能抑制了面筋蛋白的变性,提高了蛋白的溶解性,从而提高了面筋蛋白的乳化性,但其乳化稳定性有所下降[70]。
2.2 rAFPs对冷冻面筋蛋白的改良
rAFPs由于其产量高、易纯化、具有较好生物活性等优势,在冷冻食品工业中的应用有很好的发展前景。刘玫等[42]利用重组毕赤酵母表达系统生产得到三种rAFPs,重组胡萝卜抗冻蛋白(rCaAFP)、重组点带石斑鱼抗冻蛋白(rFiAFP)和重组黄粉虫抗冻蛋白(rTmAFP),都具有较好的生物活性,并将其应用于冷冻面筋蛋白中发现其能够有效改善冷冻面筋蛋白冻结及冻藏过程中的结构特性和物理性能。
2.2.1 rAFPs对冷冻面筋蛋白结构特性的影响
在冻结和冻藏过程中,三种rAFPs均可以通过减少冻结和冻藏对麦谷蛋白和醇溶蛋白非共价键系统的破坏,阻止了α-螺旋结构向其他二级结构的转变,从而更有利于面筋蛋白的二级结构保持相对稳定。另外,rAFPs通过修饰冰晶形态并抑制冻藏阶段冰晶的重结晶减弱了冻结和冻藏对面筋蛋白结构造成的挤压和破坏,使得其网络结构更为连续完整。rTmAFP和rCaAFP分别在冻结阶段和冻藏阶段对面筋蛋白二级结构及微观网络结构的保护效果最为显著。
2.2.2 rAFPs对冷冻面筋蛋白冻融特性及水分特性的影响
三种rAFPs均能降低面筋蛋白的冻结温度和提高其融化温度,引起冻结滞后和较小的熔融滞后,这可能是由于rAFPs不可逆的与冰晶结合,抑制了冰晶的生长,同时也减缓了冰晶的融化过程,其中,rTmAFP引起冻结滞后现象的效果最显著,表明其具有较高的热滞活性,这与其天然蛋白的特性一致。另在冻结阶段,添加这三种rAFPs均能减少面筋蛋白和麦谷蛋白中可冻结水含量的增量,而对麦醇溶蛋白的可冻结水含量变化无显著影响,表明rAFPs主要是通过减少麦谷蛋白中的可冻结水含量增加来降低面筋蛋白的可冻结水含量,从而减弱冻结过程冰晶形成对面筋蛋白的机械破坏,其中rCaAFP和rFiAFP的效果显著高于rTmAFP。在冻藏阶段引起面筋蛋白可冻结水含量增加的主要原因是温度波动引起的冰晶重结晶,添加这三种rAFPs均能在一定程度上抑制可冻结水含量增加,而rCaAFP表现出最强的抑制可冻结水含量增加的能力,表明rCaAFP保持了其天然抗冻蛋白,具有较好抑制冰晶重结晶能力的特性。
水分流动性对面筋蛋白和水之间相互作用形成具有黏弹性的网络结构至关重要。在冻结阶段可能由于面筋蛋白中疏水基团暴露导致蛋白质和水分子之间的作用力变弱,即水结合能力降低,从而导致水分向流动性更强的方向移动,而添加rFiAFP和rTmAFP能够减弱冻结对面筋蛋白水分流动性的影响,而rCaAFP 对冻结阶段面筋蛋白的水分流动性无显著影响;在冻藏阶段,面筋蛋白的水分向流动性更强的方向进一步移动,添加这三种rAFPs也能在一定程度上抑制面筋蛋白的水分流动性增强,且从整体上看,rCaAFP作用效果最显著。在冻结和冻藏阶段,面筋蛋白的水分会发生迁移和散失,而添加这三种rAFPs均能有效阻止其水分迁移和重新分布,且在冻结阶段rTmAFP效果最显著,在冻藏阶段rCaAFP效果更显著,表明重组鱼类AFPs保持了天然鱼类AFPs的高热滞活性特点,对样品中的冰晶形成过程影响最大,而重组植物AFPs与其天然AFPs一样能够较好地改善样品冻藏过程中温度波动引起的冰晶重结晶。
2.2.3 rAFPs对冷冻面筋蛋白热特性及流变学特性的影响
rAFPs能够提高冻结和冻藏阶段面筋蛋白的热稳定性,rTmAFP最有助于保护冻结阶段面筋蛋白的热稳定性,而在冻藏阶段,对于面筋蛋白来说,rCaAFP的保护效果最为显著;冻结阶段rAFPs对面筋蛋白热稳定性的保护主要是通过提高麦谷蛋白的热稳定性实现的,而冻藏阶段rAFPs 通过提高麦谷蛋白和醇溶蛋白的热稳定性改善了面筋蛋白整体热稳定性。
面团的流变性能可在一定程度上决定其最终产品品质,而其中面筋蛋白对面团流变性能起主要贡献作用[6]。冻结和冻藏阶段麦谷蛋白降解劣变导致面筋蛋白的流变学性质发生劣变,rAFPs能够通过减弱冻结和冻藏阶段冰晶形成和重结晶对麦谷蛋白中的GMP解聚程度、保护其网络结构以及提高蛋白与水分相互作用等方面来降低冷冻对面筋蛋白流变学性质造成的不利影响;rTmAFP和rCaAFP分别在冻结阶段和冻藏阶段对面筋蛋白流变学性质的保护效果最为显著;另外,rAFPs主要是通过保护麦谷蛋白的黏弹性实现对面筋蛋白流变学性质的保护。
综上所述,rAFPs均具有与其天然AFPs相似的抗冻特性,能够有效地为冷冻面筋蛋白提供抗冻保护,因此利用异源表达系统生产rAFPs是一种较好的制备方法,能够为AFPs的工业化生产和应用提供帮助。但关于不同rAFPs与冰晶的相互作用方式,以及rAFPs与面筋蛋白之间是否存在相互作用还鲜有报道,这都需要进一步的研究探索以更好地利用rAFPs改良冷冻面制品。
3 结论与展望
AFPs独特的结构和功能特性,使其能够在冷冻食品改良中发挥其他添加剂所不具备的多重作用。但天然AFPs在生物体内含量少且提取纯化困难,这限制了AFPs的工业化生产与应用。因此,探寻合适的异源表达体系生产rAFPs将是推动AFPs研究及应用的重要途经。面筋蛋白作为面制品的重要组成部分,其在冷冻及冻藏过程中的特性变化对于速冻面制品的品质至关重要,因此,下一步可利用异源表达体系生产更多具有较好抗冻活性的rAFPs,并研究AFPs对冷冻面筋蛋白的改良,以推进AFPs在冷冻食品中的应用及速冻面制品的改良。

