转基因玉米品系及转化体成分四重实时荧光PCR快速鉴定
(王凤军 陈 强 叶素丹 许海锋 宣红霞 杨伊平 周叶熹
(浙江经贸职业技术学院,杭州 310012)
《2019年全球生物技术/转基因作物商业化发展态势》报告显示全球转基因作物商业化种植面积已达到1.904亿公顷[1]。从1996年到2019年,全球转基因农作物商业化24年间,种植面积增长了约112倍,全球29个国家/地区累计种植27亿公顷[1]。全球共有71个国家/地区在食品、饲料和加工方面应用了转基因作物,已批准4 485项文件,涉及29种转基因作物的403个转化体[1]。转基因玉米在转基因作物中占有非常重要的地位,种植面积逐年稳步上升。截至2019年,全球转基因玉米的种植面积近6069万公顷,占转基因作物总面积的31.87%,占世界玉米总面积的31%左右[1],当前已经培育出了抗旱、抗虫、抗除草剂、抗病等多种性状的共238个转化体转基因玉米。目前国外主要种植的转基因玉米品系有Mon89034、MIR162、Bt11等品系。截至2019年8月,我国批准进口的转基因玉米转化体共计21个[3]。
随着我国农业转基因技术研究和农产品贸易的快速发展,研究、实验、生产、加工、经营和进口环节的农业转基因生物种类不断增多,需强化研究实验源头、田间种植和进口加工环节监管,加强标识管理和科普宣传,切实履行《种子法》《农业转基因生物安全管理条例》《农业转基因生物标签的标识》,保障农业转基因生物研究与应用健康发展,保障公众知情权和选择权[4,5]。转基因技术给人类带来诸多帮助,但也存在潜在的安全问题,如破坏生态环境、引起抗生素耐性、造成基因漂移、引发食物过敏、隐含对人及动物的潜在毒性等问题[6-9]。国外已批准种植和正在研发的转基因品系越来越多,但我国还未颁发转基因玉米种子生产许可证,所有转基因玉米品系均不可在我国进行商业化种植,仅能用作饲料或加工原料,因此有必要对转基因玉米品系进行筛查,控制未批准的转基因玉米品系在市场上的流通。
转基因成分的筛查检测及品系快速鉴定主要有蛋白质检测方法和核酸检测方法。由于蛋白质检测方法的局限性,以常规 PCR[10,11]、环介导等温扩增[12,13]、实时荧光PCR[14-16]、数字PCR[18,19]为主的核酸检测方法逐渐成为主要的检测手段。随着分子生物学技术的不断发展,新型高效的转基因检测技术也不断被研发出来。如徐君怡等[20]将Taqman微流控芯片技术应用于实时荧光平台可同时检测17种转基因玉米品系,检出限可达10~20拷贝,符合欧盟转基因产品检测方法最低性能要求;Piednoir等[21]利用高通量测序技术对转基因枯草芽孢杆菌进行测序,通过序列比对设计引物和特异性探针进一步运用qPCR进行确认鉴定;Turkec等[22]设计了转基因检测DNA芯片,对转基因大豆和玉米共设计了1 830个探针,可用于区分 12个转基因事件,并开发了一套数据算法来实现最大的检测通量和灵敏度。这些检测技术虽然通量较高,但检测技术较为复杂,结果分析需要通过生物信息学算法来实现,实验过程依赖于昂贵的设备与试剂,较难在日常检测过程中广泛应用。急需一种准确高效、简易可行、高通量的转基因成分识别和检测技术,保障食品农产品安全和转基因产业良性发展。
本研究通过靶标基因筛选,转基因阳性样品采集,核酸样本制备,多重引物和荧光探针组合筛选,反应体系优化以及方法学验证等过程开发建立了四重荧光定量PCR检测技术。该技术的使用可实现一个反应管中同时检测MIR162、Bt11、Mon89034三个玉米品系的特异性基因序列和一个玉米内源基因,缩短检测时限,节约试剂耗材成本,操作简单易行,满足高通量特征,为市场流通产品品系和转基因成分的实时监管和快速鉴定提供技术支撑。
1 材料与方法
1.1 材料
10%MIR162、10%Mon89034、10%Bt11、10%Mon810、100%Mon863、10%NK603、100%Bt176等转基因玉米标准品;CNAS T025-24/30、CNAS T0659-23/74/79/104/175、ACAS-T067-J273/J213,FAPAS GeMSU 56A/56B均为中国合格评定国家认可委员会(CNAS)/英国食品与环境研究院(FAPAS)能力验证样品;玉米阴性样本为“晶甜3号”“中农甜488(ZNT488)”“金甜玉808”“泰甜8号”“华珍”“珍甜6号”“金甜60”“珍早18”“甜糯3号”“加甜糯11号”。玉米深加工产品为本实验室2020年市售产品,共41个批次。
1.2 试剂
植物基因组DNA提取试剂盒(离心柱型)(DP305)、深加工食品DNA提取试剂盒(DP326)、QuantiFast Multiplex PCR Master Mix (204754)、探针与引物(Taqman):委托机构合成。
1.3 方法
1.3.1 样本核酸提取
将玉米种子和果实等未加工样本采用植物基因组DNA提取试剂盒(DP305)提取基因组DNA。玉米深加工制品采用深加工食品DNA提取试剂盒(DP326)提取基因组DNA,其中,裂解、分离、洗涤等过程按照试剂盒说明书操作,在DNA洗脱时,为增加基因组DNA得率,用50 μL进行洗脱,将离心得到的溶液再加入吸附柱CB3中,室温放置2 min后离心,获取的DNA溶液置于-20 ℃保存备用。
1.3.2 引物和探针设计
通过国际环境风险评估中心转基因数据库(CERA GM crop database,http://cera-gmc.org/index.php?action=gm_crop_database)和加拿大转基因产品库(http://www.agbios.com/dbase.php)收集得到目前已公开报道的商品化生产的转基因玉米品系信息,分析国外流通的常见品系以及我国批准应用和重点监控的转化体信息,选定MIR162、Mon89034、Bt11转基因玉米为检测靶标,选定玉米内源基因编码玉米淀粉合成酶异构体zSTSII-2(zSSIIb)作为体系质控物,通过NCBI和国内外专利检索得到三种玉米品系的特异性序列。采用 Vector NTI 11. 5 软件和Express 3.0软件在在其外源插入片段 3′端与玉米基因组的连接区序列上设计特异性引物和探针,并在NCBI Blast中进行产物特异性验证。探针荧光基团按照设备性能进行选择性标记,淬灭基团按照报告基团偏好确定。
1.3.3 转基因玉米品系多重荧光PCR方法建立
1.3.3.1 转基因玉米品系单转化体特异性验证
提取转基因玉米MIR162、Mon89034、Bt11以及非转基因玉米ZNT488基因组DNA,加入1.3.2设计的引物探针,采用GB/T 19295.5—2018《转基因产品检测 实时荧光定量聚合酶链式反应(PCR)检测方法》[23]标准中反应体系和参数进行单重实时荧光PCR扩增,设置阳性对照、阴性对照和空白对照,对扩增曲线进行分析,验证单个转化体引物探针设计的特异性。
1.3.3.2 转基因玉米品系多重荧光PCR反应条件优化
提取的MIR162、Mon89034、Bt11玉米基因组DNA,按照1∶1∶1进行混合,得到3个品系的混合DNA溶液,以此作为模板,使用引物和探针对进行多重实时荧光PCR扩增,以玉米内源基因zSSIIb扩增情况监控反应的有效性。通过单个转化体的退火温度梯度(52~64 ℃)确定各靶标基因的最佳退火温度区间,然后在共有区间范围内设置温度梯度,确定四重实时荧光PCR的最佳退火温度。以此退火温度,通过上下游引物和探针浓度十字交叉法(0.1~1.5 μL)确定4个靶标基因的引物探针的最佳浓度组合,最终确认多重荧光PCR反应体系和参数。扩增反应在ABI QuantStudio Q5实时荧光PCR仪中进行,实验设置3个平行重复,以MIR162、Mon89034、Bt11转基因玉米标准品的混合DNA为阳性对照,以非转基因玉米ZNT488为阴性对照,并设置非模板空白对照,以验证4个靶标基因之间有无信号干扰以及实验操作过程是否被污染。
1.3.4 转基因玉米品系多重实时荧光PCR特异性检测
提取转基因玉米MIR162、Mon89034、Bt11、NK603、T25、Bt176、Mon863、Mon810以及非转基因玉米ZNT488基因组DNA,对已知单组分DNA或多组分DNA使用多重荧光定量PCR体系进行多重检测,验证反应体系的特异性。
1.3.5 灵敏度检测
提取转基因玉米MIR162、Mon89034、Bt11样本基因组DNA,并按1∶1∶1比例混合作为DNA模板原液,将其进行10倍系列稀释,共稀释5个梯度,稀释介质为灭菌蒸馏水。根据玉米的单倍体基因组DNA长度为2 504 bp,混合样本经核酸蛋白分析仪测定浓度为20 ng/μL,按照式(1)计算玉米样品中的拷贝数[23]。将稀释后的DNA溶液为模板进行四重实时荧光PCR扩增,对扩增得到的Ct值和DNA模板拷贝数绘制标准曲线,计算4个检测靶标的扩增效率和检测低限。
(1)
式中:N为DNA拷贝数;ContDNA为DNA量/ng;LenDNA为基因组DNA长度/bp。
1.3.6 适用性检测
收集玉米种子,玉米深加工食品,转基因玉米标准品以及能力验证盲样等用品,其中包括实验室收集的转基因玉米标准品6种(Mon89034、MIR162、Bt11、MON863、MON810、NK603)及其混合DNA样本5种,中国合格评定国家认可委员会(CNAS)组织的能力验证样品(T067-J273),英国FAPAS分析实验室组织的能力验证样品(GeMSU56A和GeMSU568);来自不同农作物种子市场和互联网农作物销售商等10个玉米品系种子样本(晶甜3号、ZNT488、金甜玉808、泰甜8号、华珍、珍甜6号、金甜60、珍早18、甜糯3号、加甜糯11号),作为可种植的农作物活生物体代表。来自于农贸市场和超市的41份玉米食品,即罐装玉米(11批次)、玉米粉(20批次)、爆米花(10批次)。应用四重实时荧光PCR对这64份玉米及其深加工制品进行转基因品系及转化体成分进行检测分析。
2 结果与分析
2.1 样品核酸提取结果
提取的DNA溶液经0.7%琼脂糖凝胶电泳检测,条带清晰明亮,完整性好。经核酸蛋白分析仪检测,OD260/280大于1.5表明核酸纯度较高,蛋白质残留较少;OD260/230大于1.0,表明有机试剂和多糖的污染较低,提取的核酸较纯。结果表明提取效果良好,可用于实时荧光PCR检测。
2.2 引物和探针标记和筛选结果
针对转基因玉米内源基因zSSIIb和转基因玉米MIR162、Mon89034和Bt11转化体目标序列设计特异性引物和探针,为能在1个反应管中同时检测4个靶标,按照设备性能使用不同的报告基团和非荧光淬灭基团进行标记。将以上引物和探针采用GB/T 19295.5—2018《基因产品检测 实时荧光定量聚合酶链式反应(PCR)检测方法》标准中反应体系和参数分别对转基因玉米MIR162、Mon89034、Bt11以及非转基因玉米ZNT488基因组DNA进行单重实时荧光PCR扩增,得到单转化体的扩增结果与预期结果一致。筛选出用于多重荧光PCR的引物和探针序列见表1。

表1 转基因玉米品系特异性检测的引物和探针序列
2.3 多重荧光PCR反应条件优化结果
为了能够在同一反应管中检测4个靶标基因,并保持较高的反应效率,需对反应体系和条件进行优化。由于使用了商用化的多重荧光定量PCR预混液,主要优化的参数有退火温度、引物和探针浓度等。通过对MIR162、Mon89034、Bt11单一转化体以及内源基因zSSIIb分别设置退火温度梯度,进行单重实时荧光PCR反应,发现当退火温度太低时Ct出现的较晚,影响结果的灵敏度;当退火温度较高时无明显的指数型生长曲线。以MON89034为例,见图1,结果表明在56~58 ℃时3个转化体和内源基因均能有较好的扩增,且在该温度区间设置梯度进行四重实时荧光PCR反应,发现最佳退火温度为58 ℃。

图1 mon89034退火温度梯度单重荧光PCR扩增曲线图
通过十字交叉法和荧光标记的强弱与荧光信号之间的关系进行了引物和探针浓度优化,最终确定了最佳引物和探针浓度。优化后的扩增体系见表2。优化后的扩增参数为95 ℃预变性5 s;95℃变性15 s,58 ℃退火延伸1 min,变性和退火延伸共进行40个循环。

表2 转基因玉米品系的四重实时荧光PCR反应混合液组成
2.4 多重荧光PCR特异性检测结果
提取转基因玉米MIR162、Mon89034、Bt11、NK603、T25、Bt176、Mon863、Mon810以及非转基因玉米ZNT488基因组DNA,使用多重荧光定量PCR体系进行转基因品系鉴定,验证方法的特异性。图2分别为转基因玉米MIR162/Mon89034/Bt11混合样本、转基因玉米MIR162、转基因玉米Mon89034、转基因玉米Bt11、转基因玉米Mon863/NK603/T25/Bt176混合样本以及非转基因玉米ZNT488多重实时荧光PCR扩增反应结果。内源基因zSSIIb均产生了明显的S型扩增曲线,Ct值小于35,表明DNA提取过程和实时荧光PCR扩增有效。转基因玉米MIR162/Mon89034/Bt11混合样本为模板的反应管中转基因玉米MIR162、Mon89034、Bt11三个品系的转化体特异性基因序列均检出,表明样品中含有这三种玉米品系的转化体成分;在图2b~图2d中转化体特异性靶标基因仅在含有该基因的转化体玉米品系为模板的反应管中检出,非该转化体玉米品系不检出;在图2e~图2f中,Mon863/NK603/T25/Bt176混合样本和非转基因玉米ZNT488为模板的反应管中都仅有玉米内源基因zSSIIb检出,3种玉米品系的转化体特异性基因均未检出,表明这些样品中不含有这3种玉米品系的转化体成分。
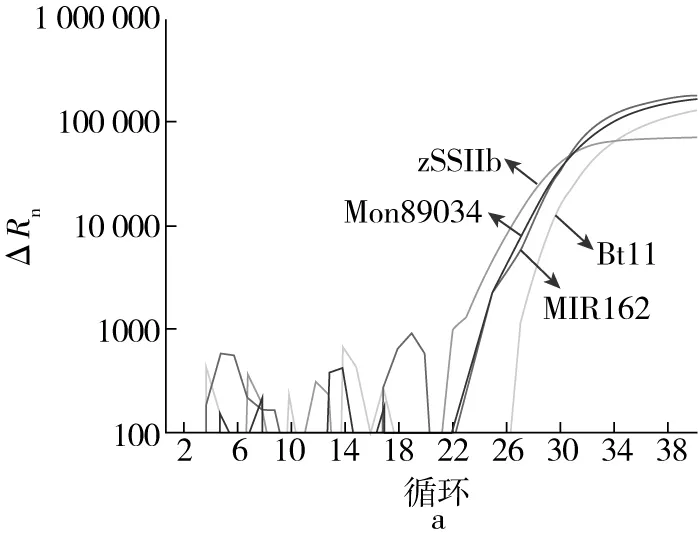
注:a为转基因玉米MIR162/Mon89034/Bt11混合样本;b为转基因玉米MIR162;c为转基因玉米Mon89034;d为转基因玉米Bt11;e为转基因玉米Mon863/NK603/T25/Bt176混合样本;f为非转基因玉米ZNT488。
以灭菌蒸馏水为模板的空白对照管中无荧光信号,表明检测基因之间无信号干扰,多重实时荧光PCR的反应结果与期望结果一致,表明引物探针的设计及反应体系的设置具有特异性,可用于玉米转基因品系及其转化体成分的快速鉴定。
2.5 多重荧光PCR重复性和灵敏度检测
通过建立转基因玉米MIR162、Mon89034、Bt11混合DNA溶液梯度稀释后四重实时荧光PCR的标准曲线,分析扩增的Ct值。四个基因相关系数R2为0.995~0.998。同一基因同一稀释梯度范围内Ct值的变异系数较小,重复性较好,如图3所示。zSSIIb基因线性回归方程为y=-3.152x+35.746,Ct值变化范围在22.366~35.324之间,标准偏差0.037~0.305,R2为0.996,扩增效率为107%;MIR162转化体特异性基因线性回归方程为y=-3.295x+37.677,Ct值变化范围在23.763~37.680,标准偏差在0.084~0.647,R2为0.998,扩增效率为101%;Mon89034转化体特异性基因线性回归方程为y=-3.458x+39.236,Ct值变化范围在24.701~38.912,标准偏差在0.160~0.876,R2为0.996,扩增效率为94.6%;Bt11转化体特异性基因线性回归方程为y=-3.266x+39.510,Ct值变化范围25.844~38.990,标准偏差在0.054~0.366,R2为0.997,扩增效率为102%,表明该四重实时荧光PCR扩增体系稳定灵敏,最低检测限可达18个拷贝。
2.6 样品检测结果
对市场流通的41份玉米加工食品样品,6种转基因标准品及其5种标准品混合样本,不同农作物种子市场和互联网农作物销售市场流通的10份农作物活生物体种子样本,3份非玉米成分样本,以及3份能力验证盲样样本等68份分样品进行转基因品系及转化体成分进行检测分析。同时按照GB/T 19295.5—2018《转基因产品检测 实时荧光定量聚合酶链式反应(PCR)检测方法》中所述的引物和探针、检测步骤和反应程序对样品进行检测[23],结果见表3。使用本研究建立的四重实时荧光PCR方法检测实验室收集的转基因标准品、能力验证盲样和阳性样本,检测结果与样本信息一致。使用四重实时荧光PCR检测10个玉米种子样本和41份玉米及其深加工制品样本结果与单重实时荧光PCR检测结果一致,只有内源基因zSSIIb检出,均为阴性结果。使用四重实时荧光PCR检测检测非玉米成分产品,4个靶标基因均无信号。表明本实验研究开发的四重实时荧光PCR快速品系鉴定体系适用于玉米转基因品系及其转化体成分的快速鉴定,尤其是大量样本的快速检测。

表3 四重荧光定量PCR适用性检测结果
3 讨论
转基因生物技术商业化在不断加速推进,但目前我国被批准进行商业化种植的转基因作物仅有棉花和木瓜,批准进口转基因品种包括大豆、玉米、油菜、棉花、甜菜等,但进口的转基因品种只能用作加工原料,不允许在国内种植。转基因产品合规性监控和检测方法种类繁多,其中蛋白质免疫印迹法实验过程复杂,耗时较长(通常在5 h以上),检测通量小,使用试剂复杂;酶联免疫吸附法灵敏度较PCR方法低,当外源基因表达的蛋白质含量极低时,难以检测出来;胶体金免疫层析法虽操作简便、耗时短,但检测灵敏度偏低,经过加工的转基因食品中靶蛋白质结构改变,不能被抗体识别。环介导等温扩增技术成本低廉,适合大规模筛查,但其对靶序列存在一定的限制,假阳性问题较为严重,易受到实验室气溶胶的污染容易产生非特异性扩增;基因芯片技术对于转基因食用农产品的检测,从实验成本考虑,价格过于昂贵,不适宜普遍推广应用。为提高转基因检测的准确性和时效性,急需开发建立能同时多基因检测且能避免常规PCR法缺陷的新方法。
多重荧光定量PCR方法兼具了荧光PCR实时定量与多重反应高通量的特征,是大批量样本筛查检测和快速鉴定的金标准。现已研发出可同时对番茄、大豆、玉米等农作物转基因成分进行筛查检测的四重实时荧光PCR,在品系鉴定方面研究应用较少。本研究通过检索国内外转基因数据库,从国内转基因监控较为关注的转基因玉米品系中确定检测靶标,建立多重荧光PCR检测技术。通过检测质控,方法学验证等确保检测准确性和可靠性。
4 结论
本研究利用实时荧光PCR法,根据多重荧光定量PCR反应中的特异性S曲线与对应的阈值大小判断被检样品中是否含有MON89034、MIR162、Bt11转基因玉米品系及其转化体成分。该检测方法设置了核酸提取质控、阳性对照、阴性对照和空白对照,可同时检测玉米内源基因和3个玉米品系的特异性靶标基因,扩增效率均在90%~110%范围内,最低检测限为18个拷贝。该方法可实现在一个反应孔中同时检测四个无荧光信号干扰的靶标基因,操作简单易行,从DNA提取到报告结果耗时不足 3 h,适用于大量样品的高通量检测,可为转基因玉米品系的快速鉴定和筛查提供参考。

