螺旋藻多糖提取物滴眼液对兔金黄色葡萄球菌性角膜炎的治疗作用
王瑶 刘廷 于洋 王欣 宋方英 杨玲玲
作者单位:1山东第一医科大学附属青岛眼科医院 266071;2山东第一医科大学(山东省医学科学院)山东省眼科研究所 山东省眼科学重点实验室-省部共建国家重点实验室培育基地266071
细菌性角膜炎是严重威胁视力的常见致盲性眼病,金黄色葡萄球菌是细菌性角膜炎的常见致病菌[1,2]。金黄色葡萄球菌产生的多种酶和毒素会造成角膜基质层坏死、融解、变薄,严重者可发生角膜溃疡穿孔,甚至眼内感染,最终眼球萎缩[3]。细菌性角膜炎常用环丙沙星、氧氟沙星、左氧氟沙星、加替沙星等广谱抗生素进行治疗。然而,随着抗生素的广泛使用,细菌的耐药性问题已成为一个紧迫的全球医疗问题[4]。寻找具有抗菌活性的生物活性物质治疗细菌性角膜炎可能是解决这一问题的新途径。
钝顶螺旋藻是一种生活在海洋和淡水中的颤藻科蓝绿藻[5]。螺旋藻长期以来在许多国家被用作食品和营养补充剂[6],并且已经证明其对人类食用是安全的[7]。近年来,研究人员发现钝顶螺旋藻具有抗炎[8]、抗氧化[9]、抗病毒[10]、辐射防护[11]、肾保护[12]等多种重要的生物活性,这些研究表明,螺旋藻可能为许多疾病提供新的治疗方法。依据钝顶螺旋藻已经报道的抗菌活性,我们推测螺旋藻多糖提取物(Polysaccharide extract from spirulina platensis,PSP)可能对角膜金黄色葡萄球菌感染具有治疗作用。本研究中,我们制备了PSP滴眼液,并观察PSP滴眼液对兔金黄色葡萄球菌角膜炎的治疗作用。
1 材料与方法
1.1 实验动物
45只新西兰大白兔购自中国山东青岛康大兔业发展有限公司,体质量2.0~2.5 kg,所有动物实验均经山东省眼科研究所伦理委员会批准,并依据《视力与眼科研究协会(ARVO)关于在眼科和视力研究中使用动物的声明》进行。
1.2 方法
1.2.1 螺旋藻多糖提取液的制备 根据文献[13],从钝顶螺旋藻中提取PSP。钝顶螺旋藻干粉(青岛海洋大学生命学院)在95%(体积/体积)乙醇中浸泡过夜,在80 ℃的NaOH(pH=10.0)溶液中浸泡4~6 h,然后离心并收集上清液。将溶液调节至pH=7.0,并在4 ℃下采用5%三氯乙酸(青岛云山生物科技有限公司)沉淀过夜。离心后,再用5%三氯乙酸沉淀上清液3 h。离心悬浮液并在4 ℃下用乙醇沉淀上清液过夜(上清液和乙醇体积比为1∶5)以获得PSP。所得PSP沉淀物用丙酮洗涤2次,在冻干机中冻干,溶解于0.9%氯化钠溶液(青岛华仁药业有限公司)中,用0.22 μm微孔滤膜过滤除菌。采用蒽酮-硫酸法测定螺旋藻多糖的含量,用0.9%氯化钠溶液将PSP溶液调节至100 μg/ml。
1.2.2 金黄色葡萄球菌接种液的制备 以金黄色葡萄球菌ATCC25923为试验菌(山东省眼科研究所病原生物学实验室),37 ℃孵育过夜。在37 ℃的摇瓶培养箱中,分离出几个菌落,接种于胰蛋白酶大豆汤中18~22 h。通过分光光度计(德国艾本德)测量OD 600 nm的细菌浓度,并将细菌悬浮液调整至最终浓度2×104菌落形成单位(Colony Forming Units,CFU)/mL。
1.2.3 模型的建立 45只新西兰大白兔,分别腹腔注射氯胺酮10 mg/kg (福建古田药业)和氯丙嗪50 mg/kg(上海禾丰制药)麻醉,0.5%盐酸丙美卡因溶液(美国爱尔凯因)眼部局部麻醉。每只兔右眼建立金黄色葡萄球菌性角膜炎模型。采用基质注射针将制备的金黄色葡萄球菌(ATCC25923)取5 μl注入到角膜基质中,约100个CFU。注射后8 h,将兔随机分成基底对照组、0.9%氯化钠溶液组和PSP组,每组15只。基底对照组作为基底对照,金黄色葡萄球菌注射8 h后,裂隙灯显微镜下照相后处死并钻取角膜。0.9%氯化钠溶液组和PSP组作为实验眼在金黄色葡萄球菌注射8 h后分别给予0.9%氯化钠溶液和PSP点眼治疗,点眼治疗时间为9 h:先是每15 min点眼1次,持续点眼5次后,改为每30 min点眼1次,持续点眼14次;最后一次点眼后1 h,对实验眼进行裂隙灯显微镜检查,并用荧光素钠染色观察角膜上皮缺损。
1.2.4 临床指标评分检查 实验眼于治疗后接受裂隙灯显微镜检查,由同一眼科医师盲评。通过眼分泌物、结膜水肿、前房积脓、角膜基质浸润和角膜基质水肿这5个参数来评估角膜细菌感染的程度。观察者以0~4的严重程度递增量表给出每个参数,5个参数的总分被认为代表角膜感染的严重程度,研究的指标评分总分为20分,得分越高表明严重程度越高,计算各组总分值并进行数据分析。本研究所用裂隙灯显微镜检查评分标准见表1。
1.2.5 角膜金黄色葡萄球菌载菌量 观察结束后立即处死兔子,使用8.5 mm角膜环钻从角膜中央钻取角膜。钻取的角膜使用灭菌缓冲液匀浆,按1∶10梯度稀释到10-5,选取3个合适稀释度的菌液吸出0.1 ml涂布于营养琼脂平板,37°培养24 h,行菌落计数。
1.2.6 组织病理学染色 每组随机抽取3只实验兔,眼球摘除后立即放入4%中性甲醛固定,固定24 h后梯度乙醇脱水,经二甲苯透明,石蜡包埋后行4 μm切片,眼球石蜡切片进行苏木精-伊红染色,显微镜下观察比较各组角膜、房角和虹膜中浸润炎症细胞的数量。
1.2.7 实时定量PCR检测 每组随机抽取3只实验眼,8.5 mm环钻钻取角膜,使用Trizol法提取组织RNA。使用HiScript III RT SuperMix for qPCR试剂盒(南京诺唯赞生物科技有限公司)合成cDNA模板,行实时定量PCR检测,扩增体系为10 μl。扩增程序为95 ℃预变性30 s,循环反应95 ℃变性10 s,60 ℃退火和延伸30 s,共40个循环。所用引物及其序列如下:白细胞介素-6(Interleukin-6,IL-6)的正向链为5'-GAACCTGCAGCAGAAAAACCA-3',反向链为5'-GAGGCAGAGCCCATGAAATTC-3';白细胞介素-1β(Interleukin-1β,IL-1β)的正向链为5'-CCACAGTGGCAATGAAAATGA-3'(Foward),反向链为5'-ACCTGCCGGAAGCTCTTGTT-3';肿瘤坏死因子(Tumor necrosis factor-α,TNF-α)的正向链为:5'-TGCTGCACTTCAGGGTGATC-3',反向链为5'-CTTGCGGGTTTGCTACTACGT-3';GAPDH的正向链为5'-CGCCTGGAGAAAGCTGCTAA-3',反向链为5'-CCCCAGCATCGAAGGTAGAG-3'。
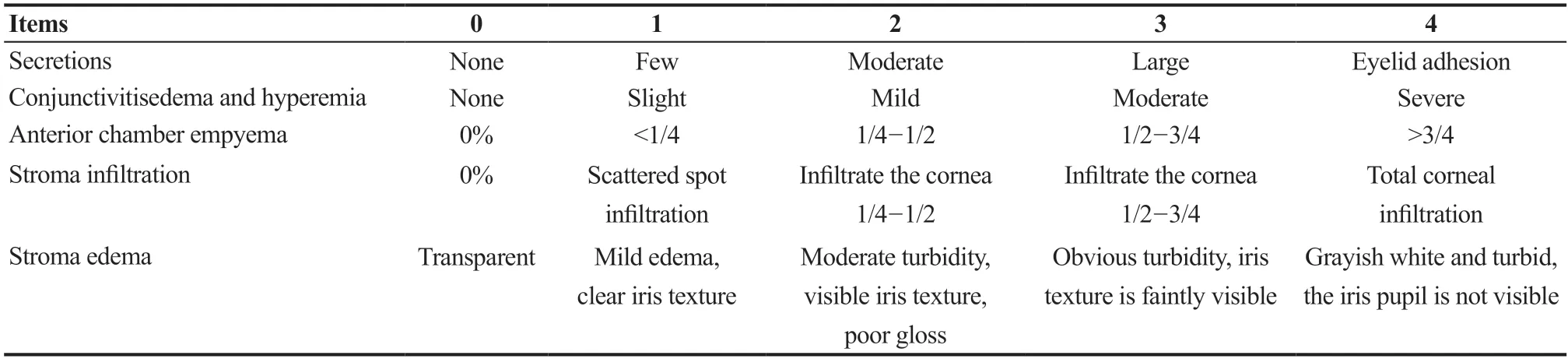
表1.角膜细菌感染裂隙灯显微镜评分标准Table 1.Slit lamp microscope scoring standards of keratitis
1.2.8 台盼蓝染色计数活细胞比率 人角膜上皮细胞(Human corneal epithelial cells,HCEC)由Choun-Ki Joo(韩国天主教大学)馈赠,使用D/F12+10%胎牛血清培养基进行培养。将细胞均匀接种于96孔板,每孔3×103个细胞。对照组和PSP组设置质量百分比浓度梯度分别为0.001%、0.005%、0.01%、0.02%和0.04%,每个浓度3个复孔。细胞贴壁培养24 h后,基底对照组更换正常培养基,PSP组分别加入含不同浓度PSP的培养基,继续培养48 h后,用0.04%台盼蓝对各组消化后的细胞进行染色计数(活细胞比例%=总细胞量100%-着色的死细胞量%)。
1.3 统计学方法
实验研究。使用GraphPad Prism 8.0.2统计软件进行数据分析。符合正态分布的计量资料在组间比较采用独立样本t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 裂隙灯显微镜检查及临床评分
兔角膜基质注射金黄色葡萄球菌8 h后,裂隙灯显微镜检查见结膜囊内少量分泌物,伴结膜轻度充血水肿,角膜中央可见片状浸润灶,未见基质水肿和前房积脓,表现为病情较轻型细菌性角膜炎(见图1)。0.9%氯化钠溶液组和PSP组点眼治疗9 h后,裂隙灯显微镜下观察显示,0.9%氯化钠溶液组兔眼可见大量的分泌物,结膜见中到重度充血水肿,角膜见轻到中度基质浸润,受累范围为角膜的1/4~3/4,基质见水肿混浊,虹膜纹理可见或隐约可见,部分兔眼伴有前房积脓,呈现出病情较重型细菌性角膜炎;而PSP组用药后兔角膜炎症反应均有不同程度的改善,各项指标较0.9%氯化钠溶液组均有不同程度的减轻,治疗效果较为显著,结膜囊分泌物及结膜、角膜、前房的炎症反应等均有明显的减轻(见图1)。根据裂隙灯显微镜的观察结果,对眼分泌物、结膜水肿、前房积脓、角膜基质浸润和角膜基质水肿这5个参数进行评分以评估角膜细菌感染的程度,结果发现PSP组各方面临床评分均优于0.9%氯化钠溶液组。PSP组和0.9%氯化钠溶液组裂隙灯显微镜观察临床评分分别为4.58±1.56和9.50±2.81,差异有统计学意义(t=5.293,P<0.001)。
2.2 角膜上皮缺损情况
通过荧光素钠染色对角膜金黄色葡萄球菌感染后的兔实验眼进行了角膜上皮缺损的检查,结果发现基底对照组角膜上皮可见轻微缺损,而0.9%氯化钠溶液组角膜上皮缺损严重,PSP治疗后角膜缺损面积较0.9%氯化钠溶液组明显减少(见图2)。角膜上皮缺损面积分析显示,0.9%氯化钠溶液组角膜上皮缺损比例达(24.62±2.67)%,而PSP组上皮缺损比例仅为(8.07±3.62)%,由此可见,PSP治疗后较0.9%氯化钠溶液更能抑制金黄色葡萄球菌感染后兔角膜上皮的缺损(见图3)。
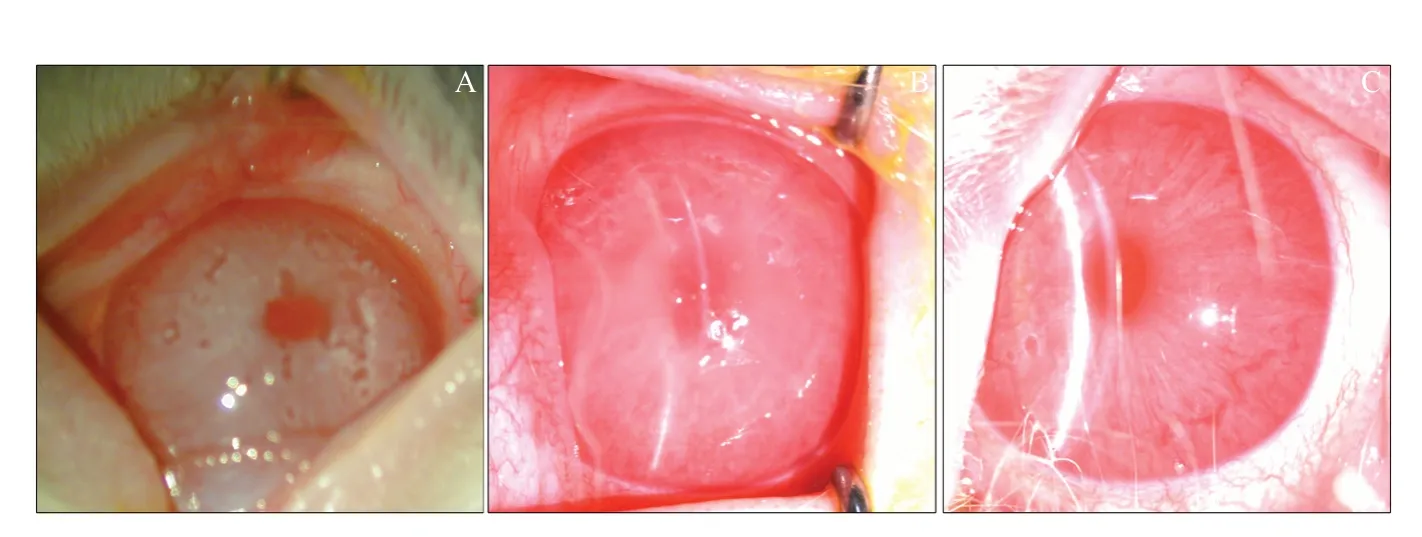
图1.裂隙灯显微镜下各组兔眼前节外观图A:基底对照组,兔角膜基质注射金黄色葡萄球菌8 h后,表现为病情较轻型细菌性角膜炎;B:0.9%氯化钠溶液组,点眼治疗9 h后,呈现出病情较重型细菌性角膜炎;C:螺旋藻多糖提取物组,点眼治疗9 h后,症状类似基底对照组,表现为较轻型细菌性角膜炎Figure 1.The appearance of the anterior segment of the rabbit eye in each group was observed by slit lamp inspection.A:Basal control group:Eight hours after injection with Staphylococcus aureus in the rabbit corneal stroma,the cornea shows mild bacterial keratitis.B:0.9%sodium chloride solution group:Nine hours after topical treatment,the corneas show more severe bacterial keratitis.C:Polysaccharide extract from spirulina platensis group:Nine hours after topical treatment,the symptoms are similar to the basal control group,showing milder bacterial keratitis.
图2.裂隙灯显微镜下点眼给药治疗后兔眼荧光素钠染色角膜上皮缺损情况A:基底对照组(兔角膜基质注射金黄色葡萄球菌后8 h),上皮可见轻微缺损;B:0.9%氯化钠溶液组(点眼治疗9 h后),角膜上皮缺损严重,缺损范围约为角膜1/4;C:螺旋藻多糖提取物组(点眼治疗9 h后),角膜缺损面积明显较0.9%氯化钠溶液组少Figure 2.Slit lamp observation of rabbit corneal epithelial defect stained with sodium fluorescein after intraocular administration.A:In the basal control group (8 h after injection with staphylococcus),slight epithelial defects can be seen.B:In the 0.9% sodium chloride solution group(9 h after topical treatment),the corneal epithelial defect is severe,and the defect area is about 1/4 of the cornea.C:In the Polysaccharide extract from spirulina platensis group (9 h after topical treatment),the area of the corneal defect is significantly reduced when compared with 0.9% sodium chloride solution group.
2.3 兔角膜金黄色葡萄球菌细菌载量检测
金黄色葡萄球菌细菌载量检测显示,0.9%氯化钠溶液组与基底对照组相比差异无统计学意义(t=1.303,P=0.2170),而PSP组角膜细菌载量明显低于0.9%氯化钠溶液组(t=4.383,P<0.001)和基底对照组(t=3.508,P=0.004),差异均有统计学意义(见图4)。
2.4 组织病理学比较
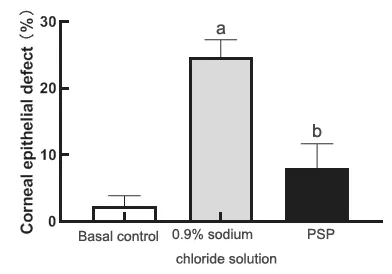
图3.螺旋藻多糖提取物点眼给药治疗后兔角膜上皮缺损面积柱状图(每组15眼)与基底对照组(兔角膜基质注射金黄色葡萄球菌后8 h)比较,a P<0.05;与0.9%氯化钠溶液组比较,b P<0.05Figure 3.Analysis of the rabbit corneal epithelial defect area after topical application of PSP (15 eyes in each group).After PSP treatment,compared with the 0.9% sodium chloride solution group,it can significantly inhibit the rabbit corneal epithelial defect after Staphylococcus aureus infection.PSP,polysaccharide extract from spirulina platensis.Compared with the basal control group (8 h after injection with Staphylococcus),a P<0.05; compared with 0.9% sodium chloride solution group,b P<0.05.
兔眼球组织病理学切片HE染色显示,基底对照组可见局部角膜表层上皮缺损,角膜基质内偶见单个炎细胞浸润,基质纤维排列整齐,房角和虹膜微血管轻度充血,前房角无明显炎性细胞浸润;0.9%氯化钠溶液组角膜上皮层丢失,角膜基质水肿变性,大量炎性细胞浸润,前房角内可见大量炎性渗出及炎症细胞;虹膜血管扩张,表面可见炎性渗出膜;PSP组角膜上皮细胞局部缺损,角膜基质轻度水肿伴少量炎性细胞浸润,房角未见明显炎性渗出,可见少量炎性细胞浸润,虹膜血管轻度扩张伴少量炎性细胞浸润,见图5。
2.5 PSP抑制炎症因子表达的情况
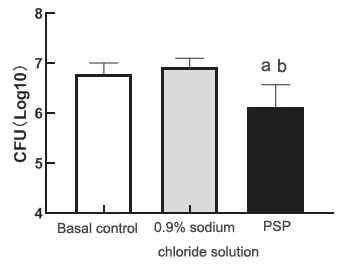
图4.治疗后兔角膜细菌载量分析(每组15眼)与基底对照组(兔角膜基质注射金黄色葡萄球菌后8 h)比较,a P<0.05;与0.9%氯化钠溶液比较,b P<0.05。PSP,螺旋藻多糖提取物Figure 4.Analysis of rabbit corneal bacterial load after treatment(15 eyes in each group).PSP,polysaccharide extract from spirulina platensis.Compared with the basal control group (8 h after injection with Staphylococcus),a P<0.05;compared with 0.9% sodium chloride solution group,b P<0.05.
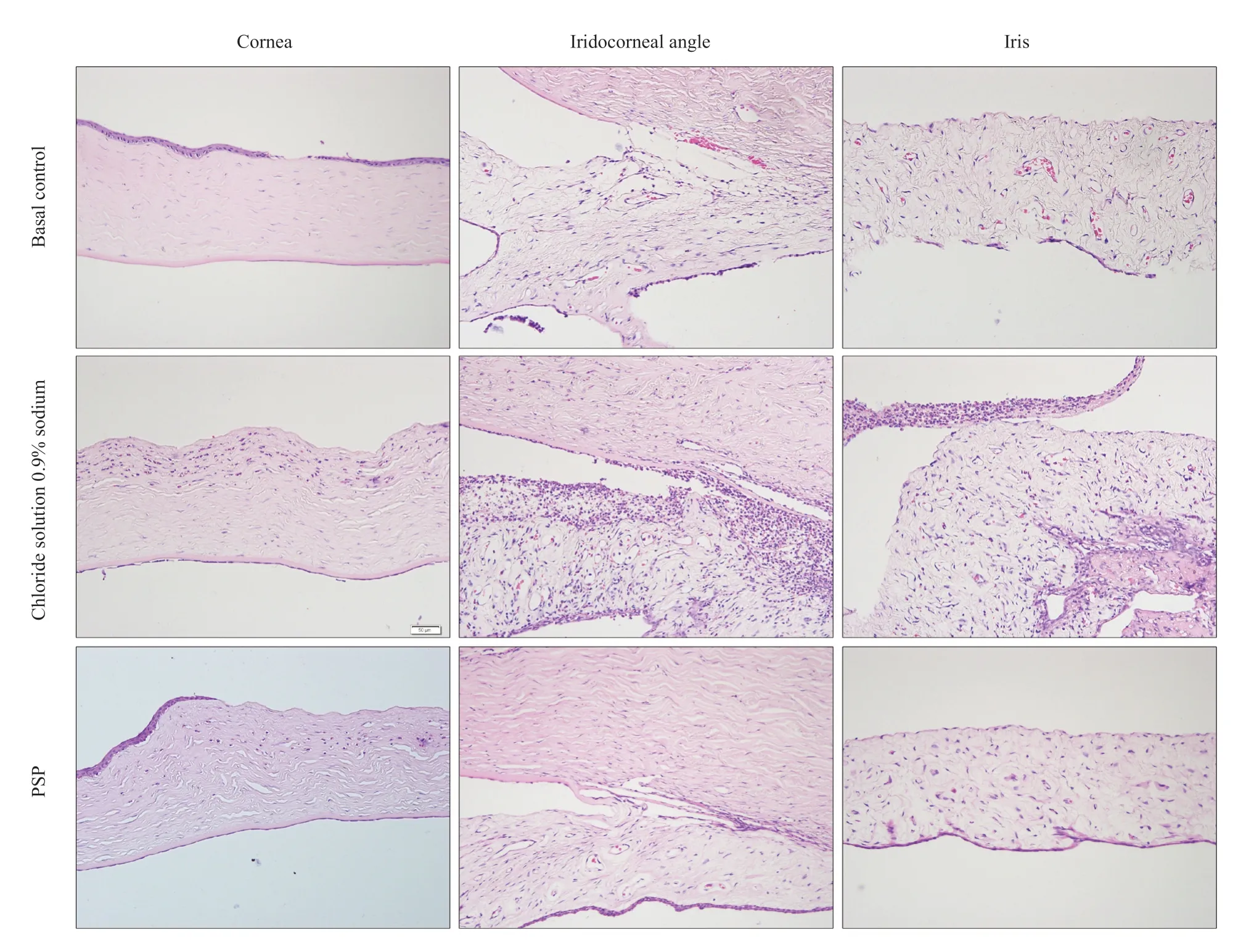
图5.螺旋藻多糖提取物点眼给药治疗后兔眼前节组织病理学变化比较螺旋藻多糖提取物组与0.9%氯化钠溶液组比较,角膜上皮缺损及组织内炎症细胞浸润程度均明显减轻Figure 5.Comparison of histopathological changes in the anterior segment of rabbit eyes after PSP treatment.Compared with the 0.9% sodium chloride solution group,corneal epithelial defects and infiltration of inflammatory cell tissue in the PSP group are obviously reduced.PSP,polysaccharide extract from spirulina platensis.
为进一步评价PSP对金黄色葡萄球菌感染后角膜炎症的作用,本研究通过实时定量PCR检测了各组常见炎症因子IL-6、IL-1β、TNF-α mRNA水平的表达情况,结果显示PSP组角膜中炎症因子IL-6、IL-1β、TNF-α的表达均明显低于0.9%氯化钠溶液组,差异有统计学意义(IL-6:t=7.082,P=0.002;IL-1β:t=19.74,P<0.001;TNF-α:t=8.092,P=0.001),见图6。
2.6 PSP对人角膜上皮细胞存活率的影响
为评估PSP的安全性,本研究比较了不同浓度的PSP对体外培养的人角膜上皮细胞存活率的影响。人角膜上皮细胞在各浓度PSP中培养48 h后,台盼蓝染色计数结果显示,活细胞均没有明显减少,活细胞比例较对照组未见明显差异,见图7。
3 讨论
螺旋藻是一种光自养的原核生物,富含多种生物活性物质,营养价值高,广泛应用于食品、药品、保健品中,受到社会各界的研究和关注。存在于生物中的多糖是生命有机体的重要组成部分,与维持生命的多种生理功能相关,现已发现植物多糖具有多种生物活性,近年来,多糖良好的抗菌活性也受到关注。螺旋藻多糖是从螺旋藻提取的生理活性多糖,无毒,具有广泛而复杂的生物活性,近年来受到各国学者的关注。越来越多的研究结果表明,螺旋藻多糖具有丰富的生理功能,包括抗衰老、抗氧化、抗病毒和抗炎活性等[8-10]。El-Sheekh等[14]研究证明钝顶螺旋藻的提取物对广谱细菌和真菌有效。Kaushik和Chauhan[15]发现钝顶螺旋藻对包括金黄色葡萄球菌在内的革兰氏阳性菌具有体外抗菌活性。Yang等[13]报道了PSP的局部应用具有抗血管生成和抗炎作用,可用于角膜新生血管的治疗,说明PSP在眼科疾病中具有潜在的临床应用价值。另有研究报道一些多糖具有潜在的抗菌活性[16]。但是,螺旋藻多糖对金黄色葡萄球菌引起的细菌性角膜炎的治疗作用鲜见相关的研究报道。本研究在PSP安全性细胞实验中设计了5个浓度,经过48 h细胞培养,证明了PSP对角膜上皮细胞的存活没有明显的影响。选用中间浓度0.01%进行体内实验,首次发现螺旋藻多糖对金黄色葡萄球菌有良好的抗菌能力,在体实验证明PSP能明显减轻兔金黄色葡萄球菌性角膜炎严重程度,有良好的应用前景。
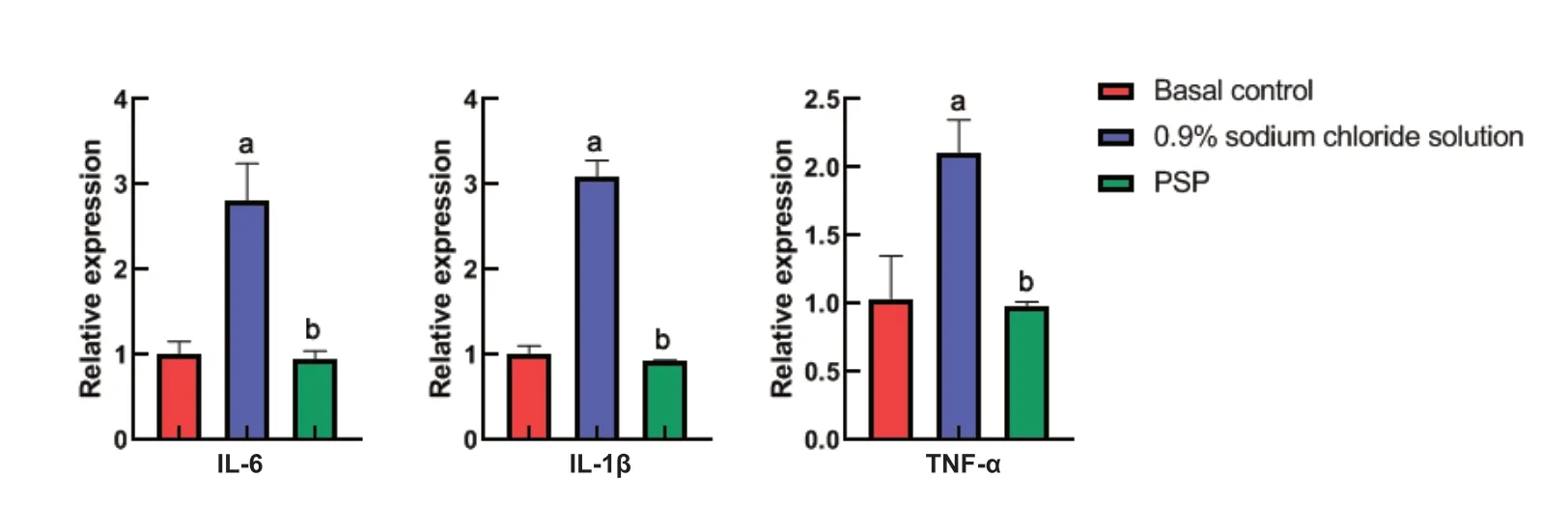
图6.螺旋藻多糖提取物点眼给药对角膜中炎症因子IL-6、IL-1β、TNF-α表达的影响(每组15眼)与基底对照组(兔角膜基质注射金黄色葡萄球菌后8 h)比较,a P<0.05;与0.9%的氯化钠溶液比较,b P<0.05Figure 6.The effects of PSP treatment on the expression of inflammatory factors IL-6,IL-1β,and TNF-α in the cornea (15 eyes in each group).Compared with the basal control group (8 h after injection with Staphylococcus),a P<0.05; compared with 0.9% sodium chloride solution group,b P<0.05.PSP,polysaccharide extract from spirulina platensis.
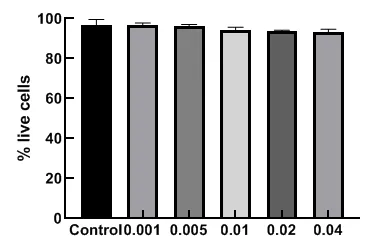
图7.螺旋藻多糖提取物处理对角膜上皮细胞存活率的影响(每组15眼)各浓度PSP处理均不会引起角膜上皮细胞存活率下降Figure 7.The effect of PSP treatment on the ratio of viable corneal epithelial cells (15 eyes in each group).PSP treatments at various concentrations did not reduce the corneal epithelial cell viability.PSP,polysaccharide extract from spirulina platensis.
细菌性角膜炎是常见的眼部感染疾病,金黄色葡萄球菌是引起细菌性角膜溃疡的常见病原菌。金黄色葡萄球菌是正常人结膜囊细菌培养的常见菌株,仅次于凝固酶阴性葡萄球菌[17,18]。金黄色葡萄球菌作为一种条件致病菌,可长期寄居在宿主表面,通常不会引起感染性疾病。本研究选用的是金黄色葡萄球菌ATCC25923,该菌通常是世界上许多国家细菌性角膜炎首位或第2位的致病菌。研究表明,来自患者结膜囊的细菌是引起结膜炎、角膜炎等常见眼部感染性疾病以及术后眼内炎的主要病因[19,20],治疗不当可导致永久性视力下降,甚至失明。目前针对细菌性角膜炎最有效的治疗途径是局部应用抗生素。但是抗生素容易诱导机体产生耐药性,因此寻找安全有效的有抗菌活性的生物活性物质对预防和治疗细菌性角膜炎非常重要,近年来受到各国学者的重视,但尚未有相关应用报道。
本研究通过观察局部应用PSP对实验性兔金黄色葡萄球菌性角膜炎的治疗效果,首次在动物水平证实PSP治疗能够有效减轻金黄色葡萄球菌性角膜炎的临床情况,表现为控制角膜上皮缺损,并降低分泌物、结膜水肿充血、前房积脓、基质浸润、基质水肿等指标的临床评分。为更好地了解PSP治疗金黄色葡萄球菌性角膜炎的作用途径及机制,我们进一步研究了它的抗菌和抗炎效果。通过菌落形成实验,我们发现PSP能明显降低感染金黄色葡萄球菌性角膜的菌落CFU,证明了PSP具有一定的抑制金黄色葡萄球菌的作用。类似于本研究,其他研究也在其他菌种中报道了螺旋藻多糖潜在的抗菌活性。Rajasekar等[21]研究发现从螺旋藻中分离的硫酸化多糖在圆盘扩散、琼脂生物测定和蛋白质泄漏测定中显示出对病原菌弧菌具有抗菌作用,并在100 μg/ml浓度时表现出最高的抗菌能力。这与本研究所使用的PSP浓度是一致的,也间接验证了本研究的可靠性。本课题组之前的研究在角膜新生血管模型中验证了PSP的抗炎作用[15]。Morsy等[22]研究也发现螺旋藻提取物对大鼠右旋糖酐硫酸盐钠诱导的溃疡性结肠炎具有保护作用,能有效防止炎症因子TNF-α、IL-6以及髓过氧化物酶的增高。通过组织病理学染色检测,我们发现PSP点眼治疗可以明显减少金黄色葡萄球菌引起的角膜、房角及虹膜组织中的炎症细胞浸润;实时定量PCR结果显示,PSP能显著降低金黄色葡萄球菌引起的角膜组织中炎症因子IL-6、IL-1β、TNF-α的表达,提示PSP具有对抗金黄色葡萄球菌引起的角膜炎症的作用。
综上所述,本研究报道了PSP对实验性兔金黄色葡萄球菌性角膜炎的治疗作用,这可能是通过PSP的抑菌和抗炎特性发挥作用的。本研究发现为应用PSP治疗金黄色葡萄球菌性角膜炎的可行性提供了一定实验依据,也为应用多糖类生物制剂治疗细菌性角膜炎提供了新思路。
利益冲突申明本研究无任何利益冲突
作者贡献声明王瑶:收集数据;参与选题、设计及资料的分析和解释;撰写论文;根据编辑部的修改意见进行修改。刘廷、于洋、王欣、宋方英:参与选题、设计和修改论文的结果、结论。杨玲玲:参与选题、设计、资料的分析和解释;修改论文中关键性结果、结论;根据编辑部的修改意见进行核修

