纹状体及其环路参与孤独症重复刻板行为机制研究进展
樊亚蕾 李恩耀 赵鹏举 郝汇睿 徐成铭 张 哲 董献文
郑州大学第五附属医院 河南省康复医学重点实验室,河南 郑州 450052
孤独症谱系障碍(autism spectrum disorder,ASD)是一种神经发育障碍性疾病,2013-05发布的《精神障碍诊断与统计手册(第5 版)》(diagnostic and statistical manual of mentaldisorders,5th Edition,DSM-V)重新定义其两大核心症状:社交障碍及重复刻板行为[1]。随着诊断手段的提高,ASD的患病率逐年上升,据美国数据显示,8 岁以下儿童患病率从1/54到1/44 只用了两年时间,男孩患病率是女孩的4.2 倍[2-3],目前我国6~12 岁儿童的ASD 患病率为0.7%[4]。ASD可能是一种多因素疾病,遗传、环境和发育(宫内和幼儿时期)等因素都可能影响ASD 的发生发展,并可能具有神经方面的缺陷,如神经连接性的改变、兴奋/抑制比失衡、突触功能变化等[5-6]。某些行为和认知缺陷大多可以在18~24 个月大的儿童中被识别出来,有助于预测ASD的后期诊断,而可靠的诊断最常发生在3岁时[7]。
重复刻板行为(restricted repetitive behaviors,RRBs)包括刻板的动作或言语、对相同性的坚持、极其狭隘的兴趣和(或)非典型的感官反应[1],可将RRBs归为两类:重复性的感觉运动行为和坚持同一性行为[7],根据《重复行为量表-修订版(Repetitive Behavior Scale-Revised,RBS-R》可分为低阶行为(刻板、自伤和受限行为)和高阶行为(强迫、仪式和坚持相同行为)[8]。重复刻板行为影响认知、沟通、社交等发展,整体发展水平均落后于正常儿童,常与共病相关,如多动、焦虑、智力障碍等[9-11],但相关机制尚未明确。近年来,较多文献显示纹状体可能是参与孤独症RRBs 形成的重要脑区,纹状体作为基底节的一部分,接受来自皮层下的主要输入,控制运动、认知、学习记忆等,纹状体功能等的改变可能是ASD重复刻板行为形成的一个重要原因[12-14]。有研究认为,基底节通路的活动增强会导致RRBs的增加,纹状体中突触相关蛋白90/突触后密度蛋白95(SAP90/PSD95)的表达异常与小鼠的RRBs 有关[15],背侧纹状体中过量的D1 多巴胺受体激活可能导致RRBs[15]。研究中多采用成熟的ASD动物模型,通过影像学、免疫组化、光遗传学等方法揭示纹状体功能等与RRBs的关系,涉及纹状体功能解剖学及多个相关神经环路。因此,本文对近年来纹状体及相关环路参与ASD 重复刻板行为机制研究进行综述,以期为ASD 相关研究提供参考。
1 重复刻板行为的相关研究
1.1 重复刻板行为定义与病因 RRBs 是指无明显目的的、不变的、以高频率反复、重复而无任何功能效果的简单行为,是ASD 患者最具特征性的行为,可阻碍适应性行为和技能的正常发展,若强行阻止可能会激发患儿的抵抗行为[17]。ASD 中RRBs 形成病因复杂,在神经生物学方面,皮层-纹状体-丘脑-皮层环路被认为是ASD 中RRBs 发生发展的病理生理学基础,黑质纹状体环路、多巴胺能信号调节、基底节的功能缺陷等可能与RRBs 的形成相关[8,18]。基因与染色体变异亦可能参与RRBs发病机制[19]。RRBs 作为ASD 的核心症状之一,执行功能损伤可能会导致ASD 个体无法抑制异常行为、无法执行目标行为,行动缺乏灵活性和持久性,从而形成RRBs[19-20]。在行为模式方面,认为某种行为可能引发了ASD患者愉悦或享受的状态,导致行为的不断强化形成RRBs;也有研究认为RRBs 引起感官上的刺激,使其喜欢并享受这种刺激导致RRBs,即感觉性强化[14]。在环境方面,环境富集可使RRBs 有所减弱[21];动物研究认为孕哺期暴露于某些环境因素下可致仔鼠内侧前额叶皮质内质网应激,导致树突棘减少或其不可逆的损伤、突触形态受损、突触相关蛋白减少等,最终导致子代RRBs[22]。综上,重要脑区功能障碍、执行功能缺陷、环境、遗传等因素都可能导致ASD中RRBs的发生。
1.2 重复刻板行为表现与评估 ASD 患者RRBs发展轨迹复杂,临床表现不尽相同,并非所有诊断为ASD 的患者都有明确的RRBs 证据,临床表现的强度和严重程度也可能有很大差异[23-24]。同一个ASD患者的某个固定兴趣和刻板行为可能维持相当长的一段时间,也可能根据年龄的变化而变化,男性通常比女性受到更严重的影响[25]。根据《精神障碍诊断与统计手册(第5版)》将其分为以下4种类型:(1)刻板或重复的躯体运动、使用物体或言语;(2)坚持相同性:对常规的坚持,或仪式化的语言或非语言行为模式;(3)高度受限的、固定的兴趣;(4)对感觉输入的过度反应或反应不足,或对环境的感受方面有不同寻常的兴趣[1]。RRBs也并非ASD患者特有表现,抽动秽语综合征、智力落后、精神分裂症、强迫症、帕金森等精神和神经类疾病亦存在[26-27],这些疾病相似的行为特征对ASD 的诊断和干预措施可能存在潜在混淆,可以从这些疾病的其他相关特点入手诊断,如强迫症患者并没有明显的语言和认知障碍,强迫和反强迫的强烈冲突使患者感到焦虑和恐惧[7]。但对于这些疾病而言,ASD的RRBs更明显,更具有特点,持续时间更长,亦是其核心症状之一[14,17,28]。在典型发育过程中,重复行为如手部的习惯性/重复性动作等,是为了自身技能更好发展,但有研究者用RRBs 来说明各种重复行为,概念的运用存在潜在的混淆。重复行为随时间减少明显,而RRBs 不会随时间减少[17,24]。两者应明确辨析,减少误区的存在,更有利于ASD的普及与诊断。
临床上针对RRBs 提出了不同的评估量表,如《广泛性发育障碍儿童耶鲁-布朗强迫症量 表(The Children’s Yale-Brown Obsessive Compulsive Scales for Autism Spectrum Disorder,CYBOCS-PDD)》、《重复行为问卷(Repetitive Behavior Questionnaire,RBQ)》、《重复行为量表-修订版(Repetitive Behavior Scale-Revised,RBS-R)》、《沉默行为量表(Stereotyped Behavior Scale,SBS)》等。对于ASD患者,自闭症诊断访谈量表修订版(ADI-R)和自闭症诊断观察量表(ADOS)中也有指标涉及RRBs[29-30]。在ASD诊断工作中,对ASD核心症状RRBs的量化界定是十分重要的,由于各种诊断量表临床应用不足,亦带有评估者的主观性,ASD 新的诊断标准发布等原因,可能还需要开发更为准确的量表评估。动物研究中,行为学评估RRBs 方法有跳跃、旋转、埋珠、自梳理、无目的咀嚼物体,还可用Y-Maze、T-Maze等逆向学习评估灵活性进而揭示RRBs[22,31-33]。
目前ASD 患病率逐年增加,尽管最近对ASD 的RRBs 方面取得了进展,但涉及RRBs的潜在病理生理学机制仍未明确。近年影像学发现ASD 的纹状体结构异常可能与RRBs有关,纹状体由尾状核和豆状核(壳核和苍白球)组成,尤其是尾状核体积及增长速度异常可能与RRBs有关[34-35]。研究发现纹状体参与运动控制、行为决策、学习、认知、记忆、编码奖励信息等,较多文献发现纹状体及其环路异常在ASD的RRBs形成过程中的关键作用,但具体机制仍待明确[11,36-39]。
2 纹状体参与ASD重复刻板行为可能的机制
纹状体是哺乳动物前脑的主要皮层下成分,位于白质深部,是锥体外系的一部分,其接受来自皮层下的主要输入。纹状体相关环路已被证明控制多种神经功能,主要有运动控制、认知和动机等[40-41]。纹状体有不同的分类方法:在解剖关系上,由尾状核和豆状核(壳核和苍白球)组成,豆状核的头端和尾状核头部相连,相连处形成灰白相间的条纹。按照神经化学成分可归为纹状小体和基质两个区室,分别接受来自相关的边缘系统和感觉运动皮质的输入[42]。依据细胞结构相似但功能不同可分为背侧纹状体和腹侧纹状体,背侧区由尾状核和壳核组成,控制运动和认知功能;腹侧区由伏隔核和嗅结节组成,调节动机、奖励和情绪[43]。纹状体神经元主要分为多棘投射神经元(spiny projection neurons,SPN)和无棘中间神经元(aspiny interneurons,aSPN),SPN 约占纹状体神经元总数的95%,其中60%的SPN参与直接通路(direct pathway spiny projection neurons,dSPN),35%的SPN 参与间接通路(indirect pathway spiny projection neurons,iSPN),直接与间接通路相关结构见图1[44]。根据皮层与纹状体的传入和传出投射关系,将纹状体细分为3 个区域:纹状体背外侧部、纹状体背内侧部和纹状体腹侧部[45]。随着研究的不断深入,研究者发现纹状体的体积、组织结构的改变,以及纹状体相关环路缺陷可能导致RRBs,下文重点阐述纹状体及其环路导致RRBs的相关机制。
2.1 孤独症纹状体体积变化 研究者利用磁共振成像(MRI)发现随着年龄的不断增长,正常儿童的尾状核体积在慢慢减小,而ASD 尾状核体积慢慢增加且主要集中在尾状核头部,与重复刻板行为的严重程度呈正相关[35,46],纹状体的增长速度与RRBs 的严重程度呈正相关[13]。3~4岁ASD儿童与正常儿童对比发现,ASD儿童左右壳核和左侧尾状核体积增大[23]。WOLFF等[47]研究认为,RRBs中的强迫性和仪式性行为与双侧尾状核体积呈显著正相关。LANGEN等[13]采用纵向研究,每人被MRI扫描2 次(平均年龄9.9 岁和12.3 岁),ASD 患者的纹状体特别是尾状核的生长速率增加了1倍。D3 多巴胺受体(DRD3)基因在纹状体中过表达与纹状体体积增加和RRBs 严重程度相关[48-49]。大量研究表明纹状体体积增加与RRBs 的严重程度呈正相关,但目前研究结果不一,猜测可能是纹状体环路和结构的作用在生长发育过程中是动态变化的,也可能是评估的年龄或方法不同出现结果不一[8,23]。
2.2 纹状小体与基质 化学神经解剖学将纹状体分为纹状小体和基质两类边界清楚的间区,纹状小体和基质间功能不平衡是RRBs 的潜在相关因素,研究认为纹状小体和基质中多巴胺调节模式异常是促进RRBs 的一个重要因素[41,50]。KUO 等[51]发现ASD 模型鼠中纹状小体和基质成分之间不平衡的神经元活动导致皮质-纹状小体-黑质回路功能失调。纹状小体和基质活动的相对失衡可能产生僵化行为或刻板行为[50]。在RRBs 形成过程中,纹状小体相对于周围基质的优先激活在不同发育年龄之间无差异[52]。对12.75 d孕鼠注射丙戊酸钠(valproic acid,VPA)后,仔鼠纹状小体的钙结合蛋白表达增加(正常的纹状小体本不应该富集钙结合蛋白),认为其表达增加可能是从基质转移到纹状小体区域[42]。研究表明ephrin-Eph 信号介导的排斥作用调节纹状小体与基质的分离[53],VPA处理后可能会干扰仔鼠ephrin-Eph介导的排斥反应,使纹状小体和基质分离混乱导致ASD,但研究中并没有评估仔鼠的RRBs。纹状小体和基质的神经激活状态和分离状态可能在ASD 的RRBs 形成机制中发挥重要作用。
2.3 纹状体相关环路 基底节是位于大脑深部的灰质核团,主要包括纹状体、屏状核和杏仁核。广义的基底节还包括红核、黑质和丘脑底核,在人体随意运动控制及精细运动调控中发挥重要作用。纹状体是基底节接受大脑皮质信息输入的主要核团,通过不同的通路控制机体活动(图1):(1)直接通路(促进运动);(2)间接通路(抑制运动);(3)超直接通路(抑制无效的随意运动)。在动作执行过程中,直接通路和间接通路被同时激活,协调配合进行运动控制[44,54-55]。间接通路激活减少和RRBs增加有关[52,56],直接通路的激活足以产生运动刻板[57]。dSPN 活性的增加或iSPN 活性的降低,都可能导致RRBs 的增加[58]。ASD 模型鼠中丘脑底核的神经元激活显著降低,与RRBs 的频率呈负相关;丰富环境下饲养的小鼠间接通路激活增加致RRBs减少[56,59]。直接通路与间接通路激活状态均与RRBs表达相关。
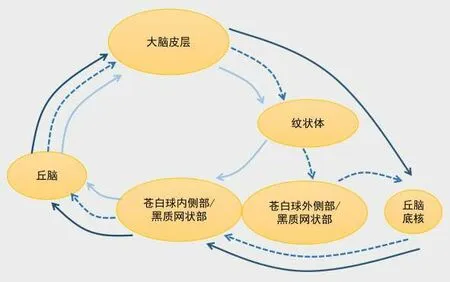
图1 基底节参与运动控制的神经通路直接通路;间接通路;超直接通路Figure 1 The neural pathways of the basal ganglia involved in motor control
研究认为,支持灵活行为的纹状体环路改变可能是RRBs障碍的基础,认为ASD组在逆向学习选择不确定时,即当环境暗示需要改变某些行为时,前额叶皮层和腹侧纹状体激活减少,从而阻碍对未来行为的灵活选择和规划,引起行为僵硬[60]。腹侧苍白球中的两类神经元,γ-氨基丁酸能神经元和谷氨酸能神经元分别编码接近和回避的驱动,其活动之间的平衡决定了动机行为的类型,抑制或刺激腹侧苍白球两类神经元信号之间的平衡,在控制动物的行为动机方面是非常重要的,ASD的核心症状之一RRBs 是否也会受到类似的干扰有待研究[61]。Shank3 突变小鼠重复的自梳理行为与皮质-纹状体通路的中等多棘神经元突触传递减少有关[36]。VPA 诱导的ASD 模型鼠中,皮质-纹状体通路尤其是头部囊泡谷氨酸转运蛋白1-谷氨酸受体1(VGluT1-GluR1)突触密度降低[42]。Neuroligin-3(NLG3)是一种突触后黏附分子,可以调控突触的发育及功能,NLG3突变导致RRBs增加是通过伏隔核/腹侧纹状体的选择性突触损伤引起[62]。以上研究可能为纹状体相关环路参与RRBs 形成机制提供了合理的解释。
2.4 多巴胺系统 利培酮是多巴胺D2 受体拮抗剂,治疗ASD 鼠可改善纹状体细胞聚集模式,研究认为纹状体细胞的神经元迁移可能受到多巴胺相关信号的调节[42,63]。基底节是运动刻板表达的核心,运动刻板可通过多巴胺能刺激纹状体来诱导,也可阻断纹状体内多巴胺能来消除,多巴胺D1/D2 类受体激动剂(如阿扑吗啡)增强纹状小体的基因表达超过基质的激活量从而产生了强烈的运动刻板,而多巴胺D2类受体拮抗剂可阻断阿扑吗啡诱导的运动刻板[50]。NLG3突变通过特异性抑制纹状体D1多巴胺受体表达的中等多棘神经元的突触致RRBs 增加[62]。卡耶哈岛(Calleja 岛)是腹侧纹状体嗅结节中密集排列的颗粒细胞簇,以表达D3多巴胺受体为特征,嗅结节D3神经元的光遗传激活可以在小鼠体内稳定地启动自我梳理,同时可抑制其他正在进行的行为[64]。黑质-纹状体通路(nigrostriatal,NS)是从黑质神经元投射到背侧纹状体,在控制目标导向运动行为中起核心作用,可能通过陷入无目的、刻板的行为循环模式而导致ASD 样行为,多巴胺活动的失衡及NS通路功能障碍被认为是异常循环行为的原因之一,已被证明参与介导RRBs[11,65-66]。利用光遗传技术使黑质网状部表达多巴胺D1受体的中等多棘神经元末端兴奋,导致持续的RRBs[57]。16p11.2缺失综合征小鼠RRBs增加,发现纹状体中多巴胺D2受体表达神经元的数量增加,多巴胺D1 受体的皮质神经元数量减少,以及突触功能缺陷[67]。所有这些证据表明,纹状体导致RRBs 的机制中确实存在多巴胺相关功能缺陷。
3 结论与展望
本文重点综述了近年来纹状体参与RRBs的机制研究进展,纹状体结构及其环路异常在RRBs发病机制中至关重要。纹状体体积增加与RRBs 的严重程度成正相关;纹状小体和基质神经元活动的不平衡,以及在生长发育过程中分子介导的排斥反应导致纹状小体和基质分离紊乱等原因可能引起RRBs;间接通路激活减少和直接通路激活增加可能与RRBs 增加有关;皮质-纹状体、黑质-纹状体等纹状体相关通路的功能缺陷可能导致RRBs;多巴胺系统的调节作用及功能障碍可能导致RRBs。较多证据显示纹状体及其相关环路与RRBs相关,但这些神经环路和其所支持的RRBs 具体功能在很大程度上仍未知,还需要开展更深层次的研究,从而为孤独症纹状体参与RRBs形成更系统的机制理论。

