儿童Xp11.2易位/TFE3基因融合相关性肾癌2例报告并文献复习
陈海涛,马 慧,李 爽
(华中科技大学同济医学院附属武汉儿童医院泌尿外科,湖北武汉 430016)
Xp11.2易位/TFE3基因融合相关性肾癌(renal cell carcinoma associated with Xp11.2 translocation/TFE3 gene fusion,Xp11.2 tRCC)是一种临床上少见的肾癌,2004年世界卫生组织(World Health Organization,WHO)泌尿及男性生殖系统肿瘤分类中将TFE3 RCC正式列为一个独立的肾癌亚型,2016年被纳入家族MiT易位性肾细胞癌[1]。该病好发于儿童及青少年,约占儿童及青少年肾癌的1/3[2]。既往关于儿童Xp11.2 tRCC运用腹腔镜技术诊治的文献报道不多,本文回顾性分析华中科技大学同济医学院附属武汉儿童医院收治的2例儿童Xp11.2 tRCC病例资料,结合相关文献复习,希望提高儿童Xp11.2 tRCC的诊治水平。
1 病例资料
病例1,男性,9岁,因“左腰部疼痛伴血尿1 d”入院。入院查体:腹部未及明显包块,查尿常规示:红细胞10 248个/μL,白细胞(+++),尿蛋白(+++)。查肿瘤全套示甲胎蛋白(alpha-fetoprotein,AFP)、癌胚抗原(carcino-embryonic antigen,CEA)、CA-125、CA19-9均正常,行超声检查示:左肾实质内混合性回声团。行腹部计算机断层扫描(computed tomography,CT)平扫+增强示(图1A、B):左肾上极前缘见类圆形稍低密度影,强化较肾皮质差,肿块未见明显包膜,内部未见明显脂肪影,CT值约28~56 Hu,强化不均,边界不清,向内侵及肾盏,肿块约35 mm×27 mm,余无明显异常;影像学诊断:左肾上极前缘向外膨隆包块,考虑为肾癌。术前诊断:左肾占位性病变,肾癌(T1aN0M0,R.E.N.A.L.评分8X)。在完善术前检查后,于气管插管全身麻醉下行后腹腔镜根治性左肾切除术,手术顺利。术后病理诊断(图1C、D):(左)肾Xp11.2转位/TFE3融合性肾细胞癌;距肾门0.5 cm靠近肾上极见一4.0 cm×3.0 cm×2.5 cm的肿物,输尿管残端及肾周脂肪组织内均未见肿瘤成份;免疫组化结果:TFE3(+)、CD10(+)、CK(PAN)(局灶弱+)、Vimentin(+)、EMA(-)、CD34(-)、CK7(-)、S-100(-)、WT-1(-)、Bcl-2(-)、CD99(-)、Desmin(-)、CD56(-)、CgA(-)、INI-1(+)、HMB-45(-)、Ki-67(约5%+)。术后随访见患儿恢复可,行胸腹盆腔部CT平扫+增强、全身骨扫描、头颅MRI检查、四肢X线片等检查均未见明显肿瘤转移征象。
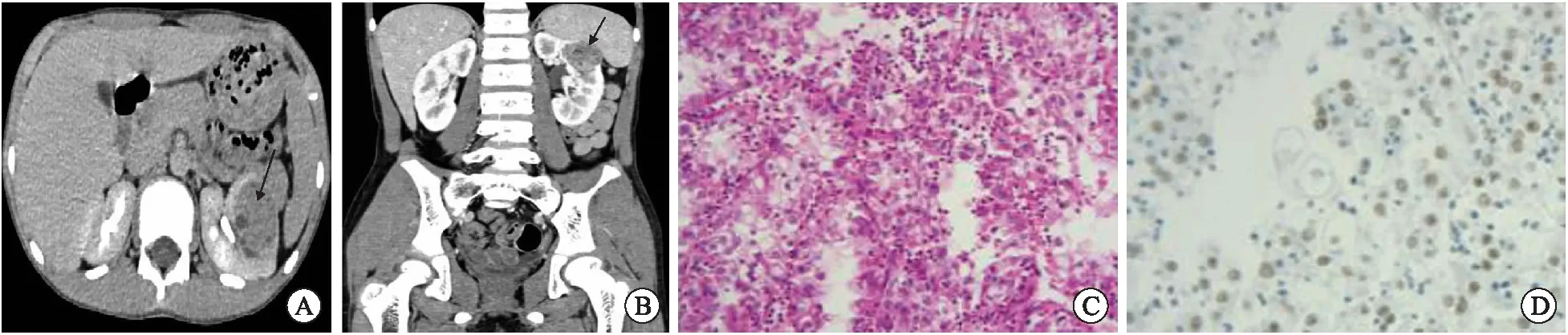
A:轴位增强肾盂期CT;B:冠位增强皮质期CT;C:术后病理(HE,×200);D:免疫组化(TFE3抗原,×200)。图1 Xp11.2 tRCC病例1术前影像学及术后病理图
病例2,男性,12岁,因“B超发现左肾囊性包块,并增大1年”入院。查体无明显异常,查尿常规示:红细胞及白细胞均为阴性,尿蛋白(+);查肿瘤全套示AFP、CEA、CA-125均正常,CA19-9为33.8 U/mL。行彩超检查示:左肾中下级实质内多房囊性包块,约6.2 cm×5.1 cm×4.4 cm,边界清晰,内可见多条稍高回声光带分隔。行腹部CT平扫+增强示(图2A、B):左肾体积增大,左肾中下极实质内见一圆形低密度影,CT值约10 Hu,其内可见分隔和点状钙化,未见强化,边界清,肿块约50 mm×50 mm×54 mm,延时扫描未见造影剂进入包块,余无明显异常;影像学诊断:左肾囊性占位,考虑为肾囊肿。术前诊断:左肾囊性占位性病变(Bonsiak Ⅲ级,T1bN0M0,RENAL评分9X)。完善术前检查,气管插管全身麻醉下行腹腔镜保留肾单位左肾部分切除术,术中将囊性占位完整切除,包膜无破裂,手术顺利。术后病理诊断(图2C~E):(左)Xp11.2转位/TFE3融合性肾细胞癌;肿块约5.7 cm×4.3 cm×2.2 cm,切开可见内有多个囊腔,囊腔直径约0.6~4.8 cm,壁厚0.1 cm,肾周脂肪组织内均未见肿瘤成份;免疫组化结果:TFE3(+)、CK(PAN)(+)、CK8/18(部分+)、WT-1(-)、Ki-67(约<1%+)、CK34βe12(-)、CD10(+)、EMA(-)。荧光原位杂交(fluorescence in situ hybridization,FISH)检测结论:TFE3基因异位检测结果为阳性(试剂盒:Zytolight TFE3基因双色分离断裂探针)。术后随访见患儿恢复可,病情稳定,行腹部B超、胸腹部CT等检查未见明显肿瘤转移征象。

A:轴位增强髓质期CT;B:冠位增强髓质期CT;C:大体标本;D:术后病理(HE,×100);E:免疫组化(TFE3抗原,×100)。图2 Xp11.2 tRCC病例2术前影像学及术后病理图
2 讨 论
Xp11.2 tRCC定义为X染色体短臂一区一带二亚带(Xp11.2)的转录因子E3(TFE3 gene fusion,TFE3)断裂后与其他染色体发生平衡易位,形成不同类型的TFE3融合基因[3]。目前已经证实Xp11.2 tRCC所涉及的融合基因至少有5种,均可导致融合型TFE3蛋白的过度表达[2-4]。融合型TFE3蛋白比野生型TFE3蛋白的转录激活活性更强,其可在体外与MET启动子结合,增强MET mRNA蛋白表达,导致HCG/MET通路异常激活,而该通路与肿瘤细胞的增殖失控、侵袭和转移密切相关,最终表现出Xp11.2 tRCC这一独特肾癌亚型[5]。
Xp11.2 tRCC术前诊断多比较困难,其缺乏特异性的临床表现,同时具备肾癌三联征(肉眼血尿、腹痛和腹部包块)者较少见,肾外症状更为罕见,大部分患者通过体检偶然发现,也有部分患者以转移灶症状为首发表现[6]。成人Xp11.2 tRCC则容易出现淋巴结和远处转移(肝脏、肺),普遍表现为侵袭性强、疾病进展快、预后差的特点;Xp11.2 tRCC在儿童及青少年患者中临床表现多为惰性,进展较为缓慢[7]。肾脏增强CT是初步诊断Xp11.2 tRCC的最佳手段,对该疾病的敏感性达90.0%,特异性达92.9%;影像学上此类肾癌多伴有囊性变、坏死、出血、实质部分强度强化,肾脏增强CT注射造影剂后,相对于肾透明细胞癌的“快进-快出”,Xp11.2 tRCC呈现“少进-慢出”的特点[3,8-9]。儿童患者中如存在淋巴结转移或类似于乳头状细胞肾癌影像学改变,则诊断为Xp11.2 tRCC的可能性大[10]。
Xp11.2 tRCC治疗方法有根治性肾切除(radical nephrectomy,RN)和保留肾单位肾部分切除术(nephron sparing surgery,NSS),对于直径小于4~7 cm的早期RCC,成人主要应用NSS治疗,NSS可取得与RN相似的效果,且在长期随访中拥有良好的肾功能、心血管功能,总体预后较好。对于伴有区域淋巴结转移、肿瘤边界不清或已侵犯集合系统、出现腔静脉癌栓的患者,主张行RN[3,7,11]。
近年来因腹腔镜手术创伤小、视野清晰、出血少、操作精确、术后恢复快等优点,其在成人肾癌诊治中得以广泛应用并取得较多经验;但因儿童腹腔小,技术及理念上存在很多分歧和困难,故对儿童肾肿瘤行腹腔镜手术国内外文献报道较少[3、12-13]。本文病例1患儿有血尿病史,影像学检查提示左肾肿瘤直径约4 cm,已向内侵及肾盏,肾周组织及局部淋巴结未见明显异常。术前影像学诊断:左肾上极前缘向外膨隆包块,首先考虑为肾癌。患儿手术耐受性可,经科室讨论后行后腹腔镜根治性左肾切除术,术后病理报告为Xp11.2易位/TFE3基因融合相关性肾癌,肾周脂肪组织及输尿管残端未见肿瘤成份。病例2患儿无明显临床症状,影像学检查提示左肾病灶为多房囊性包块,直径约6 cm,边界清晰,肾周组织及局部淋巴结未见明显异常。术前影像学诊断:左肾囊性占位,性质暂不明确。患儿一般情况可,遂行腹腔镜保留肾单位左肾部分切除术,术中将囊性占位完整切除,包膜无破裂。术后病理报告为Xp11.2易位/TFE3基因融合相关性肾癌,形态学特征呈多房囊性改变,肾周脂肪组织及肾盏切缘均未见肿瘤成份。2例患儿手术均顺利完成,术中出血少,术后恢复可,术后随访行影像学检查均未见明显肿瘤转移征象。
Xp11.2 tRCC组织中TFE3表达均较高,都有一段保守序列,通过保守序列的抗体可以对所有融合基因产物进行定性和半定量分析,其敏感性和特异性可分别达到99.6%和97.5%[2]。免疫组化染色检测TFE3阳性表达已经成为诊断此类肾癌的特征性标记物,但在非Xp11.2 tRCC中也有TFE3蛋白阳性的表现[14]。有研究发现组织蛋白酶K(Cathepsin K,Cath-K)表达于约60%的Xp11.2 tRCC病例,可有效鉴别Xp11.2 tRCC与肾透明细胞癌、肾乳头状癌等[15]。Cath-K诊断敏感性仅达72.7%,没有超越TFE3蛋白,但特异性达100.0%,其阳性强度与TFE3基因的融合伴侣有关[16]。因此,联合TFE3蛋白免疫组化及FISH可进一步诊断Xp11.2 tRCC的亚型[15-17]。
有研究发现Xp11.2 tRCC DNA修复机制较为完善,通过DNA损伤诱导肿瘤细胞凋亡作用不大,因此常规放、化疗效果较差[18]。随着靶向药物精准治疗的应用,有研究发现苹果酸舒尼替尼对Xp11.2 tRCC有确切疗效,但尚缺乏大量病例的循证医学证据[3,9]。因靶向药物对患儿生长发育可能有影响,导致其在儿童Xp11.2 tRCC中应用受到限制。
近年1项Kaplan-Meier分析表明儿童和成人 Xp11.2 tRCC 患者无论是行NSS或RN,生存率均无明显统计学意义,预后也无性别差异,但成人Xp11.2 tRCC患者总体生存率明显偏低[3]。Xp11.2 tRCC的融合类型也是影响肿瘤侵袭性和预后的重要因素,另有研究发现有区域淋巴结转移但无远处转移的儿童Xp11.2 tRCC也有相对较好的长期预后,总体生存率为72.4%,约是成人对照组的3倍[3,19]。因此,术前系统性评估患儿影像学特征,如患儿手术耐受性可,可选择腹腔镜NSS或RN治疗儿童Xp11.2 tRCC,使患儿最大程度获益[2,11,13,20]。

