重症新型冠状病毒肺炎患者预后危险因素的评估
薛文娟, 陈公平, 林振吕, 林 婷, 张 伟
新型冠状病毒(2019 novel Coronavirus,2019-nCoV)感染引起的以呼吸系统受累为主的疾病,具有传染性,可通过呼吸道飞沫及密切接触传播[1-2]。新型冠状病毒肺炎(Coronavirus disease 2019,COVID-19)可表现为发热、干咳、气喘、乏力,除了呼吸系统外,还可侵犯消化系统、心血管系统等[3-4]。据世界卫生组织统计,截至2021年7月5日,全球COVID-19累计确诊病例超过1.85亿,死亡病例超过400万,病死率高[5]。部分COVID-19患者虽早期以轻型或普通型为主要表现,但可进展为重型或危重型。因此,及时正确地评估病情十分重要,及早发现、诊断及治疗对于改善COVID-19患者的预后具有重要的意义。本研究拟探讨影响重症COVID-19患者预后的危险因素,为临床早期识别重症患者提供参考。
1 对象与方法
1.1 对象 收集2020年1月17日—2月26日湖北省宜昌市第三人民医院确诊的359例COVID-19患者的临床资料,男性195例,女性164例,年龄(52.64±17.27)岁(18~91岁)。纳入标准:(1)年龄≥18周岁;(2)根据国家卫生健康委员会发布的《新型冠状病毒肺炎诊疗方案(试行第六版)》[6]的诊断标准确诊COVID-19患者。排除标准:(1)年龄<18周岁;(2)临床资料不完整。本研究经福建医科大学附属第一医院伦理委员会批准(伦理审批编号:闽医大附一伦理医研[2020]153号),患者均签署知情同意书。
1.2 方法
1.2.1 收集一般资料 收集患者的一般资料,包括性别、年龄、吸烟及饮酒史、基础疾病(高血压病、糖尿病、恶性肿瘤、脑血管疾病等)、症状、实验室检查及影像检查等。肝功能异常(以下情况≥1项者)定义:丙氨酸氨基转移酶(alanine transaminase, ALT)>40 U/L;天冬氨酸氨基转移酶(aspartate aminotransferase, AST)>40 U/L;或总胆红素(total bilirubin, TBIL)>20.4 μmol/L。急性肾损伤定义为48 h内血清肌酐升高≥0.3 mg/dL(≥26.5 μmol/L);或在过去1周内血清肌酐增加至≥1.5倍基线值;或尿量<0.5 mL/(kg·h),持续6 h。
1.2.2 临床分型 根据《新型冠状病毒肺炎诊疗方案(试行第六版)》[6]标准,临床分为4型:
1.2.2.1 轻型(6例) 临床表现轻微,影像上无肺炎的表现。
1.2.2.2 普通型(287例) 表现发热、干咳等,影像学上有肺炎的表现。
1.2.2.3 重型(33例) 符合以下情况之一者:有气促,呼吸频率≥30 min-1;静息状态时,外周氧饱和度≤93%;氧合指数即动脉血氧分压与吸入氧浓度比值≤300 mmHg(1 mmHg=133.3 Pa)。
1.2.2.4 危重型(33例) 符合以下情况之一者:表现为呼吸衰竭并且需要行机械通气治疗;有休克症状;合并其他器官功能衰竭需ICU监护治疗。
1.2.3 分组 重型及危重型患者纳入重症,随访至2020年4月10日,根据重症患者的转归,分为存活组(n=51)及死亡组(n=15)。重症患者死亡组中呼吸支持方式10例为有创机械通气,5例为高流量给氧或无创通气;生存组2例为有创机械通气,29例为高流量给氧或无创通气,20例为鼻导管给氧。重症患者死亡组中1例未接受激素治疗,14例接受激素治疗;生存组中8例未接受激素治疗,43例接受激素治疗。所有重症患者均接受抗病毒治疗。

2 结 果
2.1 轻型/普通型、重型及危重型患者的一般资料比较 3种分型患者的性别、吸烟、饮酒人数差别均无统计学意义(P>0.05);3种分型患者的年龄、高血压病、糖尿病、冠状动脉粥样硬化性心脏病(冠心病)、脑血管疾病、慢性阻塞性肺病(chronic obstructive pulmonary disease, COPD)、恶性肿瘤、肝功能损害、急性肾功能损伤、急性心肌损害、急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)及死亡人数比较,差别有统计学意义(P<0.05),死亡人数主要见于危重型(表1)。
2.2 轻型/普通型、重型及危重型患者的实验室指标比较 3种分型患者入院时白细胞数、ALT及总胆红素比较,差别无统计学意义(P>0.05);入院时中性粒细胞数、淋巴细胞数、血红蛋白、血小板、白蛋白、乳酸脱氢酶(lactate dehydrogenase,LDH)、AST、血肌酐、最高白细胞数目、最高中性粒细胞数目、最低淋巴细胞数、最低血小板、最长凝血酶原时间(prothrombin time,PT)、活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、ALT峰值、AST峰值、肌酐的峰值、最大D-二聚体、LDH峰值、C-反应蛋白(C-reactive protein,CRP)、降钙素原(procalcitonin,PCT)比较,差别具有统计学意义(P<0.05,表2)。

表1 新型冠状病毒肺炎不同分型患者的一般资料比较
2.3 重症患者中生存组及死亡组的一般资料比较 两组患者的性别、年龄、吸烟、饮酒、糖尿病、冠心病、脑血管疾病、急性肾功能损伤、急性心肌损害差别均无统计学意义(P>0.05);死亡组患者的高血压病、COPD、恶性肿瘤、肝功能损害及ARDS比例显著高于存活组,差别具有统计学意义(P<0.05,表3)。
2.4 重症患者中生存组及死亡组的实验室指标比较 两组患者入院时的白细胞数目、中性粒细胞数目、血小板、白蛋白、LDH、ALT、AST、血肌酐、总胆红素、ALT、肌酐的峰值比较,差别无统计学意义(P>0.05);入院时的淋巴细胞数、血红蛋白、最高白细胞数目、中性粒细胞数目、最低淋巴细胞数、血小板、最长PT、APTT、最大D-二聚体、AST峰值、CRP、PCT、最低氧合指数比较,差别有统计学意义(P<0.05,表4)。
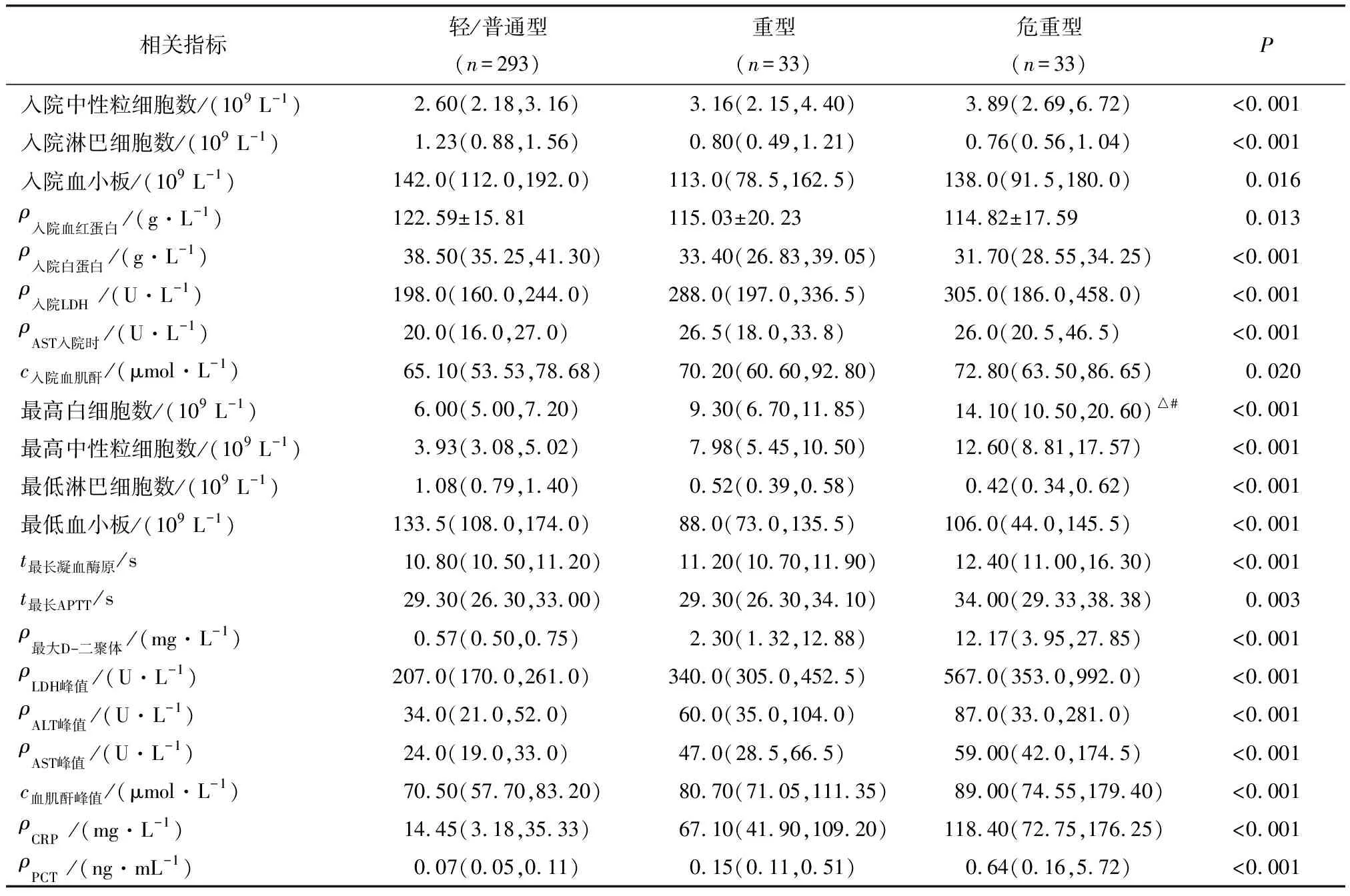
表2 新型冠状病毒肺炎不同分型患者的实验室指标比较Tab.2 Comparison of laboratory indicators of patients with different clinical type of Coronavirus disease 2019

表3 重症新型冠状病毒肺炎生存组及死亡组患者的一般资料比较
2.5 重症COVID-19患者死亡的多因素Cox回归分析 对重症COVID-19患者行单因素Cox回归分析显示,年龄、高血压病、COPD、恶性肿瘤、急性心脏损害、ARDS、入院时中性粒细胞数、入院淋巴细胞数、最高白细胞数、最高中性粒细胞数、最低血红蛋白、最低血小板、最长PT及最大D-二聚体与重症COVID-19患者死亡相关。多因素Cox回归分析发现,ARDS、最长PT及CRP是重症COVID-19患者死亡的危险因素,入院时淋巴细胞数升高是重症COVID-19患者死亡的保护因素(P<0.05,表5)。
3 讨 论
COVID-19是一种具有高传染性的全球公共卫生疾病,病死率高。本研究发现,重症COVID-19患者年龄、死亡率、基础疾病发生率及炎症指标显著高于轻型/普通型,肝肾功能指标较差。此外,与重症COVID-19存活组比较,死亡组入院时的淋巴细胞数、血红蛋白、血小板明显降低,最高白细胞数目、最高中性粒细胞数目、最长PT、APTT、D-二聚体、AST峰值、CRP及PCT显著升高。通过多因素Cox回归分析发现,ARDS、最长PT及CRP是重症COVID-19患者死亡的危险因素。一旦发生ARDS,COVID-19死亡的概率显著增加,淋巴细胞数增加是重症COVID-19患者死亡的保护因素。

表4 重症新型冠状病毒肺炎生存组及死亡组患者实验室指标比较Tab.4 Comparison of laboratory indicators between the survival group and the death group of patientswith severe and critical Coronavirus disease 2019

表5 重症新型冠状病毒肺炎患者死亡的多因素Cox回归分析Tab.5 Multivariate Cox regression analysis on the death of patients with severe Coronavirus disease 2019
本研究发现,老年人尤其是合并有多种慢性基础疾病的患者更容易发生重症COVID-19,预后更差,这与既往的研究一致[7-8]。一项纳入1 099例确诊COVID-19的回顾性研究发现,重症COVID-19患者更容易合并慢性疾病,且重症患者的年龄显著高于非重症患者[9]。体液和细胞免疫功能随着年龄的增长而下降,且中性粒细胞趋化性及吞噬作用也会减弱。病毒入侵人体后会激活免疫系统,对于免疫功能降低的老年人,尤其是合并呼吸系统及心脑血管疾病者,病情进展快。
淋巴细胞减少与COVID-19患者预后差相关[10-12]。一项纳入339例老年COVID-19患者进行4周随访的研究发现,死亡组中淋巴细胞比生存组明显减少,死亡组的CD4+和CD8+淋巴细胞计数均显著减少,提示患者的细胞免疫受到抑制[11]。另一项研究显示,淋巴细胞数目降低是老年COVID-19患者死亡的一个危险因素[12]。本研究发现,淋巴细胞降低是重症COVID-19患者死亡的危险因素。此外,炎症介质引起的免疫损伤以及肺部募集淋巴细胞到气道中,这些可能是COVID-19患者淋巴细胞减少的原因。
有研究表明,细胞因子炎症风暴是COVID-19疾病进展的可能原因[13-14]。SARS-CoV-2进入宿主细胞后开始繁殖,激活机体的免疫细胞,释放大量炎症因子,病毒或炎症因子损伤组织,可引发严重的炎症反应。CRP、PCT是临床上常见的炎症标志物,能反应机体的炎症状态及程度。Luo等[15]的研究提示,入院时CRP水平是COVID-19不良预后的独立预测因子。此外,通过地塞米松抑制全身炎症可降低COVID-19的死亡率,提示COVID-19的炎症反应与预后之间可能存在因果[16]。但有研究发现,使用大剂量的糖皮质激素可引起机体免疫功能低下,导致感染,病情加重[17]。
重症COVID-19容易发生凝血功能异常,影响患者的预后[18-19]。在COVID-19患者机体中,尤其是重症患者,病毒、炎症因子风暴或缺氧等原因损伤血管内皮细胞,可引起组织因子释放入血,激活外源性凝血途径,导致机体的微循环血栓形成,使得外源性凝血因子过度消耗,出现PT延长,引起凝血功能异常。本研究发现,重症患者死亡组的PT较存活组明显延长,且PT延长可能是重症COVID-19患者死亡的危险因素,提示外源性凝血途径受损。外源性凝血途径相关的凝血因子的消耗或合成不足,可能与重症COVID-19患者预后差相关。
本研究存在以下不足:本研究为回顾性研究,重型及危重型的病例数较少,且病例来源于单中心,可能存在选择偏倚;此外,随访时间较短,仍需大样本前瞻性试验进一步评估重症COVID-19患者死亡的因素。

