腹腔镜下胆囊癌根治术的有效性及安全性分析
袁志明
(长江水利委员会长江医院普外科 湖北 武汉 430019)
胆囊癌是一种胆道系统恶性肿瘤,具有较高的恶化程度,放化疗治疗时的敏感度较低,预后效果不理想,5 年生存率较低,因此,临床多采用根治性切除术治疗,具有较高的治愈率。以往临床采用开放胆囊癌根治术,术中不仅切口大,也会将腹腔内脏器较长时间暴露在空气内,增加感染风险,不利于术后康复。随着腹腔镜技术的不断成熟完善,腹腔镜下胆囊癌根治术在临床得到了普及推广,使开腹手术缺陷不足得以弥补,在去除病灶的基础上,减少患者术中损伤,更有利于患者术后恢复[1]。为了进一步了解腹腔镜下胆囊癌根治术实施的有效性及安全性,本研究选择180 例胆囊癌病例开展分组对比,现报道如下。
1.资料与方法
1.1 一般资料
选取2019 年5 月—2021 年5 月长江水利委员会长江医院收治的180 例胆囊癌患者。纳入标准:①病例均自愿接受影像学检查、血清肿瘤标志物等综合检查,诊断为胆囊癌;②具有手术指征,术前患者及家属自愿接受根治性手术,签署同意书;③患者意识功能正常,可正常沟通交流。排除标准:①有严重靶器官功能障碍;②合并其他恶性肿瘤与凝血功能障碍患者;③妊娠期或哺乳期女性;④存在远处转移、手术禁忌证患者;⑤不配合与资料不全者。根据手术术式不同分为两组,对照组中病例90 例,男性53 例,女性37 例,年龄37 ~68 岁,平均年龄(42.08±3.67)岁,TNM 分期:Ⅰ期37 例,Ⅱ期53 例;观察组90 例,男性50 例,女性40 例,年龄34 ~70 岁,平均年龄(42.57±3.44)岁,TNM 分期:Ⅰ期36 例,Ⅱ期54 例。两组间病例资料比较无显著差异(P>0.05),具有可比性。
1.2 方法
对照组实施开腹胆囊癌根治术,流程如下:气管插管麻醉,取仰卧位,作一切口,位置位于右上腹腹直肌处,长度控制在10 cm,将皮下组织依次分离后,探查腹腔内脏腑情况,详细观察胆囊处病变情况,对胆囊及部分肝脏进行常规切除,再开展常规淋巴结清扫,清扫范围在胰十二指肠及相关组织。切除病灶后,利用电凝止血,利用无菌0.9%氯化钠溶液冲洗腹腔,放置引流管,缝合切口。
观察组实施腹腔镜下胆囊癌根治术,流程如下:气管插管麻醉,取仰卧位,作一切口,位置于脐下1 cm,作为主操作孔,将套管针置入,输入二氧化碳,建立气腹,控制负压值在12 mmHg;在剑突侧切口、右侧肋缘处切口作为辅助操作口,将5 mm 与12 mm 的套管针分别置入到辅助切口内;将腹腔镜置入后,利用显示屏观察腹腔内情况,通过转换探头位置对腹腔情况进行详细探查,于胆囊处用保护袋取出一块病变组织,送往实验室开展病理检查,确诊为胆囊癌后,再开展根治性手术,先清扫肝十二指肠韧带处淋巴结,根据患者的实际病情,开展肝段切除术或者肝外胆道切除术治疗,外胆道切除者开展胆肠吻合术;行肝部分切除患者需阻断肝蒂,明确切除范围后,将管道结构夹闭分离,用电刀切断,电凝处理创面达到止血目的,用保护袋取出病灶送往实验室开展病理检查。解除气腹,无菌0.9%氯化钠溶液冲洗腹腔后,放置引流管,将切口关闭,术毕。
1.3 观察指标
①记录手术指标,包括切口长度、手术时间、术中出血量;②康复指标:术后首次下床时间、引流管留置时间、首次排气时间、住院时间;③测量术前1 d、术后第3 天患者的炎症因子水平,包括白介素-6(IL-6)、C-反应蛋白(CRP)、肿瘤坏死因子-α(TNR-α);④统计术后患者感染、胆瘘等并发症发生情况。
1.4 统计学方法
采用SPSS 24.0 统计软件进行数据处理。正态分布的计量资料采用均数±标准差(± s)表示,组间比较采用t检验;计数资料用频数(n)、百分比(%)表示,组间比较采用χ2检验。P<0.05 为差异有统计学意义。
2.结果
2.1 两组手术指标对比
手术后观察组手术涉及相关指标优于对照组,差异均有统计学意义(P<0.05),见表1。
表1 两组手术指标对比(± s)
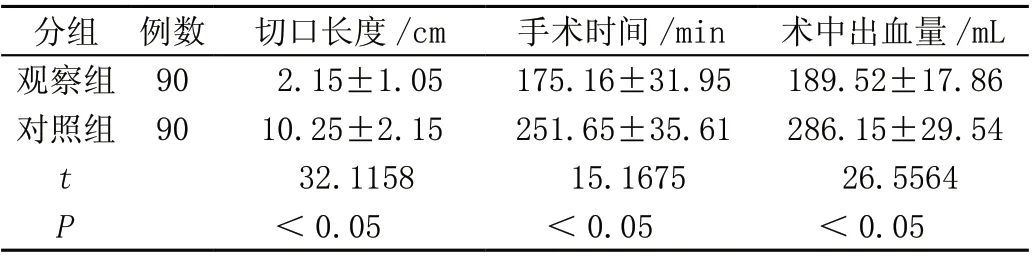
表1 两组手术指标对比(± s)
分组 例数 切口长度/cm手术时间/min术中出血量/mL观察组 902.15±1.05175.16±31.95189.52±17.86对照组 9010.25±2.15251.65±35.61286.15±29.54 t 32.115815.167526.5564 P<0.05<0.05<0.05
2.2 两组术后康复指标对比
观察组患者术后康复所用时间少于对照组,差异均有统计学意义(P<0.05),见表2。
表2 两组术后康复时间比较(± s, d)
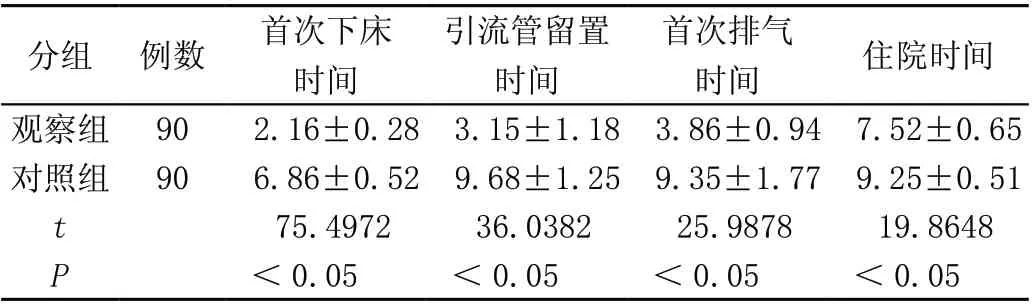
表2 两组术后康复时间比较(± s, d)
分组 例数首次下床时间引流管留置时间首次排气时间住院时间观察组 902.16±0.28 3.15±1.18 3.86±0.94 7.52±0.65对照组 906.86±0.52 9.68±1.25 9.35±1.77 9.25±0.51 t 75.497236.038225.987819.8648 P<0.05<0.05<0.05<0.05
2.3 两组炎症指标对比
术后观察组第3 天的炎性指标与对照组术后指标相比更少,差异均有统计学意义(P<0.05),见表3。
表3 两组炎性因子水平比较(± s)
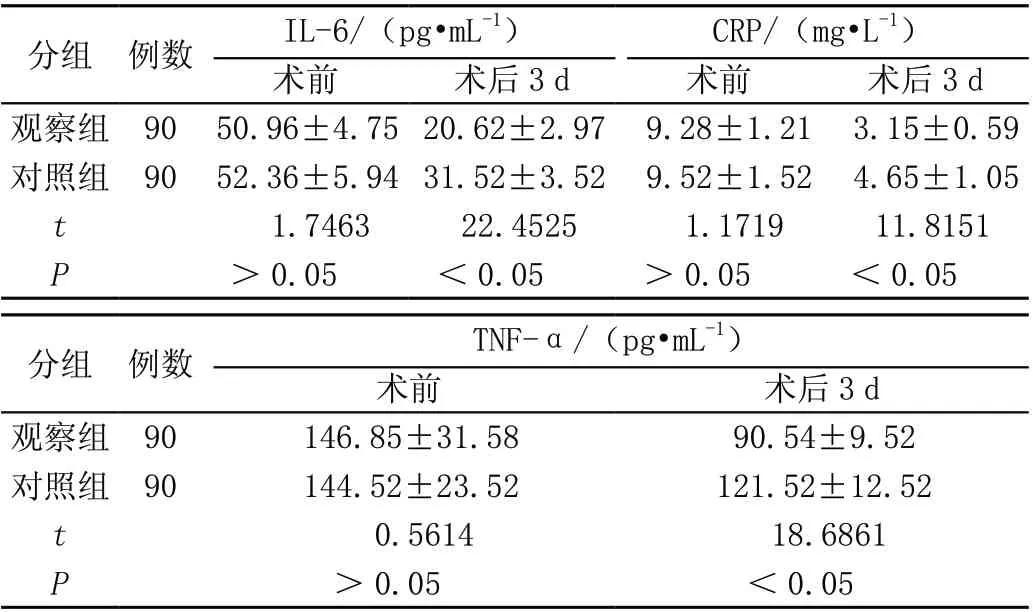
表3 两组炎性因子水平比较(± s)
CRP/(mg·L-1)术前术后3 d术前术后3 d观察组 90 50.96±4.75 20.62±2.97 9.28±1.21 3.15±0.59对照组 90 52.36±5.94 31.52±3.52 9.52±1.52 4.65±1.05 t 1.746322.45251.171911.8151 P>0.05<0.05>0.05<0.05分组 例数IL-6/(pg·mL-1)TNF-α/(pg·mL-1)术前术后3 d观察组 90146.85±31.5890.54±9.52对照组 90144.52±23.52121.52±12.52 t 0.561418.6861 P>0.05<0.05分组 例数
2.4 两组并发症比较
术后观察组出现的并发症发生率低于对照组,差异有统计学意义(P<0.05),见表4。
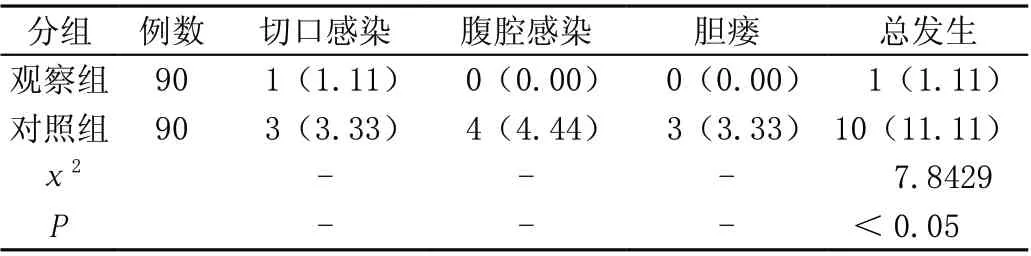
表4 两组并发症发生情况比较[n(%)]
3.讨论
胆囊癌是由于胆结石刺激黏膜诱发上皮化生突变,胆汁排空障碍,导致胆石酸等致癌物质在胆汁内增多而诱发癌变[2-3]。胆囊癌是胆道系统常见恶性肿瘤,多见胆囊体部、底部等部位,国内胆囊腺癌发生率较高。数据显示,全国范围内胆囊癌发病率约占总胆道病0.43%~3.80%,位居第5 位(胃癌、肝癌、食管癌及结肠癌),男性发病率低于女性,约1:3,随着年龄增长,该病发病率逐年递增。
高危因素。①胆囊结石和慢性胆囊炎。胆囊癌、胆囊结石间相互作用是“永恒话题”。全国流行病学数据调查中,胆囊癌伴胆囊结石患者占比49.7%,这和结石直径、数目等因素有关,即结石直径>2 cm,癌变率也会随之提高。慢性胆囊炎是因急性/亚急性胆囊炎反复发作、长期胆结石等因素导致,即胆囊结石和慢性胆囊炎间呈因果关系,随着结石机械性刺激,诱发胆囊黏膜损伤、DNA 损伤,致使其持续性再生和修复,释放诸多细胞因子及生长因子,诱发癌变。②胆囊息肉样变。基于现代影像学技术的持续发展,胆囊息肉样变检出率为7%~12%,存在肿瘤性、非肿瘤性类别。后者多是因胆固醇沉积、炎症、反应性增生等原因导致的病理学改变,虽癌变率较低,但若面临以下情况应警惕是否恶变:息肉直径>1 cm,恶变率约为25%;息肉直径<1 cm 但伴有胆囊炎、胆囊结石等症;基底部息肉较宽或为单发,且急速增大(增长速度不低于0.3 cm/6 个月)。
影像学检查。①腹部彩超。是胆囊癌常见检查方式,可检出直径0.2 cm 以上病灶,包含息肉型、肿块型、厚壁型及弥漫型等类别、为更好保证腹部彩超检查结果,杜绝胃肠胀气对检查结果的影响,推荐空腹检查,但在早期胆囊癌检查中仍未满足理想状态。内镜超声是近几年新型技术,通过高频探头和病灶紧贴,缩短声路,预防声衰竭,杜绝因肥胖、结石和肠道积气等原因导致的图像伪影。②CT 检查。和腹部彩超相比,CT 敏感性较差,但准确率较高,为83.0%~93.3%。是以自身检查便捷、无创伤和空间分辨率高等优势,成为胆囊癌检查的首选。影像学表现为:囊壁处呈现局限性/弥漫性不均匀性增厚;结节向胆囊强突出,且胆囊腔已被肿块填充,但密度不均。同时,增强CT 还可对胆囊良恶性病变予以进一步筛查,便于手术方案的调整。
胆囊癌手术治疗的效果及预后,1777 年,由奥地利医生首次提出胆囊癌,但百年后(1887 年)首次施行切除术,目前虽已得到200 余年研究,但尚未明确充分认识胆囊癌。原因为:胆囊具有较为特殊的解剖结构,病灶极易出现浸润、转移,早期缺乏典型症状,导致临床确诊时病情已经发展至中晚期,此时多以手术方式切除胆囊,以达到根治目的,以延长患者的生存周期,提升生存质量[4]。但在Ⅳ期、Ⅴ期患者,预后效果极差,若未及时治疗生存期不足6 个月,术后5 年内生存率更是低于5%,即探寻更为科学且有效的治疗方案尤为必要。
随着腹腔镜技术的进一步发展,腹腔镜手术的使用范围大幅扩大,在胆囊癌治疗中也有所应用,但是相关研究仍相对较少。根据现有研究显示[5],胆囊炎病例开展手术治疗时,采用腹腔镜行根治性手术,可减少术中损伤,有效切除病灶,安全性高,整体疗效较为理想。本组研究结果证实,与开腹胆囊癌根治术相比,观察组所开展的腹腔镜胆囊癌根治术开展后,术中损伤小,术后胃肠功能与切口恢复时间较短,炎性指标水平降低较快,可减少感染、胆瘘等并发症发生率,整体手术优势更明显,安全性更高。
胆囊癌根治术实施过程中,需将肝脏与周围侵犯脏器组织切除干净,做好区域淋巴结清扫工作,切除病灶后重建消化道方可完成手术[6],使得手术操作难度大,很多学者质疑腹腔镜根治术在胆囊癌治疗中的效果与安全性。担心手术安全的原因主要是怕术中操作不当,出现肿瘤破裂或胆汁瘘等因素,导致腹腔内病灶转移或者出现切口种植,导致术后复发[7]。随着腹腔镜手术的深入,临床经验不断丰富,腹腔镜根治术可做到整块切除,有效避免胆囊破裂导致腹腔污染,在取出标本时用保护袋,也可避免标本转移时感染其他部位,从而有效避免上述存在问题,使手术的安全性与有效性均可大幅提升[8]。腹腔镜作为微创手术方法,可减少切口长度,避免腹腔长时间与空气接触,从而降低感染风险,对于腹腔内其他脏腑器官的影响也会有效减少,更好降低术后并发症的发生风险,使得患者在术后的恢复时间有效缩短。术中是通过腹腔镜对病灶进行观察,了解病灶与周围脏腑器官的关系,这对于操作者的专业能力要求较高,需要熟练掌握腹腔镜的使用方法,术中稳定、有序的操作是保证手术顺利完成及患者预后康复的关键所在。
另外,IL-6、CRP、TNF-α 是机体炎症敏感指标,指标水平和炎症程度呈正相关,可直观反映躯体炎症程度。针对手术患者,应激反应较强时会引起炎症指标增高,诱发术后并发症,阻碍术后康复。但在腹腔镜下胆囊癌根治术患者中,因切口小和创伤轻等优势,可减轻机体应激反应,杜绝机械性损伤,减缓炎症指标剧烈波动;预防腹腔长期暴露导致的感染;术野极为清晰,避免组织牵拉、意外损伤等原因导致的胆瘘。
腹腔镜胆囊切除术虽是胆囊良性病症常见术式,但却因早期胆囊癌的隐匿性,难以借助肉眼探查、胆囊标本检验中发现病灶组织。即以TNM 分期为导向,调整手术方式、切除范围备受医疗关注,但在TIb 期患者中却存在争议,原因为:①Tis 期、TIa 期胆囊癌由于仅侵犯黏膜及下层组织,处于隐匿期。通过腹腔镜胆囊切除术治疗,无任何组织损伤,切缘处呈阴性,5 年生存期高达100%,无需再次施行根治术,仅需在术中彻底切除胆囊即可。②TIb 期胆囊癌已侵犯到黏膜肌层,既往报道中多为回顾分析,面临可靠性和证据级别低等缺陷,仍处于探索研究。原因为:该时期胆囊癌会对胆囊三角区、胆总管等部位淋巴结造成累及侵犯,转移率约为15.7%,淋巴管浸润率更是高达18%。通过国内外研究数据表明,在TIb 期胆囊癌患者预后及复发效果比较中,可知腹腔镜胆囊切除术更具优势,即在根治术的基础上施行淋巴清扫是可行的,且5 年内患者生存率更是由最初40%增加到72%。③和TIb 期胆囊癌相比,T Ⅱ期治疗方案较为明确,除胆囊切除术外,还应施行S4b-S5 段切除术。
综上所述,腹腔镜下胆囊癌根治术实施后,视野清晰,创伤小,可减少机械性损伤与严重炎性反应,减少胆瘘、感染等并发症发生,更有利于患者术后恢复,整体疗效与安全性更理想。

