半夏SSR分子标记开发与遗传多样性
张景,李晓东,宗庆波,何贝贝,拉基,景纳良,王柯月,钟淑梅,舒少华
1.华中农业大学植物科学技术学院,武汉 430070; 2.湖北省果茶办公室,武汉 430070;3.九州通医药集团九信中药研究院,武汉 430051
半夏(Pinelliaternata(Thunb.) Breit.)是天南星科多年生草本植物,其药用部位为干燥块茎,具有燥湿化痰、消痞散结的功效[1],现代药理研究发现半夏具有镇咳、止呕、抗炎抗病毒等作用[2]。半夏作为药材使用历史悠久,以野生资源为主,主要分布于四川、湖北、安徽、江苏、河南和浙江等地。近年来,由于半夏生长环境的不断恶化、人为过度采集,使半夏野生资源急剧减少[3],因此,有必要开展半夏资源的保护和种质资源遗传多样性的研究[4]。同时,半夏分布广泛,种质资源比较丰富,药用品质也存在不同[5],并且难以从形态上识别。目前生产中,发现极少数块茎为红色的半夏品种具有高产、高抗性等特点,但是却没有一套完整的选育方法。
SSR(simple sequence repeats,SSR)标记因其多态性高、重复性好、覆盖面广等优点,广泛运用于QTL图谱绘制、遗传多样性分析和分子标记辅助育种等方面[6-7]。Bernadette等[8]利用SSR分子标记构建了四倍体苜蓿的遗传图谱;李磊等[9]从50对ISSR引物中筛选到5对多态性高的引物,从而实现在分子水平对5种叶型半夏的鉴定与区分;徐敏等[10]通过开发9对SSR引物发现五味子居群间有一定的基因流,居群内存在着丰富的遗传多样性;Feng等[11]研究结果表明,SSR标记具有很高的重复性和信息量,可用于评价药用菊科植物的遗传多样性和亲缘关系。
目前对半夏的栽培[12]、药理作用[13-14]等方面已有一些研究,但关于半夏种质资源遗传多样性和分子标记辅助育种等方面的研究相对较少。由于采用高通量测序方法开发SSR标记在植物中被广泛应用[15-17],本研究基于半夏转录组数据,设计开发SSR引物,对不同居群半夏之间的种群结构、遗传多样性进行分析,旨在为半夏资源保护、遗传多样性研究和分子辅助育种提供参考和依据。
1 材料与方法
1.1 材 料
半夏材料共17份,包括从全国收集的14份材料以及从湖北省江汉平原地区野生半夏资源中选育的3份材料,所有收集到的材料经湖北中医药大学陈科力教授鉴定为天南星科植物半夏(P.ternata),收集到的材料种植于华中农业大学药用植物资源圃。详见表1。

表1 半夏试验材料 Table 1 P. ternata germplasm
1.2 DNA提取
选取幼嫩的半夏叶片置于液氮中速冻带回,采用改良的 CTAB法进行半夏基因组DNA的提取,利用超微量紫外分光光度计检测DNA浓度与质量,于-20 ℃保存备用。
1.3 SSR引物开发
半夏转录组数据由云南农业大学杨生超教授提供。针对不同的Unigene设计SSR引物共2 000对。利用生物信息学软件(Primer-blast)对引物进行比对,筛选出266对引物并由生工生物工程(上海)股份有限公司合成。
1.4 多态性SSR引物筛选
利用2个不同居群半夏的叶片DNA(HTX1、HBLK)进行PCR扩增,通过2%琼脂糖凝胶电泳筛选能够扩增出目的产物大小且条带清晰明亮的引物。利用初筛的引物分别对17份不同居群的半夏DNA进行PCR扩增,利用6%聚丙烯酰胺凝胶电泳(PAGE)检测初筛引物的多态性。
1.5 PCR扩增
采用20 μL体系:PCR Buffer 2 μL,dNTP0.6 μL,Mg2+1.2 μL,Primer F 0.6 μL,Primer R 0.6 μL,TaqDNA聚合酶0.2 μL,模板DNA 2.0 μL,ddH2O 12.8 μL。
PCR反应程序: 94 ℃预热5 min;94 ℃变性45 s,退火45 s,72 ℃模板延伸45 s, 35个循环,72 ℃延伸10 min。利用6%聚丙烯酰胺凝胶电泳(PAGE)检测扩增产物,在120 V电压下电泳90 min,硝酸银染色,显色液及蒸馏水洗净,观察并统计条带,拍照保存图像。
1.6 数据统计与分析
统计17份半夏样品的聚丙烯酰胺凝胶电泳结果,在同一迁移位置上有条带的记作“1”,无条带的记作“0”,利用Excel表格建立1/0矩阵,利用PowerMarkerV3.25软件计算引物多态信息含量(polymorpism index contet,PIC)、多态性频率(frequency of polymorphism,FP)、等位基因数(allele number,AN)。利用POPGENE Version1.32、GenAIEX6.502软件对不同居群半夏的遗传多样性参数进行计算,包括Shannon信息指数(I)、有效等位基因数(effective allele number,Ne)、居群间基因流(interpopulation gene flow,Nm)、居群间遗传分化系数(coefficient of genetic differentiation between populations,Gst)。利用NTsys2.10软件中的UPGMA(非加权算术平均值聚类法)进行聚类分析,绘制亲缘关系树状图。
2 结果与分析
2.1 多态性SSR引物筛选
本试验从转录组数据中筛选得到266对引物,经PCR扩增、琼脂糖凝胶电泳检测,筛选出75对能成功扩增出目的片段大小且条带清晰明亮的引物。利用筛选得到的75对引物对17份半夏材料的DNA样品进行PCR扩增,产物经聚丙烯酰胺凝胶电泳检测,对结果进行多态性分析,筛选出19对多态性好的引物(表2),部分引物的聚丙烯酰胺凝胶电泳图见图1。

M为600 bp marker;A、B分别为引物Unigene23904和Unigene49309扩增产物凝胶电泳图;编号1~17为17个半夏居群DNA。M is 600 bp marker; A and B were primers Unigene23904 and Unigene49309 amplification products gel electrophoresis map,respectively.17 Pinellia ternata strains DNA were numbered 1-17.
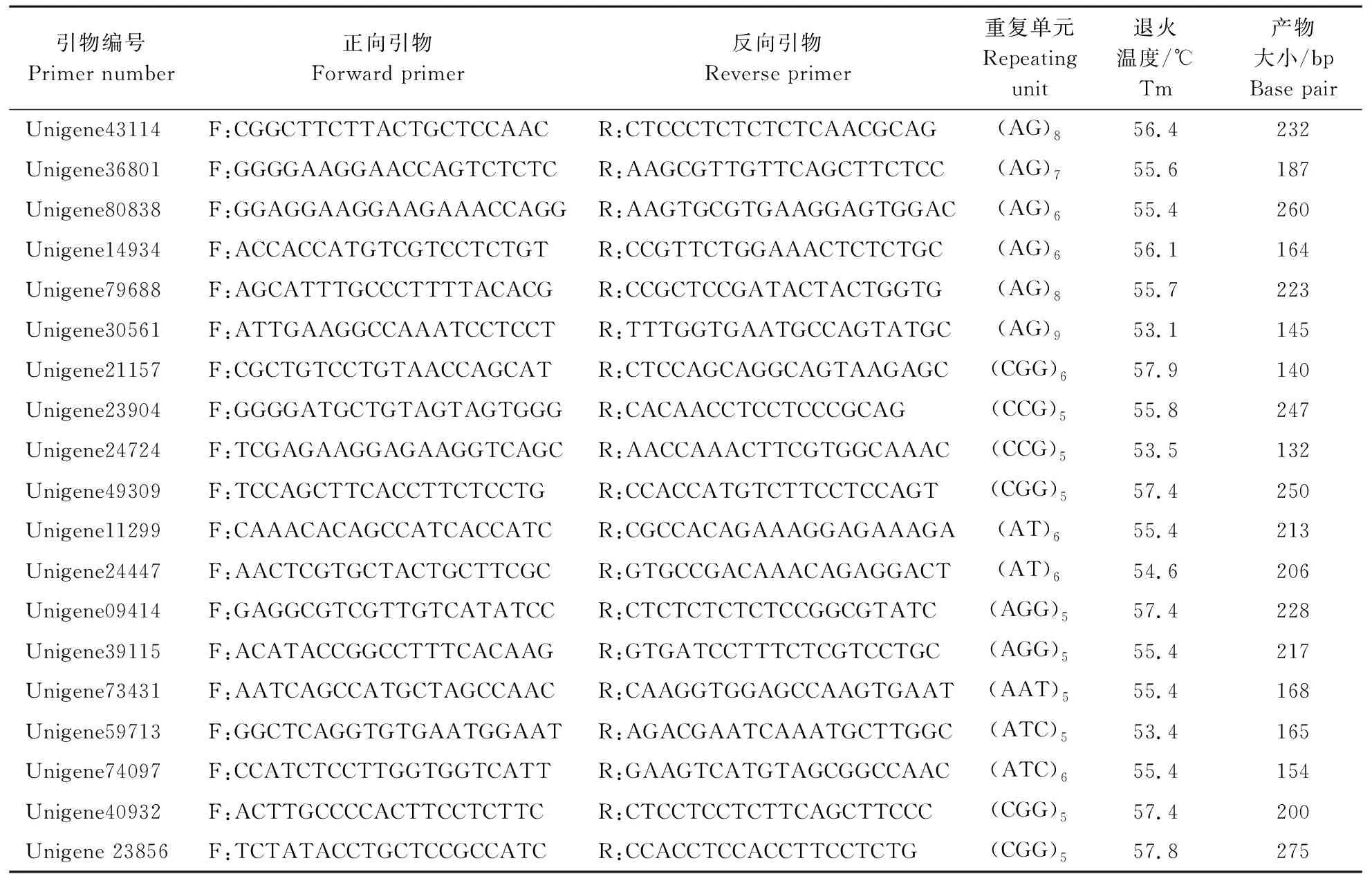
表2 19对SSR引物信息 Table 2 The information of 19 pairs of SSR primers
2.2 半夏遗传多样性分析
利用筛选出的19对多态性高的引物,进行遗传系数分析,由表3可知,19对SSR引物在17份半夏材料中共检测到多态性位点49个,平均每对引物有2.5个多态性位点;等位基因数(Ne)一共有76个,平均值为3.8;Nei基因多样性指数(He)范围为0.606~1.762,PIC范围为0.40~0.96,平均为0.60。多态性频率FP的变幅为0.44~0.85,平均值为0.64。结果表明筛选出的引物多态性高,所选半夏材料遗传多样性丰富。

表3 半夏居群遗传多样性 Table 3 Genetic diversity of P. ternata populations
根据遗传相似系数聚类分析结果将对应的SSR分子标记的带型结果导入GenAIEX6.502软件中,由分子方差分析(AMOVA)可知,88%的变异来源于个体间,12%的变异来源于群体间(P<0.001)(表4),这说明群体与群体间的差异相对较小,但群体内的遗传多样性水平较高,而遗传变异主要来源于个体间[18]。
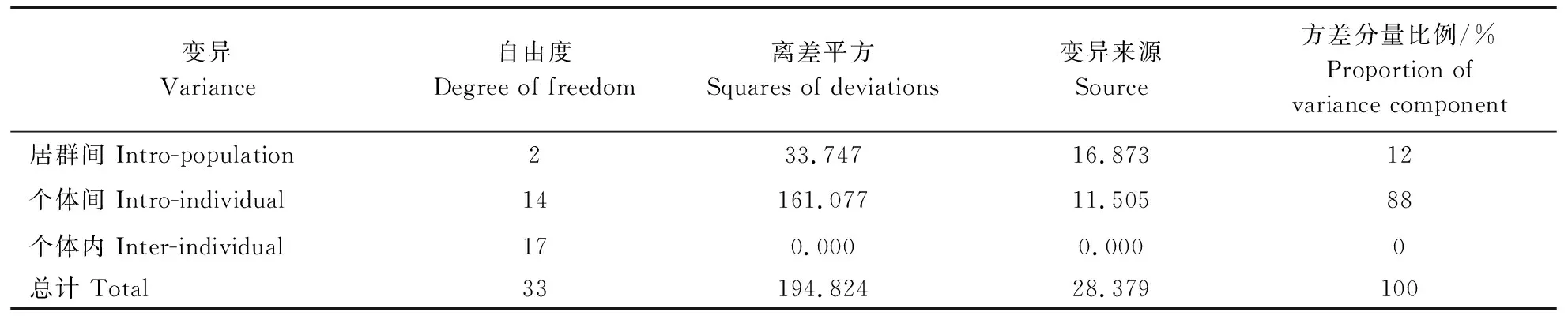
表4 半夏居群分子方差分析 Table 4 Analysis of molecular variance(AMOVA) in P. ternata populations
另外居群间平均分化系数Gst为0.124,小于0.15(Wright),说明居群间遗传分化较小。总的基因流估算值Nm为1.765,大于1(Wright),表明居群间能正常地进行基因交流,且居群间遗传分化受基因流的影响较大。
2.3 半夏群体聚类分析
将19对多态性高的引物的读带结果按0/1矩阵格式在Excel中排版,通过NTSYSpc 2.10软件中的Similarity计算遗传相似度。相似度结果(表5)表明,不同居群半夏的遗传相似度有差异,其中HNJS(湖南吉首)与HNSX(河南嵩县)的遗传相似度最高,为0.906。以遗传相似系数为标准,利用UPGMA法构建聚类图。由图2可知,17个半夏居群间遗传相似度为0.63~0.91,以遗传相似系数0.70为标准,将17个居群分成5个类群,其中1个类群较大,其他4个类群较小。各类群内又可做亚类群分类,从下至上分类情况如下:

图2 半夏遗传相似度聚类图Fig.2 Genetic similarity clustering map of P. ternata populations

表5 不同居群半夏遗传相似度 Table 5 Genetic similarity of different P. ternata populations
第1类为云南文山和湖北荆州,第2类和第3类分别为重庆万州和HTX1(选育材料),第4类为江苏盐城和江西(JXJX),第5类为湖北(HBWS)、HTX2(选育材料)、湖南常德、河南嵩县、湖南吉首、湖北荆州、安徽宿松、贵州凯里、湖北(HBLK)、HTX3(选育材料)、湖北天门聚成一大类。聚类分析结果表明,不同居群的半夏遗传结构不严格按照产地划分,表明不同居群半夏有较大的基因交流程度,具有较近的亲缘关系。
3 讨 论
本研究基于转录组数据,设计开发SSR引物,利用多态性SSR引物进行半夏遗传多样性分析,结果表明:所开发的19对SSR引物多态性高,能将17份半夏材料明确区分。通过分子方差分析(AMOVA)发现半夏的遗传变异主要来源于居群内。由遗传多样性分析可知,不同产地的半夏具有丰富的遗传多样性;由遗传距离与聚类结果可知,不同居群的半夏遗传结构非严格按照产地划分。
3.1 SSR引物多态性
Botstein等[19]认为PIC<0.25、0.25
3.2 半夏遗传多样性
利用19对多态性较高的SSR引物对17个半夏居群进行遗传多样性分析,结果显示每对引物的多态性位点平均为2.4个,多态性位点百分数平均为92.2%,等位基因数的平均值为3.8个,Nei基因多样性指数平均为1.03,表明本研究收集的17份半夏材料蕴含了比较丰富的遗传变化信息,显示了较高水平的基因多样性。而张君毅[22]采用SRAP分子标记方法对24个居群半夏进行遗传多样性分析,从中筛选出29对引物,共检测到286个位点,多态性位点百分数占48.3%;Nei’s基因多样性指数平均值为0.198,同样也证明了半夏居群存在丰富的遗传多样性。
研究遗传多样性有助于分析生物多样性的起源和进化,并为植物分类提供有益的资料,进而为植物育种和保护策略制定基础[23],因此,遗传育种的前提是做好天然居群及居群间遗传多样性和遗传变异的研究。郑丹书[24]对半夏居群间、居群内的分化程度进行分析,结果表明半夏居群内部存在较大变异,占67.18%;而居群间的变异程度较小,为32.82%;由POPGENE3.2计算得出Gst=0.411 2,Nm=0.715 9,结果也阐明了半夏居群大部分的变异(58.88%)存在于居群内部,而导致居群存在较高分化水平的主要原因可能是基因流。本研究发现半夏居群间分化系数Fst为0.124,说明居群间遗传分化较小。而通过分子方差分析(AMOVA)发现居群内的变异达到88%,也验证了半夏的遗传变异主要来源于居群内。而Nm值为1.765,表明居群间能正常地进行基因交流,且居群间遗传分化受基因流的影响较大。由遗传多样性分析可知,不同居群的半夏具有丰富的遗传多样性;根据聚类结果分析可知,不同居群的半夏遗传结构不严格按照产地划分,表明不同居群半夏有较大的基因交流程度,具有较近的亲缘关系,造成这种现象的原因可能是:①由于栽培材料在长期的驯化过程中出现了遗传分化以及部分材料的来源混乱导致的[25];②也可能是因为人为的半夏引种栽培干扰较大,加之多地区品种遗传背景高度复杂,而半夏常以无性繁殖为主,且世代交替频繁,从而导致种质一致性差[26]。

