结肠腺癌APC2基因表达及预后的生物信息学分析*
胡明超,王强,吴嘉旭,俞文渊(南京医科大学附属江苏盛泽医院普外科&南京医科大学康达学院盛泽临床医学院,江苏苏州 215228)
截止目前为止,大肠癌(colorectal cancer, CRC)仍然维持着高发生率以及高死亡率[1]。血清癌胚抗原(carcinoembryonic antigen,CEA)和糖类抗原19-9(carbohydrate antigen19-9,CA19-9)是预测和评估大肠癌预后的常用生物学标志物[2]。然而,CEA和CA19-9作为诊断和监测大肠癌生物学标志物的敏感性和特异性仍然较低[3]。因此,寻找具有高度敏感性和特异性的生物学标志物,用于改善肿瘤的诊疗并进行预后评估仍然是目前研究的重点。腺瘤性结肠息肉病基因(adenomatous polyposis coli,APC)已在结肠癌、肝癌等多种恶性肿瘤中得到了广泛的研究[4-5]。APC2是其同源基因,位于染色体19p13.3上[6],并被证实在多种人类癌症进展中发挥重要作用,包括视网膜母细胞瘤(RB)肿瘤、淋巴细胞白血病和卵巢癌等[7-8]。然而,目前国内仍缺乏关于APC2基因与大肠癌的相关研究。本研究基于癌症基因图谱(The Cancer Genome Atlas, TCGA)数据库挖掘APC2基因在结肠癌中的表达及预后评估作用,以期为进一步阐明APC2基因在大肠癌发生、发展中的作用提供新的研究方向。
1 材料与方法
1.1数据来源 从TCGA公开数据库(https://cancergenome.nih.gov,访问日期:2021年3月8日)下载所有结肠腺癌(colon adenocarcinoma, COAD)癌组织和癌旁组织APC2mRNA的转录组表达数据以及相对应的每例患者的临床病理及预后资料[9-10],具体包括患者年龄、性别、肿瘤浸润深度分期(T)、淋巴结分期(N)、转移分期(M)、TNM分期和患者总生存期(overall survival, OS)。
1.2相关资料整理 下载的TCGA数据中包含APC2基因表达量的COAD癌组织455例以及癌旁组织41例,对其进行正态性检验并分析二者之间是否存在表达差异。以肿瘤组织中APC2基因表达量的中位数(0.79)为截断值,分为APC2基因表达组(228例)和低表达组(227例),以此分别评估APC2基因的表达情况在COAD中的预后价值。
1.3蛋白质相互作用网络构建 利用String在线工具(https://string-db.org/)进行APC2基因编码蛋白质的相互作用网络(protein-protein interaction, PPI)分析,并设定组织来源为”Homo sapiens”,然后进行PPI网络构建。

2 结果
2.1APC2基因在COAD癌组织以及癌旁组织中的差异表达 TCGA数据库中下载的455例COAD患者癌组织APC2基因的表达量(0.87±0.42)显著低于41例癌旁组织(1.11±0.22),差异有统计学意义(t=3.58,P<0.05)。此外,从公共网络数据库GEPIA (Gene Expression Profiling Interactive Analysis, http://gepia.cancer-pku.cn)下载APC2基因在COAD中表达量的箱式图,证实APC2基因在COAD癌组织中的表达量低于癌旁组织,见图1。
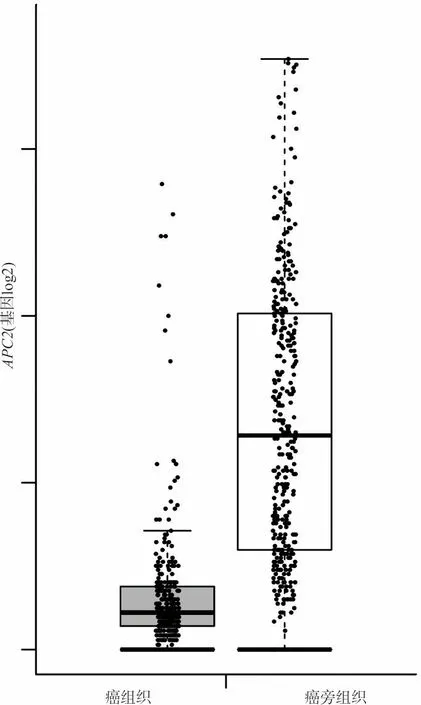
图1 APC2基因在COAD癌组织和癌旁组织中表达量的箱式图
2.2APC2基因对COAD的诊断价值 以APC2基因在TCGA数据库中COAD癌组织和癌旁组织中的表达量绘制ROC曲线,结果发现APC2基因对COAD具有良好的诊断价值(AUCROC=0.739 1,95%CI:0.685 5~0.792 6,P<0.000 1),见图2。

图2 APC2基因对COAD的ROC曲线分析结果
2.3APC2基因表达与COAD患者临床病理参数的相关性 对下载的455例COAD患者的TCGA数据集内容进行整合与统计学分析,结果证实APC2基因低表达的COAD患者具有更少数量的淋巴转移,更优的TNM分期以及更高的生存率(P<0.05),而APC2基因的表达量与患者的性别、年龄、肿瘤侵犯深度、远处转移均无关,见表1。

表1 APC2基因表达与COAD患者临床病理参数的关系[n(%)]
2.4APC2基因表达与COAD患者预后的关系 将TCGA数据库中455例COAD患者的APC2基因表达情况及生存情况汇总,其中1例高表达患者的部分数据缺失,排除该病例后最终纳入277例高表达的患者以及277例低表达的患者。如图3所示,APC2基因的表达和COAD患者的总体生存率密切相关,APC2低表达患者的生存时间中位数明显高于APC2高表达者(9.76年 vs 5.15年,log-rankP=0.005)。

图3 APC2的表达和COAD患者总生存期的关系
2.5APC2相关蛋白的相互作用(protein-protein interaction, PPI)网络 利用String在线分析分析得到与APC2基因编码相应蛋白质相互作用的蛋白质网络,如图4所示,其中PPI富集P<10-16,节点数为12个,在蛋白质网络中与APC2相互作用的细胞分裂周期基因16(cell division cycle gene,CDC16)、细胞分裂周期基因23(cell division cycle gene,CDC23)、细胞分裂周期基因27(cell division cycle gene,CDC27)、后期启动复合体亚基15(anaphase promoting complex subunit,ANAPC15),主要参与生物学过程中的有丝分裂调节,蛋白质连接的泛素化,蛋白质复合物依赖的分解代谢等过程,见表2。

图4 APC2相关蛋白质的相互作用网络

表2 与APC2表达相关的生物过程功能富集
3 讨论
随着肿瘤分子生物学的发展,CRC的靶向治疗也进入了快速发展的阶段,通过对代谢组学、蛋白质组学、转录组学等技术获得肿瘤组织中的异常表达,并进一步以此为依据开发具有特异性的靶向药物对CRC的治疗具有重要意义。在本研究中,总共纳入TCGA数据库中455例COAD患者肿瘤组织APC2基因的表达情况以及对应的临床病理资料,首先笔者团队对APC2基因在COAD组织中的差异化表达进行了分析,发现APC2基因在COAD组织中的表达量相对正常组织呈现下调的状态,而后使用GEPIA数据库进行检索也得到了同样的结果,表明APC2基因低表达促进了结肠癌的发生。同样,Xu等[11]的研究结果证实,抑制APC2基因的表达可以抑制肺癌细胞的增殖;Wu等[12]在骨肉瘤的研究中发现,对APC2基因进行过表达可以抑制肿瘤细胞的增殖和迁移能力。上述研究结果与本研究结果均证实了APC2基因的肿瘤抑制作用。笔者又根据APC2在COAD癌组织以及癌旁组织中的表达量绘制ROC曲线,结果证实,APC2基因用于区分肿瘤组织和癌旁组织具有较高的诊断价值。此外,在APC2基因表达与COAD患者临床病理参数以及预后分析中发现,低表达APC2基因的COAD患者淋巴转移数量更少,TNM分期较早以及生存时间更长,这一发现与Sun等[13]的临床研究结果刚好相反,其研究证实,APC2作为抑癌基因在结肠癌组织中高表达时,患者具有更好的预后。存在相悖结论的原因可能为Sun等[13]开展的为单中心研究,纳入的患者数量有限。此外,本研究还发现在PPI网络中CDC16、CDC23、CDC27、ANAPC15均与APC2蛋白发生相互作用,分析原因其可能通过有丝分裂调节,蛋白质连接的泛素化,蛋白质复合物依赖的分解代谢等生物学过程进而影响结肠癌的发生和发展,但具体机制仍待进一步深入研究后阐明。
本研究的不足之处在于数据仅来源于TCGA数据库中的COAD患者的RNA-Seq数据,并且部分患者的临床信息存在少量缺失,在一定程度上影响最终的统计学结果。在今后研究中我们将对APC2基因进行更深入的研究,并且同时进行体内和体外实验的验证,力求纳入更多的临床样本进行多方验证,并且进一步探索APC2基因促进COAD发生和发展机制,从而为结肠癌的诊断和靶向治疗提供具有高敏感性的生物学标志物。

