VISTA在胃癌组织中的表达及其临床意义*
黄莉莉,李勇,詹升华,曹磊, 吕心路(. 苏州大学附属儿童医院检验科,江苏苏州5003; . 太仓市第一人民医院检验科,江苏苏州5400; 3. 苏州大学附属第一医院 a.病理科,b.临床免疫研究所,江苏苏州5006)
胃癌是一种常见的恶性肿瘤,死亡率位居所有肿瘤的第二位[1]。效应T细胞的失活是肿瘤免疫逃逸的重要机制之一。研究发现,细胞毒T淋巴细胞相关抗原4(cytotoxic T lymphocyte associate protein-4,CTLA-4)、程序性死亡受体1(programmed cell death protein 1,PD-1)、V结构域Ig抑制因子(V-domain immunoglobulin suppressor of T cell activation,VISTA)等负性免疫检查点可抑制T细胞活性,削弱T细胞抗肿瘤免疫能力。目前,CTLA-4、PD-1抑制剂已用于临床肿瘤治疗,但仅对部分患者有效。负性共刺激分子VISTA与PD-L1具有同源性,但可通过不同的信号通路抑制T细胞活性,具有作为肿瘤免疫抑制剂的潜力[2-3]。研究证实,在非小细胞肺癌、卵巢癌、乳腺癌等肿瘤组织中VISTA呈高表达的肿瘤患者的预后较好[4]。目前,国内关于VISTA在胃癌患者中的研究报道少见,本研究旨在探讨VISTA在胃癌患者组织中的表达以及与IFN-γ的相关性,并分析二者与患者临床病理参数及预后的关系,以期发掘VISTA在胃肠道肿瘤治疗中的临床价值。
1 材料与方法
1.1标本采集 组织标本采集:收集2011年1月至2012年12月于苏州大学附属第一医院普外科进行胃癌切除手术且病理资料完整的268例胃癌患者的癌组织和癌旁组织(距离癌组织>5 cm),经石蜡包埋后用于制作肿瘤组织芯片。其中女58例,男210例,年龄(64.5±10.8)岁。患者临床病理资料包括:性别、年龄、肿瘤大小、分化程度、肿瘤浸润深度、肿瘤分期、是否有淋巴结转移或远处转移等。所有患者进行随访至2019年1月,共计198例患者的生存信息(失访70例)。另收集2020年1月至12月于苏州大学附属第一医院行胃癌切除手术的患者新鲜胃癌组织20例[女6例,男14例,年龄(60.5±11.4)岁]以及胃镜摘取的浅表性胃炎组织20例[女4例,男16例,年龄(52.8±9.6)岁],均置于液氮中保存。所有患者术前均未接受放、化疗治疗。且均经临床及病理组织学确诊。血液标本采集:采集各患者清晨空腹外周静脉血5 mL,3 000 r/min离心10 min,收集上层血清并进行分装,置于-80 ℃超低温冰箱保存。本研究经过苏州大学附属第一医院医学伦理委员会批准(批准文号:2018181),患者及家属知情同意。
1.2主要仪器与试剂 荧光定量 PCR(qRT-PCR)检测仪(美国Bio-Rad公司),Dmetrix imaging system切片扫描仪(美国Tucson公司)。Trizol试剂(美国Invitrogen公司),逆转录试剂盒(大连宝生物公司),荧光定量PCR检测试剂(SYBR Premix Ex Taq Ⅱ kit,大连宝生物公司),兔抗人VISTA多克隆抗体、兔抗人PanCK 多克隆抗体(美国Abcam公司),兔抗人IFN-γ多克隆抗体(美国Santa Cruz公司),小鼠抗人CD8、CD68、CD31、α-SMA即用型单克隆抗体(北京中杉金桥公司),HRP标记的鼠兔通用即用型IgG二抗(上海基因公司),IFN-γ ELISA检测试剂盒(上海联科生物公司)。
1.3组织芯片(TMA)的制作与获取 取上述268例胃癌患者的组织蜡块,经1位经验丰富的病理医生进行肿瘤组织和间质组织的选点后自制组织芯片。选择组织核心(1 mm×1 mm)置于在模块中进行包装,形成1个包含134个组织核心的芯片,对该芯片重新进行石蜡包埋并切割成4 μm的切片进行后续研究。
1.4免疫组化染色 将包埋制作好的组织芯片蜡块切成3~5 μm 薄片,黏附至防脱片;65 ℃烘片1 h,置于二甲苯中浸泡10 min,重复1 次;经无水乙醇清洗10 min,重复1次,经90%、80%、70%梯度乙醇清洗,ddH2O 洗涤5 min;加入柠檬酸缓冲液(pH 6.0)1 L置于高压锅煮沸,玻片置入高压锅煮沸3 min,自然冷却;ddH2O洗涤3次,每次5 min;室温下3% H2O2溶液浸泡15 min;PBS冲洗3次,每次5 min;加入1.5% BSA封闭液湿盒内37 ℃封闭1 h;PBS冲洗3次,每次5 min;加相应的一抗(其中兔抗人VISTA多克隆抗体,小鼠抗人CD8、CD68、CD31、α-SMA即用型单克隆抗体,兔抗人IFN-γ多克隆抗体均为1∶100稀释;兔抗人PanCK 多克隆抗体1∶50稀释),湿盒内4 ℃过夜; PBS冲洗3次,每次5 min;加入HRP标记的鼠兔通用即用型IgG二抗(1∶100稀释),室温温育1 h;PBS冲洗3次,每次5 min;DAB染液显色;ddH2O 漂洗5 min,苏木精复染后自来水冲洗玻片;65 ℃烤箱烘干,中性树胶封固。以鼠IgG和兔IgG作为阴性对照,扁桃体组织作为免疫细胞标志的阳性对照组织。由2位病理医生采用双盲法独立评估患者切片染色情况。免疫组化评分由染色强度和阳性细胞百分比综合评价而成。染色强度评分标准:0分,无染色;1分,比背景略黄;2分,黄褐色;3分,棕色。阳性细胞评分标准:0分,0%~5%;1分,6%~25%;2分,26%~50%;3分,51%~75%;4分,>75%。免疫组化总分计算公式:阳性细胞评分×染色强度评分。最终免疫组化评分得分在0~12分之间,并分为4个等级:0分为阴性(-);1~5分为弱阳性(+);6~8分为阳性(++);9~12分为强阳性(+++)。根据免疫组化染色评分结果将患者分为高、低表达组,其中6分以下为低表达组,6分及以上为高表达组。
1.5RNA提取及qRT-PCR检测 取上述20例置于液氮冻存的胃癌切除手术的癌组织和癌旁组织以及20例胃炎组织,经研磨后,用Trizol法提取各组织RNA,NanoDrop 2000 超微量分光光度计检测RNA的浓度和纯度,取吸光度(A260 nm/A280 nm)值为1.8~2.0的样本。按逆转录试剂盒说明书RNA逆转录为cDNA,样本置于-20 ℃保存。根据GenBank中VISTA基因以及内参β-actin基因(序列号分别为:NM_022153.2,NM_001101) 序列,采用Primer Premier 5.0软件设计引物,并送苏州金唯智生物技术公司合成。VISTA上游引物序列:5′-ACG
CCGTATTCCCTGTATGTC-3′,下游引物序列:5′-TT
GTAGAAGGTCACATCGTGC-3′, 退火温度60 ℃,产物片段大小101 bp。β-actin上游引物序列:5′-CAT
GTACGTTGCTATCCAGGC-3′,下游引物序列:5′-CT
CCTTAATGTCACGCACGAT-3′, 退火温度60 ℃,产物片段大小250 bp。荧光定量PCR反应体系为20 μL,包括ddH2O 7 μL,2×PCR mixture 10 μL,10 μmol/L上、下游引物各0.5 μL,cDNA 2 μL。循环参数:95 ℃ 5 min;95 ℃ 15 s,60 ℃ 1 min,共40个循环。于60 ℃时采集荧光信号,并用荧光定量 PCR检测仪自带的分析软件进行熔解曲线分析。每个样本检测3个复孔。以β-actin作为内参基因进行校正后分析。VISTA基因的表达水平采用相对定量法(2-△Ct)计算,公式:△Ct=CtVISTA-Ctβ-actin。
1.6ELISA法检测 收集上述各研究对象的血清标本,采用双抗体夹心法,按照IFN-γ ELISA检测试剂盒说明书进行检测。依据标准品的浓度和对应的吸光度(A)值绘制标准曲线,计算IFN-γ的浓度。IFN-γ参考范围:10~400 ng/L。

2 结果
2.1胃癌患者癌组织中VISTA的定位及表达 胃癌组织芯片的免疫组化染色结果表明,268例胃癌患者中VISTA呈高表达者94例(35.1%),VISTA呈低表达者174例(64.9%),二者差异具有统计学意义(χ2=11.235,P<0.001)。VISTA在胃癌癌巢组织和癌周组织中均有表达,VISTA在肿瘤浸润免疫细胞(122/268,45.5%)和间质细胞(148/268,55.2%)中呈高表达,而在肿瘤细胞中的表达水平较低(14/268,5.2%)。见图1。

注:VISTA在浸润免疫细胞(CD8、CD11c阳性)、间质细胞(CD31、α-SMA阳性)以及肿瘤细胞(PanCK阳性)中的共表达情况。
2.2VISTA在胃癌、癌旁以及胃炎组织中的表达差异 qRT-PCR法结果表明,VISTAmRNA在胃癌组织、癌旁组织以及胃炎组织中的相对表达量分别为1.000±0.198、1.313±0.175以及0.771±0.132,3组间差异有统计学意义(F=2.533,P=0.089 2)。组间两两比较结果表明,与癌旁组织相比,胃癌组织中的VISTAmRNA的表达水平稍低,但差异无统计学意义(t=1.176,P=0.246 8);与胃炎组织相比,胃癌组织中VISTAmRNA的表达水平较高,但差异无统计学意义(t=0.958 5,P=0.343 9);与胃炎组织相比,癌旁组织中的VISTAmRNA的表达水平明显升高,差异有统计学意义(t=2.469,P=0.018 2)。免疫组化染色结果显示,VISTA在癌巢、癌周以及胃炎组织细胞膜上表达,VISTA在癌巢、癌周以及胃炎组织的表达评分分别为1.424±0.386、1.409±0.426以及0.887±0.313分。癌巢、癌周组织中VISTA的表达均显著高于胃炎组织(t=2.377,P=0.022 4;t=2.256,P=0.029 1)。
2.3VISTA与IFN-γ表达水平的相关性 免疫组化染色结果显示,IFN-γ在组织间质细胞区域散在或成簇表达,主要定位于细胞浆,268例胃癌组织中VISTA与IFN-γ的表达水平呈显著正相关(r=0.295,P=0.000)。同时,采用ELISA法分析20例胃癌及20例胃炎患者血清中IFN-γ表达情况,发现胃癌患者血清IFN-γ水平为37.604±12.601 pg/L,胃炎患者血清IFN-γ水平为47.020±15.466 pg/L,2组间的差异有统计学意义(t=0.211 1,P=0.041 4)。患者血清IFN-γ与VISTAmRNA的表达水平呈正相关(r=0.449 6,P=0.003 6)。
2.4VISTA表达与胃癌患者临床病理参数的相关性 VISTA的表达水平与患者年龄、肿瘤大小、分化程度、浸润深度、是否远处转移及是否死亡之间无显著的相关性,而与患者性别、肿瘤分期以及是否淋巴结转移之间存在显著相关性(表1)。
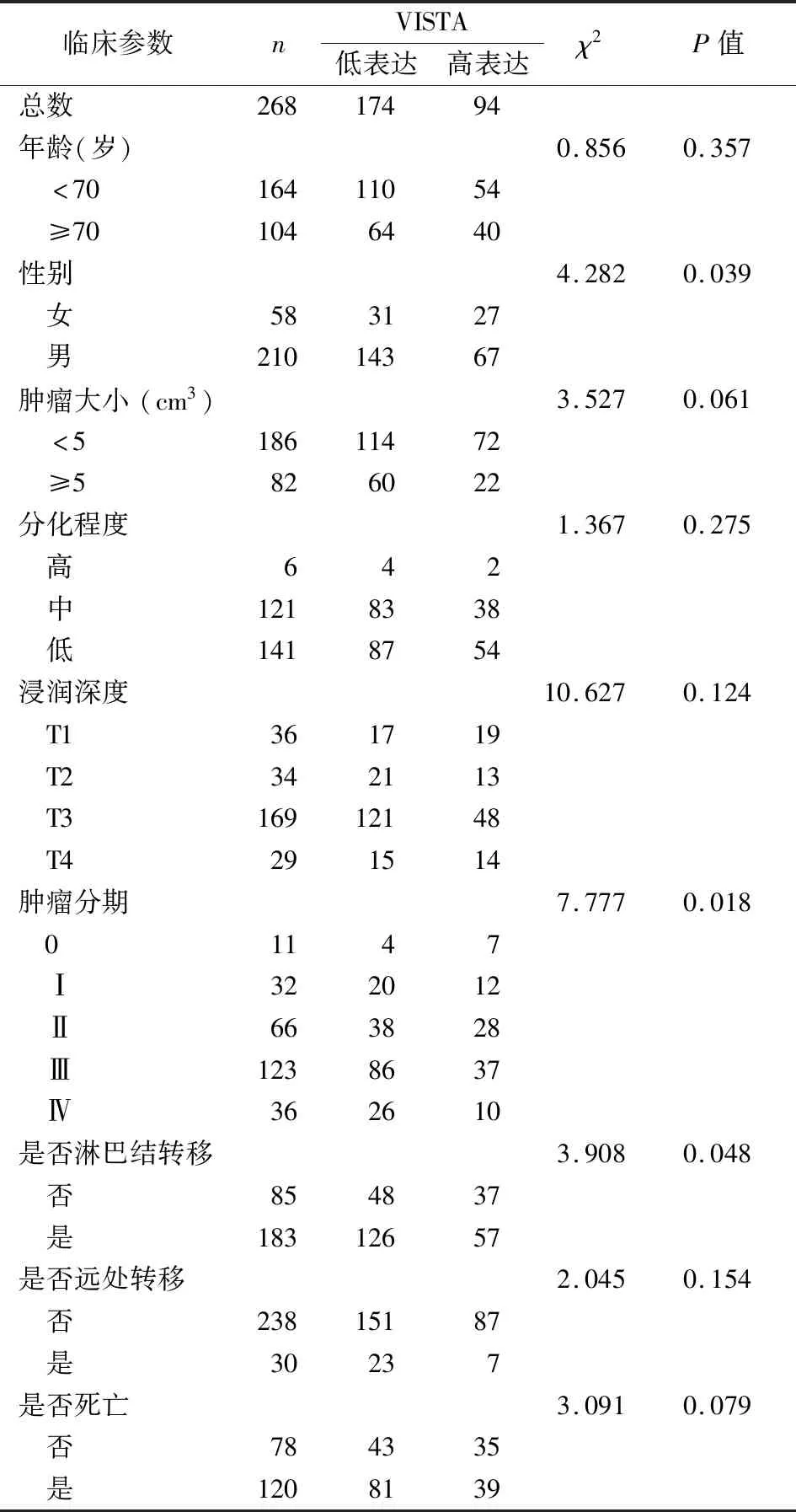
表1 VISTA表达与胃癌患者临床病理参数间的相关性
2.5VISTA表达与胃癌患者预后关系 198例有回访资料的胃癌患者生存时间为4~72(中位数44)个月。胃癌组织中VISTA高表达患者的中位生存期为61个月,低表达患者的中位生存期为41个月,经Log-Rank检验分析,2组生存率之间的差异无统计学意义(χ2=3.413,P=0.065,图2)。
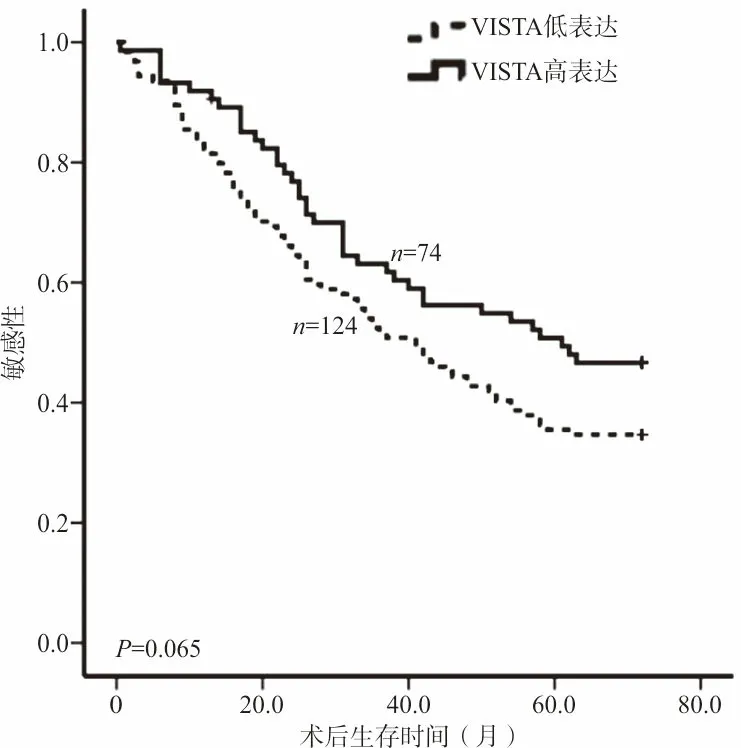
图2 VISTA高、低表达组的总生存率比较
2.6影响胃癌患者总生存率的危险因素分析 单因素分析表明,VISTA表达量、肿瘤大小、浸润深度、肿瘤分期、是否发生淋巴结转移及是否发生远处转移是影响胃癌患者总生存率的危险因素。多因素分析结果显示,除肿瘤分期外,VISTA表达、肿瘤大小、肿瘤浸润深度、是否发生淋巴结转移和是否发生远处转移均不是影响胃癌患者总生存率的独立危险因素(表2)。
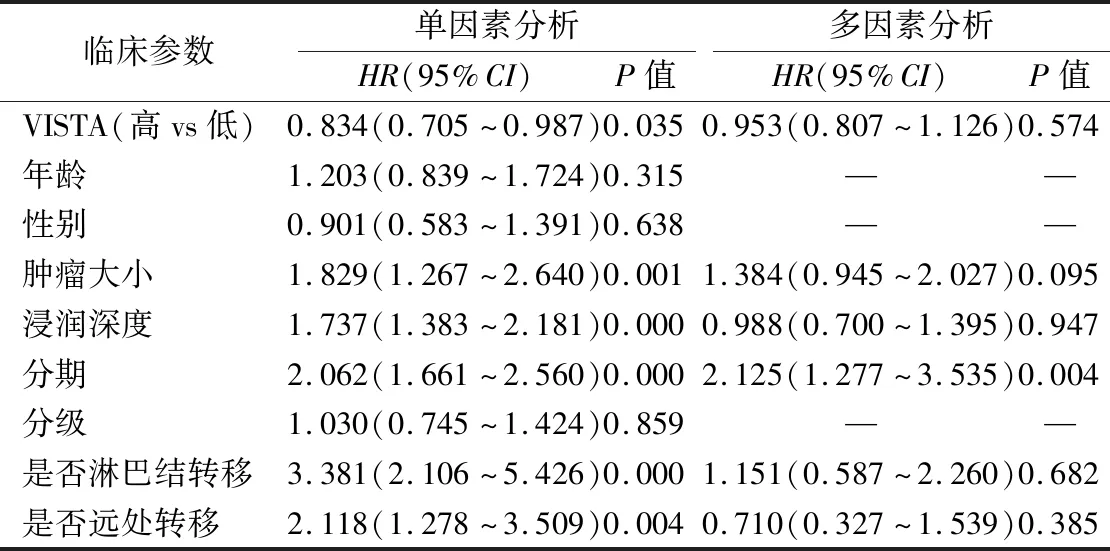
表2 与生存率相关的风险因素的单变量和多变量Cox回归分析
3 讨论
近年来随着肿瘤免疫和肿瘤微环境研究的不断深入,肿瘤免疫调控分子——免疫检查点成为肿瘤免疫干预的重要靶点,针对PD-1/PD-L1的多种单抗在临床抗肿瘤应用中显示出卓越的疗效,使得负性B7 家族免疫检查点分子在肿瘤免疫治疗中的前景受到空前关注。VISTA是一种新的免疫检查点分子,主要表达于髓样细胞、淋巴细胞和肿瘤细胞,参与抗肿瘤免疫调节[5-6]。本研究利用胃癌组织芯片检测发现VISTA主要表达于免疫细胞及间质细胞,较少表达于肿瘤细胞(5.2%),这与黑色素瘤、胃癌、前列腺癌、急性髓系白血病等疾病中的研究结果较为一致[5-8]。由于炎症组织和多种肿瘤组织均可上调VISTA的表达[9-10]。为进一步探索VISTA在胃癌诊断中的价值,本研究比较了胃炎与胃癌组织中VISTA的表达,结果显示VISTAmRNA水平和免疫组化评分不完全一致,推测原因可能是mRNA反映的是整个组织的总体表达,而免疫组化染色则是反映定位到组织中特定细胞的表达。VISTA在癌组织与炎症组织中的差异表达提示VISTA具有成为胃癌与胃炎鉴别诊断指标的潜能。IFN-γ主要产生于活化的 T 细胞,在 NK 细胞和 NKT 细胞中也可少量分泌,其表达水平反映了机体免疫细胞活化程度[11-12]。为了分析VISTA表达与肿瘤微环境中浸润免疫细胞活化程度的相关性,笔者比较了胃癌患者血清及肿瘤组织中VISTA与IFN-γ表达水平的相关性。在本研究中,VISTA的蛋白质水平和mRNA水平与IFN-γ的表达均呈显著正相关(P<0.05),提示VISTA的表达与肿瘤浸润的细胞毒性T细胞活性相关,这与Zhang等[13]的研究一致。据此推测,表达VISTA的外源性免疫细胞可能被动员至胃癌组织中参与肿瘤免疫进程。
肿瘤微环境中免疫细胞浸润及活化程度是影响患者生存率极为重要的因素。本研究中198例胃癌患者的随访资料显示,VISTA高表达患者的总体生存率(中位生存期为61个月)显著高于低表达患者(中位生存期为41个月),且高表达患者分期更低,淋巴结转移更少,这与近年发表的一项meta分析结果以及胰腺癌的研究结果类似[7,14]。提示VISTA表达阳性的免疫细胞能够提升患者的生存能力。此外,单因素分析结果表明,VISTA低表达(P=0.035)是影响胃癌总生存率的危险因素,但VISTA表达水平的高低与胃癌患者的预后无显著相关性。以上结果提示VISTA低表达可作为胃癌患者风险因素的预后标志物,但可能需要联合肿瘤微环境中的其他指标进行综合分析才能更好地预测患者预后。
本研究分析了VISTA在胃癌患者组织中的表达情况,为VISTA应用于胃癌的临床诊疗提供了新的研究思路。本研究的不足之处在于没有进一步分析肿瘤微环境细胞的表达与VISTA表达之间的相关性,从而综合评估VISTA与免疫微环境的相互作用。

