原位光化学衍生快速检测黄曲霉毒素荧光强度
(广东省科学院广东省分析测试研究所(中国广州分析测试中心),广东省食品营养与安全快速检测仪器工程技术研究中心,广东 广州 510070)
黄曲霉毒素(aflatoxins,AF)可以由曲霉菌黄曲霉、寄生曲霉、集峰曲霉和伪溜曲霉4种真菌产生,其基本结构是二呋喃环和香豆素。黄曲霉毒素广泛存在于自然界中,目前已确定结构的黄曲霉毒素达20余种,主要分为B族、G族及衍生物[1]。食品和中药材在采集、加工、运输和贮藏过程中如保存不当极易发生霉变,造成黄曲霉毒素污染。其中黄曲霉毒素B1(aflatoxins B1,AFB1)、黄曲霉毒素B2(aflatoxins B2,AFB2)、黄曲霉毒素G1(aflatoxins G1,AFG1)、黄曲霉毒素G2(aflatoxins G2,AFG2)较为常见[2-3]。1993 年国际癌症研究机构将AF确定为Ⅰ类致癌物[4]。AF对人体健康具有急性、慢性、致癌、免疫抑制等多种毒性危害作用。自然条件下产生的 AFB1、AFB2、AFG1、AFG24 种毒素残留对人体的毒性往往具有协同和加和效应,黄曲霉毒素总量(total aflatoxins,TAFs)检测已成为当前食品质量安全检测领域发展的必然趋势[5]。目前,我国只对食品中的黄曲霉毒素B1规定了限量要求,其中特殊膳食用食品限量0.5 mg/kg,其它食品限量 5 mg/kg~20 mg/kg[6]。而2020《中国药典》对莲子、薏苡仁等中药材中黄曲霉毒素的限量规定为“每1 000 g含AFB1不得过5 mg,AFG2、AFG1、AFB2和 AFB1的总量不得超过 10 mg”[7]。
黄曲霉毒素具有荧光特性,在365 nm波长紫外光激发下,B族黄曲霉毒素发射波长为425 nm蓝色荧光,G族黄曲霉毒素为450 nm黄绿色荧光[8-9],这也是检测黄曲霉毒素的基本原理之一。根据其荧光特性,主要的检测方法包括薄层色谱法[10-11]、微柱筛选法[12]、荧光分光光度法[13-14]、高效液相色谱法[10]。荧光分光光度法/高效液相色谱法的灵敏度比薄层色谱法和微柱筛选法高,但是需要大型精密仪器,成本高,时间长,对检测人员专业性要求高,难以满足现场快速检测需求。而黄曲霉毒素的荧光特性受溶剂的影响很大,容易发生荧光淬灭,荧光值减弱,因此需要进行衍生增强其荧光强度。目前常用的衍生方法包括:三氟乙酸(trifluoroacetic acid,TFA)衍生、碘衍生、溴衍生、光化学衍生、电化学衍生等[15]。其中光化学衍生具有操作简单,重复性好、灵敏度高、衍生过程不引入化学试剂污染等优势。朱鹏飞等[16]、蒋孟圆等[17]、赵磊等[18]利用光化学衍生进行样品前处理后测定其中黄曲霉毒素,结果均准确稳定,基线平稳,具有较高的性价比。本文以光化学衍生的方法增强黄曲霉毒素荧光强度,并优化有机溶剂种类(乙腈、80%乙腈、甲醇和70%甲醇)和光化学衍生时间,利用黄曲霉毒素原位衍生荧光检测仪实现操作简易、成本低廉的黄曲霉毒素快速检测。
1 材料与方法
1.1 材料与试剂
黄曲霉毒素B1标准品(≥99%)、黄曲霉毒素B2标准品(≥99%)、黄曲霉毒素G1标准品(≥99%)、黄曲霉毒素G2标准品(≥99%):青岛普瑞邦生物工程有限公司;甲醇(分析纯)、乙腈(分析纯):广州化学试剂厂。
1.2 仪器与设备
黄曲霉毒素原位衍生荧光检测仪(以下简称原位衍生荧光检测仪):中国广州分析测试中心自制(专利号:CN202010573958.5);吸收和三维荧光扫描光谱仪(AqualogR):日本 HOR IBA 公司;离心机(TD5G):上海卢湘离心机仪器公司;BT分析天平(BT25S):北京赛多利斯科学仪器公司;石英比色皿(10 mm):宜兴市晶科光学仪器有限公司。
1.3 标准溶液配制
标准储备溶液(10 μg/mL):分别精确称取 AFB1、AFB2、AFG1、AFG2标准品各 1 mg,用乙腈溶解并定容至100 mL,在-20℃下避光保存,备用。
标准工作溶液(100 ng/mL):分别准确移取标准储备溶液(1.0 μg/mL)1.0 mL 至 100 mL 容量瓶中,用有机溶剂定容。此溶液密封后避光-20℃下保存,3个月内有效。
标准系列工作溶液:准确移取黄曲霉毒素标准工作液(100 ng/mL)0.025、0.125、0.50、1.25、2.50、5.00 mL于25 mL容量瓶中,用70%甲醇溶液定容至刻度,配制 浓度点为 0.10、0.50、2.00、5.00、10.00、20.00 ng/mL的黄曲霉毒素系列标准溶液。
1.4 方法
1.4.1 仪器工作条件
原位衍生荧光检测仪:激发波长365 nm,电压3.10 V,门控 10 ms,测试时间 10 s。
荧光扫描光谱仪:激发波长365nm,增量3.54 nm。
1.4.2 原位衍生荧光检测仪原理
原位衍生荧光检测仪包括检测室、激发光源、荧光检测器和光化学衍生模块[19],如图1所示。
检测室上设有发射荧光的单色器和单光子计数器探头,样品放入检测室后经光化学衍生模块进行原位光化学衍生,增强黄曲霉毒素的荧光效应,提高检测灵敏度。再由激发光源提供365 nm波长紫外光激发样品后产生发射荧光,发射荧光经单色器截止背景散射光后产生400 nm~500 nm波段荧光,经单光子计数器探头检测并输入电信号至荧光检测器进行检测。
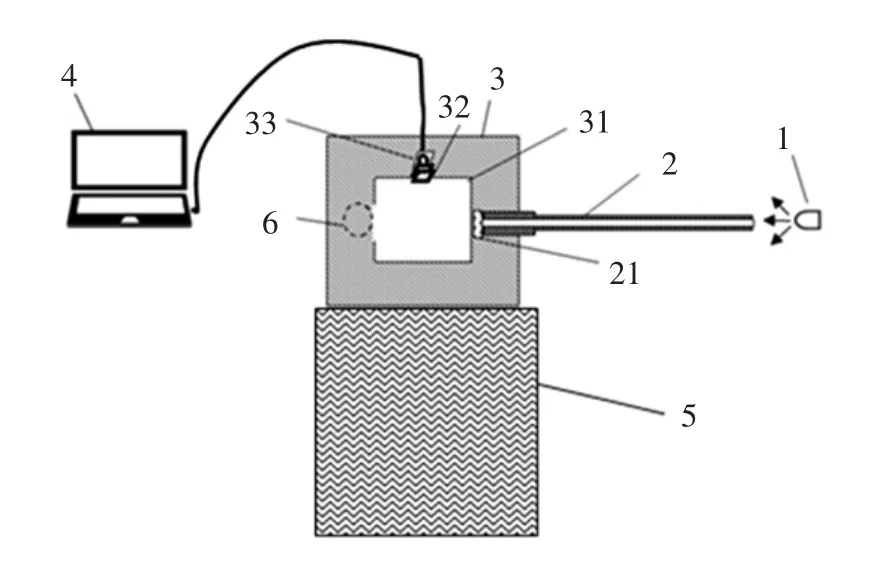
图1 原位衍生荧光检测仪的原理示意图Fig.1 Schematic diagram of insitu derivatization fluorescence detector
1.4.3 不同溶剂对黄曲霉毒素荧光增强的影响
分别用4种有机溶剂:乙腈、80%乙腈溶液、甲醇、70%甲醇溶液按照 1.3.2的方法配制 AFB1、AFB2、AFG1、AFG2标准工作溶液(100 ng/mL),吸取 2.5 mL标准工作溶液于石英比色皿中,然后将石英比色皿放置原位衍生荧光检测仪中进行光化学衍生4 min后,再按1.4.1的工作条件测定荧光强度。
1.4.4 光化学衍生时间对AFB1和AFG1荧光强度的影响
吸取2.5 mL70%甲醇溶液配制的5、10、20 ng/mL的AFB1、AFG1标准溶液于石英比色皿中,使用原位衍生荧光检测仪分别按 0、1、2、3、4、5、6、7、10、15 min 进行光化学衍生,按1.4.1的工作条件测定荧光强度,并计算其光化学衍生前和后荧光强度的增加量(即荧光增量)。
1.4.5 黄曲霉毒素线性范围和检测限(limit of detection,LOD)
吸取2.5 mL黄曲霉毒素系列标准溶液,进行光化学衍生4 min后,按1.4.1的工作条件测定荧光强度。
方法检测限的计算公式如式(1)[20]所示。

式中:δ为测定空白值的偏差;S为标准曲线的斜率。
2 结果与分析
2.1 原位衍生荧光检测仪测定黄曲霉毒素的荧光增强效果
光化学衍生前后黄曲霉毒素荧光增强情况见表1。
由表1可知,光化学衍生前AFB1和AFG1的荧光值比AFB2和AFG2要弱,相差一个数量级。但是经过光化学衍生后,AFB1的荧光强度增强了约7.6倍,AFG1的荧光强度增强了约5.5倍,极大地提高了AFB1和AFG1荧光信号,分别与AFB2和AFG2处于同一数量级中。而AFB2和AFG2荧光信号较强,光化学衍生对其无增强作用,反而随着检测时间的延长荧光信号有所衰减,但前后差异不大。因此,使用光化学衍生的方法可以对黄曲霉毒素总量(AFB1、AFB2、AFG1、AFG2)的荧光强度进行整体提升,提高其检测灵敏度。
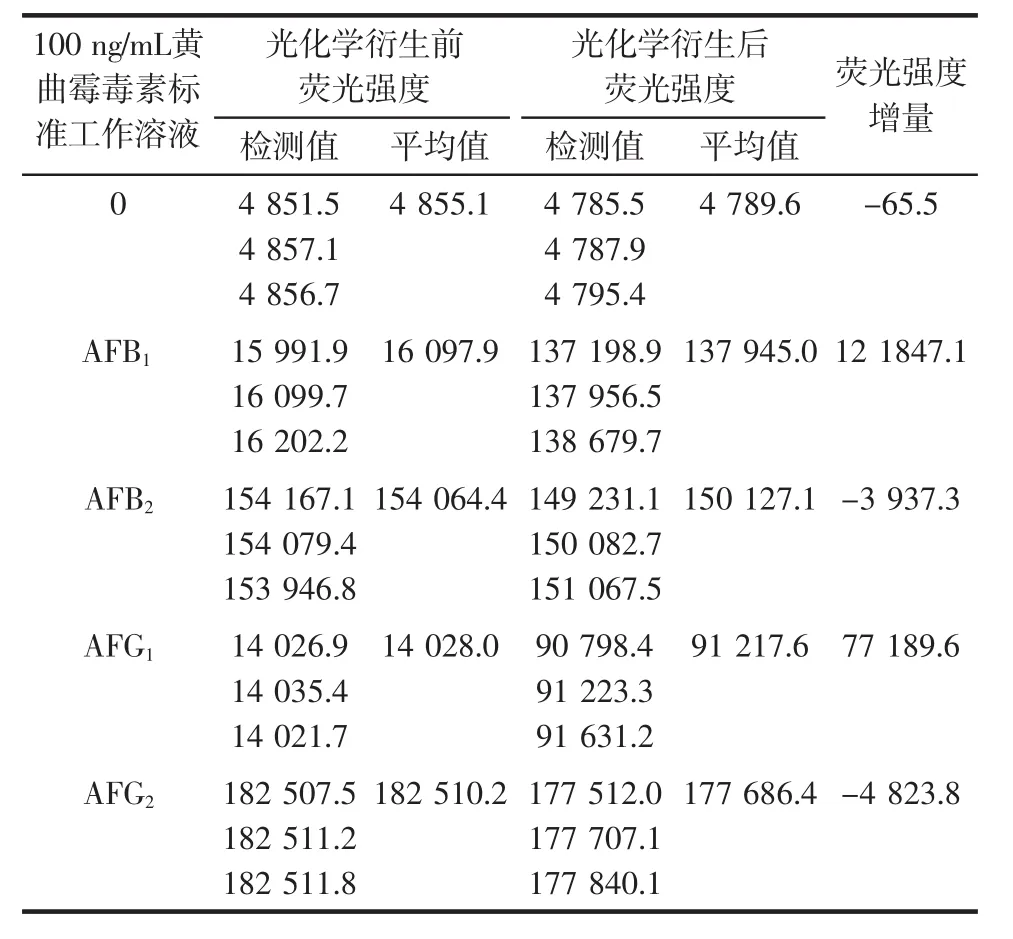
表1 光化学衍生前后黄曲霉毒素荧光增强情况Table 1 Fluorescence enhancement of aflatoxin before and after photochemical derivatization
原位衍生荧光检测仪测定的荧光信号如图2所示。
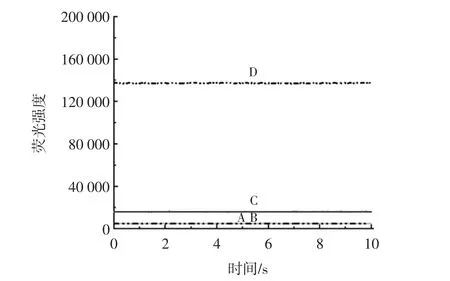
图2 原位衍生荧光检测仪测定黄曲霉毒素荧光信号图Fig.2 Determination of aflatoxin fluorescence signal by insitu derivatization fluorescence detector
黄曲霉毒素荧光信号强,基线平稳,且仪器检测时间为10 s。该仪器将光化学衍生模块与检测器集成,在仪器内对黄曲霉毒素进行原位光化学衍生,极大地简化了检测步骤,缩短了检测时间。
2.2 不同溶剂对黄曲霉毒素荧光增强的影响
原位衍生荧光检测仪测定黄曲霉毒素在不同溶剂中荧光强度如图3所示。

图3 原位衍生荧光检测仪测定黄曲霉毒素在不同溶剂中荧光强度Fig.3 Determination of fluorescence intensity of aflatoxin in different solvents by insitu derivatization fluorescence detector
结果表明:未衍生前AFB1在4种溶剂中荧光强度差异不大,经过光化学衍生后荧光强度在不同溶剂中依次递增:乙腈<80%乙腈<甲醇<70%甲醇溶剂,荧光增强效果显著;未衍生前AFB2在70%甲醇溶剂中荧光强度最大,但是经过光化学衍生后荧光强度都有微弱降低;未衍生前AFG1在乙腈中荧光强度最大,经过光化学衍生后80%乙腈<乙腈<甲醇<70%甲醇溶剂;未衍生前AFG2在4种溶剂中荧光强度差异不大,但是经过光化学衍生后荧光强度都有微弱降低。
荧光扫描光谱仪测定黄曲霉毒素在不同溶剂中荧光强度如图4所示。
结果表明,使用荧光扫描光谱仪测定黄曲霉毒素在不同溶剂中荧光强度结果与原位荧光检测仪结果一致。4种溶剂中的AFB1和AFB2荧光峰值都在425 nm左右,AFG2的荧光峰值在450 nm左右,与Büchi等[8]和居乃琥[9]报道一致。而AFG2在乙腈溶剂中未衍生时荧光峰值为445 nm左右,但衍生后荧光峰值偏移至430 nm处,且荧光强度减弱,有可能是乙腈溶剂中AFG2紫外光作用下降解并生成了荧光强度较弱的物质。

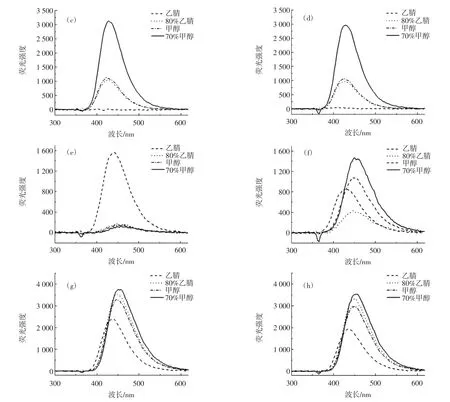
图4 荧光扫描光谱仪测定黄曲霉毒素在不同溶剂中荧光强度Fig.4 Determination of fluorescence intensity of aflatoxin in different solvents by fluorescence scanning spectrometer
综上所述,AFB2和AFG2的荧光信号较强,AFB1和AFG1的荧光信号弱,需要进行光化学衍生来增强荧光。在70%甲醇溶剂中AFB1、AFG1的光化学衍生荧光增强效果最显著,优于甲醇和乙腈。AFB1和AFG1在紫外光和水的作用下,被氢化,双键打开后在环上引入羟基,生成荧光特性更强、更稳定的AFB2和AFG2[21-22],解决了AFB1和AFG1容易产生荧光猝灭的问题,提高了检测灵敏度,同时也能降低检测过程中基质对结果的干扰。而AFB2和AFG2在70%甲醇溶剂中的荧光强度大且稳定,因此选择70%甲醇作为黄曲霉毒素的提取溶剂为最优。
2.3 光化学衍生时间对AFB1和AFG1荧光强度的影响
将光化学衍生前后荧光增量归一化后观察不同衍生时间对AFB1和AFG1荧光强度的影响,结果如图5所示。

图5 不同衍生时间下AFB1和AFG1荧光强度的变化Fig.5 Changes of fluorescence intensity of AFB1and AFG1under different derivatization time
3种不同浓度的AFB1和AFG1标准溶液的荧光增量趋势基本一致,AFB1随光化学衍生时间的加长其荧光增量先增大,3 min~4 min时达到峰值后逐渐减弱;而AFG1在5 min~7 min时达到峰值后趋于平缓。4种黄曲霉毒素中以AFB1的污染情况最为严重,AFB1的检出率远大于AFG1[23],GB 2761—2017《食品安全国家标准食品中真菌毒素限量》也只规定了AFB1的限量指标,同时考虑快速检测对检测时长的要求,因此选择4 min为黄曲霉毒素的光化学衍生时间。
2.4 方法线性范围和检测限
以荧光强度为纵坐标,黄曲霉毒素浓度为横坐标,建立 AFB1、AFB2、AFG1、AFG2的浓度标准曲线如图 6所示,其回归方程、R2、线性范围、检测限见表2。
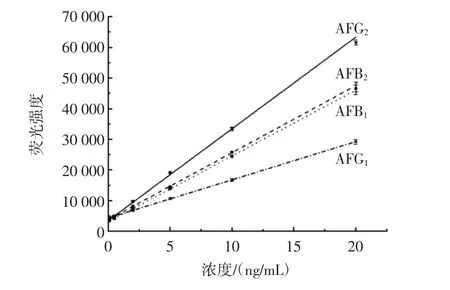
图6 原位衍生荧光检测仪测定黄曲霉毒素浓度标准曲线Fig.6 Determination of aflatoxin concentration standard curve by insitu derivatization fluorescence detector
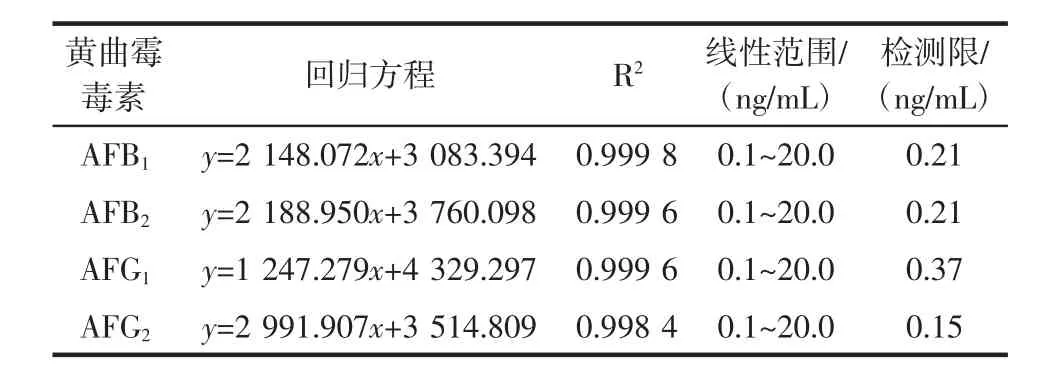
表2 黄曲霉毒素的回归方程、R2、线性范围、检测限Table 2 Regression equation,R2,linear range,detection limit of aflatoxin
结果表明,该方法在0.1ng/mL~20.0ng/mL线性关系良好,R2为 0.998 4~0.999 8,方法检测限在 0.15 ng/mL~0.37ng/mL之间,可以满足快速检测黄曲霉毒素的要求。
3 结论
通过对有机溶剂种类(乙腈、80%乙腈、甲醇和70%甲醇)和光化学衍生时间的优化,建立了原位光化学衍生快速检测黄曲霉毒素荧光强度的方法。该方法对AFB1和AFG1的荧光增强效果显著,且AFB2和AFG2荧光强度强且稳定,在0.1 ng/mL~20.0 ng/mL线性关系良好,R2为0.9984~0.9998,检测限在0.15ng/mL~0.37 ng/mL,满足快速检测黄曲霉毒素的要求。同时该方法将光化学衍生与荧光检测一体化,检测时间短,操作简单方便,在基层快速检测人员和监管部门快速筛查中具有广泛的应用前景。

