奇亚籽蛋白酶解制备抗氧化肽的工艺优化
马倩,潘梦莹,陈秋銮,陈雪芹,孟春,洪晶
(福州大学生物科学与工程学院,福建 福州 350108)
奇亚籽,即芡欧鼠尾草的种子(Salvia hispanica L.),属于薄荷科,原产于墨西哥中部、南部以及危地马拉,大小类似芝麻(1 mm~2 mm),形状呈椭圆形。奇亚籽被誉为“超级食品”,含优质蛋白质(16%~26%)、脂肪酸(30%~33%)、膳食纤维(18%~30%)、抗氧化物等多种营养成分[1]。2009年,奇亚籽作为一种新颖性食物通过欧洲理事会和欧洲议会,2014年在我国被批准为新食品原料[2]。作为一种新食品原料,奇亚籽有巨大的营养价值和治疗潜力。其蛋白质含量高于其它传统作物,如小麦、玉米、大米、燕麦等[3-4],且不含任何有毒成分和麸质蛋白,适合于乳糜泻患者食用[5]。在氨基酸组成方面,奇亚籽含有8种必需氨基酸和10种非必需氨基酸,评分基本符合联合国粮农组织和世卫组织的理想氨基酸模式[6-7]。资料显示,奇亚籽具有抗氧化、降血糖、降血压、降血脂、抗血小板凝聚等多种保健作用[8-11]。目前,国内对奇亚籽的研究较少,主要集中于营养成分的测定和分析[7,12];国外对奇亚籽的研究主要集中在两个方面,一方面是直接添加至产品中,研究其加工特性[13-15],另一方面是集中于油脂的研究[9,16],对奇亚籽中蛋白及活性多肽的研究利用很少。
抗氧化肽是生物活性肽的一种,由二到几十个氨基酸残基组成,能通过清除氧自由基和羟自由基达到抗氧化的功能[17]。化学合成的抗氧化剂本身可能具有毒副作用[18],食源抗氧化肽活性高,易被人体消化吸收,食用安全性高[19-20],极具发展潜力。通过酶解法制备抗氧化肽条件温和易控制,是目前国内外生产多肽的主要方法。近年来,关于植物蛋白水解物抗氧化性的研究已有许多报道,如大米蛋白[21]、高粱蛋白[22]、核桃蛋白[23]、双孢菇蛋白[24]等,但对奇亚籽蛋白酶解产物的研究相对较少。且去油之后的奇亚籽通常被废弃,使得其中大量的优质蛋白未能有效利用。
本文以奇亚籽为原料,以1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基和羟基自由基清除率为指标,以中性蛋白酶酶解制备抗氧化肽,在单因素试验结果的基础上,通过响应面法对抗氧化肽制备工艺进行优化,可充分利用奇亚籽蛋白资源,开发奇亚籽的潜在价值,为奇亚籽优质蛋白及多肽的综合利用提供参考。
1 材料与方法
1.1 材料与试剂
奇亚籽:市售,经中药粉碎机粉碎、过筛,后经石油醚脱脂干燥后制成脱脂粉,4℃储藏备用,脱脂后蛋白含量为(31.35±0.05)%。
碱性蛋白酶(149533U/g)、中性蛋白酶(41553U/g)、胰蛋白酶(79 260 U/g)、木瓜蛋白酶(63 360 U/g):北京诺特莱斯生物科技有限公司;DPPH:美国Sigma公司;水杨酸、过氧化氢(H2O2):西陇化工股份有限公司;硫酸亚铁(FeSO4):国药集团化学试剂有限公司;其它试剂均为国产分析纯。
1.2 仪器与设备
高速粉碎机(AZL-600T):永康市艾泽拉商贸有限公司;高速冷冻离心机(Z 323K):德国HERMLE Labortechnik GmbH;紫外分光光度计(EU 2600):上海昂拉仪器有限公司;数显恒温水浴摇床(HH-4):国华电器有限公司;pH 计(pH700):美国 Eutech Instruments;电子天平(JA2003N):上海精密科学仪器有限公司。
1.3 试验方法
1.3.1 奇亚籽抗氧化肽制备工艺
以碱提酸沉法提取奇亚籽蛋白,提取条件为前期优化所得。即取奇亚籽脱脂粉,按1∶40(g/mL)比例加入0.2 mol/L NaOH溶液,35℃水浴搅拌120 min,离心,上清液调pH值至3.5使蛋白沉降,离心后沉淀即为奇亚籽粗蛋白,冷冻干燥后作为酶解原料。
酶解工艺流程为:奇亚籽蛋白溶液→酶解→灭酶→离心→上清液(酶解液)。
将奇亚籽蛋白粉配成一定浓度溶液,加入一定量的酶,调pH值,恒温水浴摇床酶解,酶解过程中每隔30min调pH值,酶解结束后于100℃水浴灭酶10 min,冷却后于4℃下10 000 r/min离心20 min,取上清液测抗氧化活性。
1.3.2 最适酶筛选
以抗氧化活性为指标,选取碱性蛋白酶、中性蛋白酶、胰蛋白酶及木瓜蛋白酶,分别在其最适条件下进行酶解(表1),以选取最适酶。酶解工艺流程参照1.3.1。
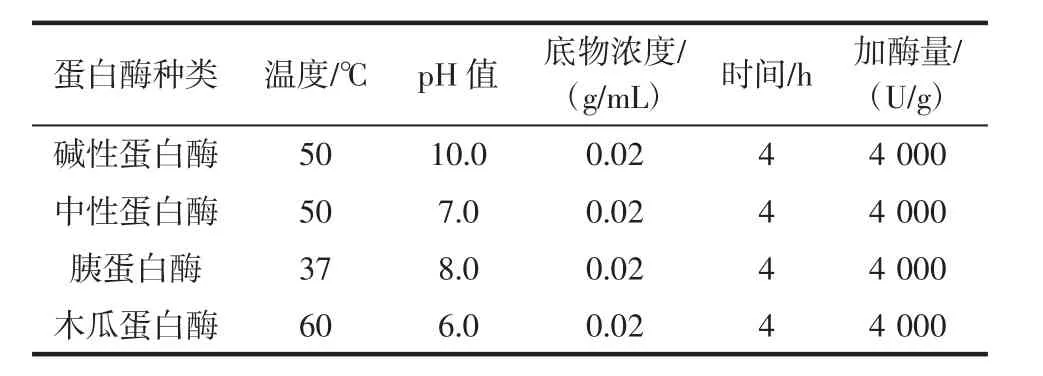
表1 不同酶酶解条件Table 1 Hydrolysis conditions of different proteases
1.3.3 单因素试验
采用1.3.2中选出的最适酶,以DPPH自由基清除率、羟基自由基清除率为指标测定酶解物的抗氧化能力。对影响酶解产物抗氧化能力的加酶量、pH值、酶解时间、酶解温度4个因素各设置不同水平做单因素试验,酶解步骤按照1.3.1。
固定加酶量5 000 U/g,底物浓度0.015 g/mL,pH 7.0,酶解温度50℃,酶解时间3 h进行试验。各变量因素水平分别设定为加酶量(500、1 000、1 500、2 000、3 000、4 000、5 000、6 000、7 000 U/g),pH(5.0、6.0、7.0、8.0、9.0),酶解温度(30、40、50、60、70 ℃),酶解时间(2、3、4、5、6 h),各组试验均重复 3 次,数据取平均值。
1.3.4 响应面法优化奇亚籽蛋白酶解工艺
根据单因素试验结果,使用Design-Expert V8.0.6软件进行Box-Behnken设计,建立三因素三水平试验,确定奇亚籽蛋白酶解最佳工艺条件。以DPPH自由基清除率和羟基自由基清除率为响应值,加酶量(A)、酶解pH值(B)、酶解时间(C)为自变量,因素水平编码见表2。

表2 响应面试验设计Table 2 Code and level of factors chosen
1.3.5 DPPH自由基清除率测定
DPPH自由基清除率测定参照Hong Jing等[25]的测定方法稍作修改。用95%乙醇配制质量浓度为0.4%的DPPH溶液,低温避光保存。样品溶液与DPPH溶液按体积比1∶1混合并振荡均匀,室温(25℃)避光反应30 min,对照组用95%乙醇混合样品溶液,空白组即用95%乙醇代替奇亚籽酶解液。每组3个平行,于波长517 nm处测定吸光值。DPPH自由基清除率计算公式如下。
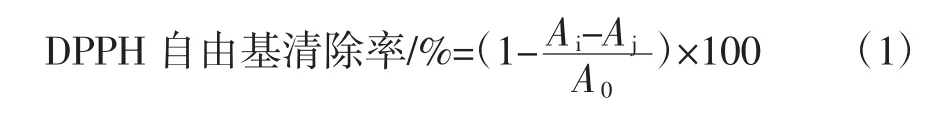
式中:Ai为样品组(DPPH+样品)吸光度;Aj为对照组(95%乙醇+样品)吸光度;A0为空白组(DPPH+95%乙醇)吸光度。
1.3.6 羟基自由基清除率
羟基自由基清除率作为奇亚籽酶解物抗氧化能力测定的另一指标,参照Zhang Yufeng等[26]的方法进行测定。配制8 mmol/L的FeSO4溶液、20 mmol/L的H2O2及3 mmol/L水杨酸。取0.335 mL样品与0.1 mL FeSO4、0.335 mL 水杨酸及 0.08 mL H2O2混匀,37℃保温30 min后流水冷却。加入0.15 mL蒸馏水使反应液总体积达1 mL,5 000 g离心10 min后于510 nm波长处测定上清液吸光值,分别以蒸馏水代替样品和H2O2溶液作为空白组和对照组。羟基自由基清除率计算公式如下。
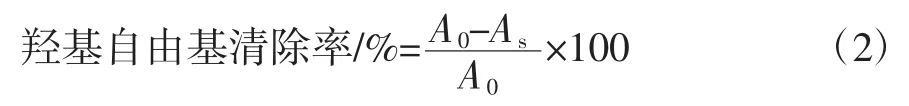
式中:A0为空白组吸光值;As为样品组净吸光值。
1.4 抗氧化能力值(oxygen radical absorbance capacity,ORAC)测定
抗氧化能力值测定参照Blanca Hernndez Led-esma等[27]描述的方法。采用荧光素钠(sodium fluorescein,FL)为荧光指示剂进行测定。
1.5 数据处理
2 结果与分析
2.1 蛋白酶种类的筛选
不同酶对酶解物抗氧化活性的影响见图1。

图1 不同酶对酶解物抗氧化活性的影响Fig.1 Comparative effectiveness of 4 kinds of proteases in hydrolyzing Chia seeds
蛋白酶的特异性对水解物的生物活性有着重要的影响,由于抗氧化肽是由特定肽片段组成的,因此蛋白酶的种类及其水解能力的差异决定了多肽抗氧化活性的差异。由图1可知,在各酶最适pH值、温度,以及相同酶添加量、酶解时间、底物浓度条件下,测得中性蛋白酶的DPPH自由基清除率最高,为90.64%,其羟基自由基清除率为11.93%;碱性蛋白酶的羟基自由基清除率最高,为31.63%,DPPH自由基清除率为67.31%。两者综合下,中性蛋白酶的抗氧化活性相对较好,因此,选取中性蛋白酶进行后续酶解工艺优化。
2.2 单因素试验结果
2.2.1 加酶量对酶解物抗氧化活性的影响
加酶量对酶解物抗氧化活性的影响如图2所示。
由图2可知,在加酶量处于500 U/g~2 000 U/g时,酶解物的DPPH自由基及羟基自由基清除率均呈现出缓慢的上升趋势,此时蛋白酶水解蛋白质成为多肽,释放抗氧化活性,上升趋势缓慢可能的原因在于加酶量此时还较小,水解不完全,抗氧化活性还未完全释放出来。当加酶量增加到3 000 U/g时,酶解物的自由基清除活性大大提高,可能是由于酶量的增加使酶与底物结合效率提高,蛋白质利用率提高,水解更充分,3 000 U/g~7 000 U/g范围内酶与底物基本达到饱和,抗氧化活性变化趋势平缓。因此结合经济因素,选择3 000 U/g为最佳加酶量。

图2 加酶量对DPPH自由基和羟基自由基清除率的影响Fig.2 Effect of enzyme dosage on DPPH free radical scavenging rate and hydroxyl radical scavenging rate
2.2.2 酶解pH值对酶解物抗氧化活性的影响
pH值对产物抗氧化活性的影响如图3所示。

图3 pH值对DPPH自由基和羟基自由基清除率的影响Fig.3 Effect of pH on DPPH free radical scavenging rate and hydroxyl radical scavenging rate
DPPH自由基清除率及羟基自由基清除率在pH 7.0时均达到最大,偏离7.0时抗氧化活性均呈现下降趋势。推测pH值对酶解产物活性的影响与蛋白酶构象、酶分子与底物分子的解离状态有关,酶解体系环境pH值过高或过低会引起酶活力减弱甚至失活,酶与底物结合效率减弱,使得酶解效率降低[28]。因此,选择pH 7.0为最佳pH值。
2.2.3 温度对酶解物抗氧化活性的影响
温度对酶解产物抗氧化活性的影响结果见图4。
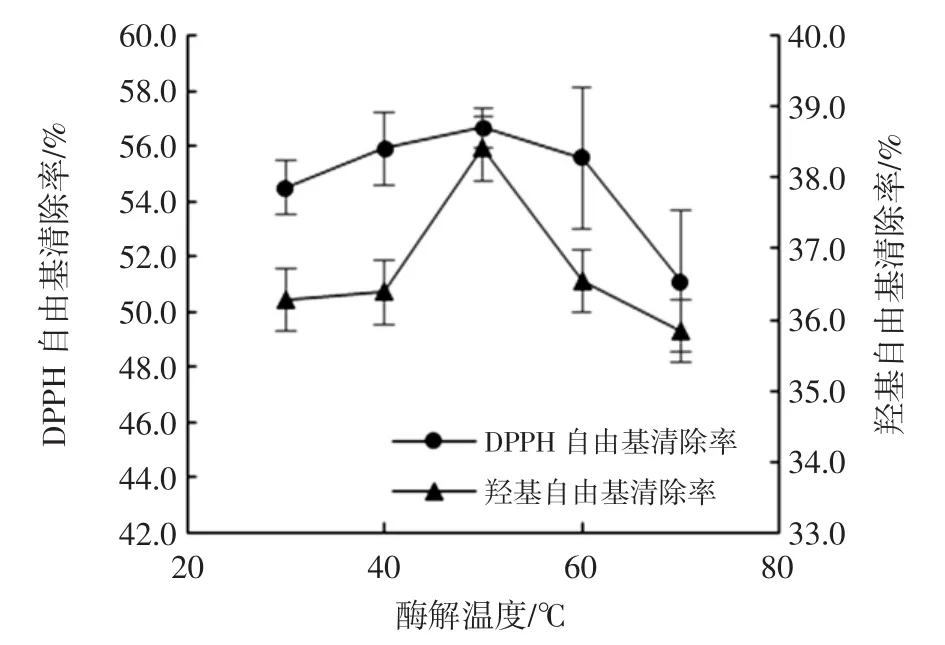
图4 温度对DPPH自由基和羟基自由基清除率的影响Fig.4 Effect of temperature on DPPH free radical scavenging rate and hydroxyl radical scavenging rate
总体来说,温度对两种自由基清除率的影响较小。随着温度的升高,自由基清除率先上升后下降,到50℃时达到峰值,这是由于温度较低(30℃~40℃)时,酶与底物的接触碰撞较温和,酶解效率较低,随温度升高,反应速率逐渐升高,水解程度增大,而当温度过高时,蛋白酶因高温逐渐变性甚至失活,抑制了活性肽的生成,水解度降低。因此选择50℃为最佳酶解温度。
2.2.4 时间对酶解物抗氧化活性的影响
酶解时间对酶解产物抗氧化活性的影响如图5所示。
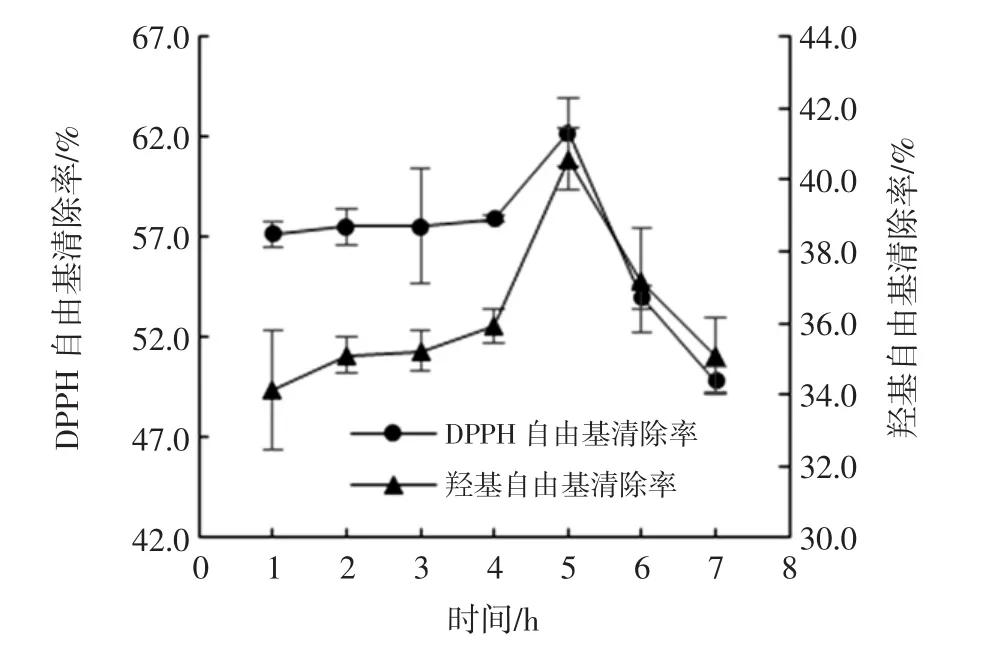
图5 时间对DPPH自由基和羟基自由基清除率的影响Fig.5 Effect of time on DPPH free radical scavenging rate and hydroxyl radical scavenging rate
在1 h到4 h内,两种自由基清除率均缓慢上升,在5 h时急剧升高并达到最大值,在5 h~7 h区间内快速下降。推测原因是酶解时间不同,其产生的肽链的长度和结构也不同,当达到最适值后,酶解时间继续延长,一部分具有抗氧化性的活性肽可能被过度水解,生成不具有抗氧化活性的片段或游离氨基酸[29],导致自由基清除活性降低。综上,选择5 h为最佳酶解时间。
2.3 响应面试验设计方案和结果分析
综合单因素试验结果,以DPPH自由基清除率(Y1)及羟自由基清除率(Y2)为指标,选取加酶量、pH值、酶解时间为考察因素,设置底物浓度为0.015 g/mL,温度50℃,根据响应面分析法中心组合设计原理进行响应面试验,共进行17组试验,响应面设计及结果如表3所示。

表3 响应面试验设计及试验结果Table 3 Respond surface experimental design and results
利用Design-Expert V8.0.6软件进行多元回归拟合分析,得到DPPH自由基清除率回归方程为:Y1=54.98+0.45A-5.75B-0.98C-0.67AB-0.84AC-2.04BC-2.21A2-8.67B2-2.42C2。
羟基自由基清除率回归方程为:Y2=41.17+2.36A-3.23B-0.19C-1.12AB-0.18AC-1.41BC-6.74A2-5.74B2-3.94C2。
回归方程的方差分析结果分别见表4、表5。
DPPH自由基清除率的回归模型(表4)F值为7.45,P 值(P=0.007 4)小于 0.01,所得模型较显著;羟基自由基清除率的回归模型(表5)F值为17.86,P值(P=0.000 5)小于0.001,回归模型极显著。此外,两者的模拟误差失拟项分别为0.141 8、0.947 5,均大于0.05,表明回归模型误差较小,拟合度好,可靠性较高。因此,所建立的两个回归模型均能够对奇亚籽酶解工艺的优化进行较好地分析和预测。
2.3.1 各因素对奇亚籽蛋白酶解产物抗氧化活性的影响
通过方差分析中F值的大小可评价各因素对指标的影响程度,F值越大,影响越显著。由表4可知,F(A)=0.16,F(B)=26.08,F(C)=0.75,即在以 DPPH 自由基清除率为指标时,各因素对奇亚籽酶解工艺的影响顺序为:酶解 pH值(B)>酶解时间(C)>加酶量(A)。由表 5 可知,F(A)=12.37,F(B)=23.13,F(C)=0.077,在以羟基自由基清除率为指标时,各因素对酶解工艺的影响顺序为:酶解pH值(B)>加酶量(A)>酶解时间(C)。综合可知,酶解pH值对两指标的影响最为显著,且一次项和二次项的影响显著,而交互作用影响不显著,表明响应值变化较为复杂。各因素交互作用的响 应面及等高线图见图6、图7。
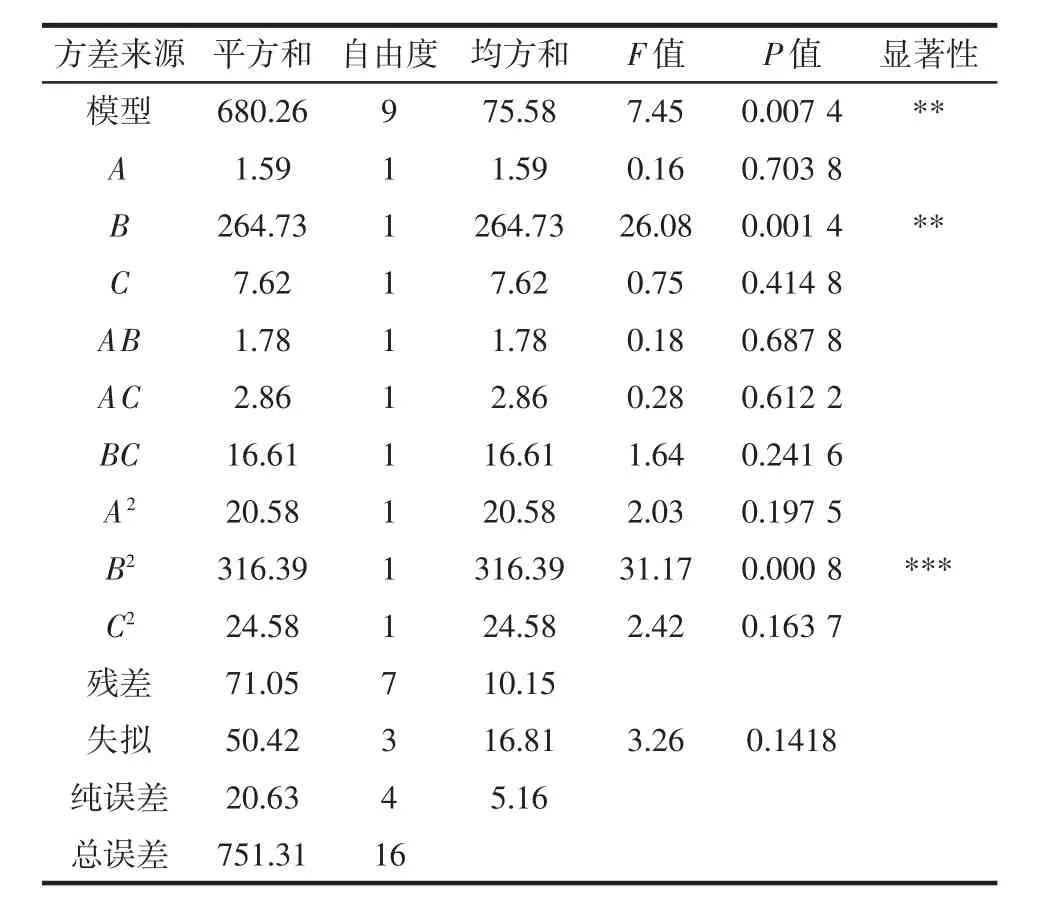
表4 DPPH自由基清除率回归模型方差分析Table 4 ANOVA of regression equation for DPPH free radical scavenging rate

表5 羟基自由基清除能力回归模型方差分析Table 5 ANOVA of regression equation for hydroxyl radical scavenging rate

图6 各因素对酶解液DPPH自由基清除率影响的响应面和等高线图Fig.6 Response surface and contour map of the effects of various factors on DPPH free radical scavenging rate
三维响应面的坡度体现了各因素对响应值影响的大小,如果坡度相对平缓,说明因素对响应值影响较小。等高线图反映变量间交互作用的强弱,等高线形状越近似椭圆形,则表明交互作用越强,越近似圆形,则表明交互作用越弱。同时,等高线沿因素所在坐标轴的变化程度越大,则此因素相较另一因素对响应值的影响越大。
图6反映各因素对酶解产物DPPH自由基清除率的影响。由图 6(a)、图 6(b)可知,奇亚籽酶解物的DPPH自由基清除率随pH值升高呈现先增大后降低的趋势,存在极大值;随加酶量、酶解时间的增加呈现先增后趋于平缓的趋势。此外,由等高线可知,等高线沿pH值轴变化趋势明显高于加酶量和酶解时间,由此可推断,pH值对酶解产物DPPH自由基清除率的影响大于加酶量和酶解时间。又由图6(c)可知,等高线沿酶解时间的变化趋势大于加酶量,说明酶解时间对该酶解工艺的影响大于加酶量。

图7 各因素对酶解液羟基自由基清除率影响的响应面和等高线图Fig.7 Response surface and contour map of effect of various factors on hydroxyl radical scavenging rate
图7反映各因素对酶解产物羟基自由基清除率的影响。由图 7(a)、图 7(b)可知,在所考察的加酶量、酶解pH值、酶解时间范围内,酶解产物的羟基自由基清除率先增大后降低,存在极大值。由等高线可知,酶解pH值的等高线变化趋势较加酶量和酶解时间大,由此可知,pH值对酶解物羟基自由基清除率的影响大于加酶量和酶解时间。又由图7(c),加酶量等高线变化趋势较酶解时间陡峭,因此,加酶量对该酶解工艺的影响大于酶解时间。
综上所述,各因素对奇亚籽酶解产物DPPH自由基清除率的影响主次顺序为:酶解pH值>酶解时间>加酶量,对酶解物羟基自由基清除率的影响主次顺序为:酶解pH值>加酶量>酶解时间,与方差分析结果一致。
2.3.2 最佳提取条件确定及验证
利用Design-Expert V8.0.6软件分析,以使两指标DPPH自由基及羟基自由基清除率同时达到最大值进行条件优选,得到最佳条件为:加酶量3 170 U/g,pH 6.94,酶解时间4.92 h,此时两种自由基清除率分别为55.39%及41.15%。
采用双指标下的最佳酶解条件进行验证性试验。鉴于可操作性,将最佳酶解条件调整为:加酶量3170U/g,pH 6.9,酶解时间4.9 h。对此条件下的抗氧化活性进行鉴定,结果如表6所示。

表6 抗氧化肽活性鉴定Table 6 Identification of antioxidant peptide activity
DPPH 自由基清除率为(54.90±0.94)%,与预测值相对误差为0.88%;羟基自由基清除率为(41.03±0.16)%,与预测值相对误差为0.29%,两者误差均较小,由此可见由响应面优化分析得到的回归模型较可靠。此外,该工艺制得的抗氧化肽具有较好的抗氧化能力值,为(0.53±0.03)μmol TE/mg。
3 结论
本文以奇亚籽为原料,在单因素的基础上,同时以DPPH自由基清除率和羟基自由基清除率为指标,利用响应面法建立奇亚籽蛋白制备抗氧化肽工艺的二次数学模型,通过方差分析,所得模型较显著,回归方程拟合度较好。DPPH自由基及羟基自由基清除率同时达到最佳值时,抗氧化肽最佳制备工艺为:加酶量3 170 U/g,pH 6.9,酶解时间4.9 h。此时,测得两种自由基清除率分别为54.90%、41.03%,与理论值55.39%、41.15%均无显著差异,表明通过响应面分析得到的回归方程能较好地预测试验结果。同时,该工艺下制得的抗氧化肽具有较好的抗氧化能力值,为(0.53±0.03)μmol TE/mg。本试验的结果为奇亚籽抗氧化肽的进一步研究提供了一定基础。

