超高压处理对淀粉-脂质复合物结构及体外消化性影响
秦仁炳,王书军,项丰娟,王津,王硕*
(1.天津科技大学食品营养与安全国家重点实验室,天津 300457;2.天津科技大学食品科学与工程学院,天津 300457;3.南开大学医学院天津市食品科学与健康重点实验室,天津 300071)
淀粉和脂类是食品的宏量营养元素,对食品的风味、质地和营养起着重要作用。淀粉和脂质在加工过程中可形成淀粉-脂质复合物[1]。淀粉-脂质复合物具有较强的抗淀粉水解酶能力[2-4],因此最新研究把淀粉-脂质复合物列为一种新型抗性淀粉(resistant starch,RS),即RS5[5-6]。抗性淀粉可以被肠道菌群发酵产生多种有益代谢产物如:短链脂肪酸(short-chain fatty acids,SCFAs)和乳酸等[7-9],降低肠道 pH 值,促进有益菌生长,减少有害菌的滋生,在调节肠道平衡和改善机体健康方面发挥重要作用[10-12]。由于抗性淀粉对人体健康有诸多益处,因此提高食物中的RS含量是近年来食品科学领域的研究热点。前期的研究主要集中在热加工方法制备RS的条件优化或加工对RS的结构和消化性影响等[13-16]。但是热加工处理往往会诱导食品中热不稳定物质发生若干化学和物理变化,从而破坏食品的颜色、风味、口味、质地,降低某些有效成分的含量及生物可利用性[17],因此在高级食品加工方面受到一定限制。与热加工技术相比,非热加工技术相对温和,可以最大限度地降低食品加工过程中由热引起的不利变化[18]。近年来,随着消费者对高品质食品的诉求越来越高,非热加工技术逐渐成为食品加工技术领域研究的热点。而关于食品的非热加工在食品中淀粉-脂质复合物的形成、性质以及对食品的质地和营养价值的影响报道很少[19-23]。在众多的非热加工技术中,由于超高压是目前一种研究最广泛,商业化程度最高的非热加工技术方法,可瞬时、均匀地作用于样品。超高压只对较弱的非共价键造成一定程度的破坏,因而,一些热不稳定物质不会受到超高压处理的影响,故对食品天然的感官品质影响很小[24]。因此超高压在食品加工技术领域越来越受到人们关注。
淀粉-脂质复合物作为一种重要的抗性淀粉形式(RS5),与其它类型抗性淀粉相比,具有自己独特结构和功能,可在实验室可控条件下制备,为研究超高压对RS5的结构和功能变化提供了一个良好的模型系统。因此,本研究的目的是探讨不同压力处理对RS5结构和体外酶消化性影响。研究结果对进一步了解食品非热加工处理过程中RS5的结构和功能变化,更好地控制食品加工过程中淀粉的消化具有重要意义。
1 材料与方法
1.1 材料
高直链玉米淀粉VII(HA7,直链淀粉含量为68.70%):宜瑞安(Westchester,IL,USA)公司;普鲁兰酶(1498NPUN/mL)、月桂酸(C12:0,LA)、α-淀粉酶(13 U/mg):美国 Sigma公司;GOPOD 试剂盒、淀粉转葡糖苷酶(3260单位/mL):爱尔兰Megazyme国际公司。所有试剂均为分析纯。
1.2 仪器与设备
HVE-50高压灭菌锅:日本hirayama公司;HPP.L2-600/0.6超高压仪:华泰森淼生物工程技术股份有限公司;DSC200 F3差示扫描量热仪:德国NETZCH公司;UV-180紫外分光光度计:日本Shimadzu(岛津)公司;D8Advance广角X射线衍射仪:德国布鲁克公司;inVia Reflex激光共聚焦拉曼光谱仪:英国雷尼绍公司;SHJ-A磁力搅拌水浴锅:上海玺袁科技有限公司。
1.3 方法
1.3.1 淀粉-脂质复合物制备
淀粉-脂质复合物的制备方法是参考QIN等[16]的方法。用0.2 mol/L醋酸钠缓冲液(pH 5.0)把HA7配成10%淀粉悬浮液然后于高压锅中130℃下加热60 min,使HA7充分凝胶化。将凝胶化的淀粉糊冷却至60℃,加入普鲁兰酶(80 NPUN/g淀粉)搅拌12 h使其充分脱支。将脱分支之后的淀粉悬浮液于130℃下再一次加热30 min,然后加入月桂酸,其添加量为淀粉干基10%,在90℃水浴锅中搅拌复合1 h,将复合物搅拌冷却至25℃。淀粉-脂质复合物悬浮液2 000 g离心20 min,用50%乙醇洗涤3次。制备得到淀粉-脂质复合物命名为DHA7-LA,冷冻干燥,研磨过100 μm筛,放在密闭容器中于4℃条件下储存备用。
1.3.2 淀粉-脂质复合物超高压处理
准确称取2 g DHA7-LA放入聚丙烯袋中加6 mL蒸馏水使DHA7-LA与蒸馏水充分混合。然后用真空封口机密封,放在25℃下平衡2 h后将样品放入超高压设备中,分别在200、300、400、500 MPa的压力条件下25℃处理10 min。处理后样品立即用液氮速冻(命名为 200-LA、300-LA、400-LA 和 500-LA),随后在真空冷冻干燥机里冷冻干燥,并研磨后过100 μm筛于4℃条件下储存备用。
1.3.3 差示扫描量热法(differential scanning calorimetry,DSC)
利用差示扫描量热仪和热分析数据站对样品的热性能进行测量。准确称取复合物样品3 mg放入铝盘坩埚中,向铝盘坩埚内添加去离子水使水∶复合物的质量比例达到3∶1。在DSC测量之前,将制备好的样品于25℃下平衡过夜,然后样品以10℃/min的升温速率从20℃加热至135℃。用空DSC铝盘坩埚作为空白参比,用仪器自带的热分析软件分析复合物的热转变温度(起始凝胶化温度To,峰值温度Tp,终止温度Tc)和凝胶化焓值变化(ΔH)。每个样品至少重复3次[25]。
1.3.4 激光共聚焦显微拉曼光谱
首先硅片校正仪器,然后将少量样品用载玻片压至紧实平整,在显微镜视野中选择清晰界面进行测试,激光光源为波长785 nm。具体测试参数:扫描范围为 100 cm-1~3 200 cm-1,激光功率为 50%,分辨率为7 cm-1,每个样品至少采集6个不同的点,使用仪器自带软件WIRE 2.0处理样品图谱,并记录半峰宽(full width at half-maximum,FWHM)数据[3]。
1.3.5 广角X-射线衍射(X-ray diffraction,XRD)
复合物的相对结晶度是由X-射线衍射仪在40 kV和40 mA Cu-Kα辐射(λ=0.154 06 nm)条件下进行检测得到。首先样品在含有饱和NaCl溶液的密闭容器中于25℃下平衡7 d后进行分析。X-射线衍射光谱的扫描范围从 4°~35°(2θ),扫描速率为 2°/min,步长0.02°。用TOPAS 5.0软件计算样品的相对结晶度。

1.3.6 淀粉-脂质复合物的体外酶消化测定
参考Wang等[26]的淀粉体外消化方法对样品进行了消化分析。具体操作方法如下:准确称取样品(100mg,干基)放入4.0 mL含有0.1 mmol/L乙酸钠缓冲液(pH 5.2)中,然后加入1.0 mL新制备的含有1 645个单位的α-淀粉酶和41个单位的淀粉转葡萄糖苷酶消化酶液,复合物/酶混合物放置于37℃磁力搅拌水浴锅中260 r/min孵育2 h。每隔20 min取0.05 mL的水解产物,加入0.95 mL的95%乙醇混合,使消化酶失活,然后在13 000 r/min转速下离心3 min。采用GOPOD试剂盒测定葡萄糖释放量。水解指数(HI)用超高压前后样品的水解曲线下面积(0~120 min)与同一时期白面包对应面积比值的百分比表示。然后采用Granfeldt等[27]提出的经验计算公式估算复合物的血糖指数(eGI)值。

1.4 数据分析
所有的分析都至少做了3个平行处理。数据结果的表示方法为平均值±标准偏差,对于XRD只做1次,采用SPSS 19.0统计分析软件对结果进行单因素方差分析然后用 post-hoc Duncan’s多重比较分析(p<0.05)测定平均值之间的显著差异。
2 结果与分析
2.1 超高压处理前后淀粉-脂质复合物长程有序性分析
超高压处理前后的DHA7-LA的XRD衍射图谱和结晶度见图1和表1所示。

图1 淀粉-脂质复合物经超高压处理前后的X-射线衍射图谱Fig.1 XRD patterns of starch-lipid complexes before and after HPP-treated

表1 拉曼和XRD检测的淀粉-脂质复合物的结构特征Table 1 Structural characteristics of starch-lipid complexes determined by LCM-Raman and XRD
从图1可以看出,DHA7-LA样品在2θ为5.6°、7.5°、12.9°、16.9°、19.8°、22.6°具有明显 XRD 衍射峰。DHA7和LA形成的复合物为典型V型晶体结构在7.5°、12.9°、19.8°(2θ)处具有明显 XRD 衍射峰,而5.6°、16.9°、22.6°(2θ) 处的 XRD 衍射峰表明存在淀粉回生的B型淀粉晶体结构。
上述结果表明,所制备的复合物由B型和V型两种晶体类型组成。从图1可以看出超高压处理没有改变X-射线衍射类型,但是随着压力的逐渐增大,DHA7-LA的XRD衍射峰强度逐渐降低,结晶度从(33.8±0.5)%(DHA7-LA) 逐渐降低到(22.9±0.5)%(500-LA),衍射峰宽度逐渐增大,说明超高压处理能破坏其淀粉-脂质复合物完美的晶体结构(图1和表1)。主要因为超高压处理影响复合物的单螺旋结晶结构,使水分子进入淀粉颗粒内部,使淀粉结晶区的螺旋结构打开,导致结晶度降低[28]。
2.2 超高压处理前后复合物短程有序性分析
拉曼图谱是表征淀粉-复合物短程有序性的重要手段,拉曼光谱中位于 480、865、940、1 264 cm-1的谱带是与淀粉相关的典型谱带,这些峰分别与淀粉的吡喃环的骨架振动、CH2振动、C-O-C的骨架振动和CH2OH(侧链)振动有关[29-31]。淀粉-脂质复合物经超高压处理后的拉曼图谱见图2。
由图 2 可知,DHA7-LA 在 480、865、940、1 264 cm-1处有明显峰出现。拉曼图谱的480 cm-1处的半峰宽对淀粉短程有序性(即螺旋簇的排列)的变化敏感,FWHM值越小,表明淀粉短程分子有序结构越高[32-33]。由图2和表1可以看出,淀粉-脂质复合物经超高压处理后半峰宽呈现变宽趋势并且480 cm-1强度也在逐渐减弱,其中 480 cm-1半峰宽从(14.18±0.43)cm-1增加到(14.85±0.24)cm-1。说明超高压破坏了淀粉的短程有序结构且随着压力的增加破坏程度逐渐增大,与前面的XRD结果相一致。

图2 淀粉-脂质复合物经超高压处理后的拉曼图谱Fig.2 Raman spectra of starch-lipid complexes before and after HPP-treated
2.3 淀粉-脂质复合物热力学性质分析
超高压处理前后淀粉-脂质复合物的DSC热分析图和相应的热转变温度(To、Tp和 Tc)及焓变化(ΔH)如表2所示。
DHA7-LA复合物有两个吸热转变温度,Tp1和Tp2分别为I型复合物和II型复合物的峰值温度,分别为(95.5±0.3)℃和(113.4±0.3)℃。超高压处理后Tp1和Tp2峰呈现增加的变化趋势,而总ΔH呈现先增加后减少的趋势,表明超高压能够显著影响复合物组成和含量,从表2可以看出处理压力为200 MPa就能使II型的淀粉-脂质复合物向I型复合物转变,到300 MPa时II型复合物焓值显著减少从(7.2±0.1)J/g降低到(2.6±0.8)J/g,I型复合物焓值由(0.6±0.1)J/g增加到(5.1±0.8)J/g,但是200 MPa~300 MPa处理时复合物总焓值并没有减少,说明复合物类型遭到改变,但是复合物总量并没有减少,随着压力进一步升高复合物总焓值逐渐降低,其中在400 MPa处理后复合物总焓值为5.6 J/g,在500 MPa未检测到II型复合物熔融峰,复合物总量也最低为(3.4±0.6)J/g,表明超高压能有效破坏淀粉-脂质复合物结构且随着压力的升高破坏能力逐渐增强。随压力升高,I型复合物和II型复合物相转变温度逐渐升高,其中凝胶化峰值温度Tp1由(95.5±0.3)℃升高到(97.9±0.5)℃,Tp2由(113.4±0.3)℃升高到(120.2±0.4)℃。另外凝胶化起始温度和凝胶化终止温度也都有一定提高。凝胶化转变温度升高可能是:(1)由于超高压处理后DHA7-LA样品中较不稳定的复合物晶体结构熔融,留下更稳定的残余晶体,从而导致更高的熔融温度[34-35];(2)超高压处理压力或退火过程中能使一部分IIa型复合物向结构更稳定,熔融温度更高的IIb型晶体结构转变;(3)超高压作用下,淀粉晶体结构的破坏导致无定形区域的增加可能阻碍了水的吸收和淀粉溶胀,从而减缓了淀粉-脂质复合物粉晶体的熔融[36]。

表2 超高压处理前后淀粉-脂质复合物的热力学参数表Table 2 Thermal properties of starch-lipid complexes before and after HPP-treated
2.4 淀粉-脂质复合物样品的体外消化性
淀粉-脂质复合物样品的体外酶消化图谱如图3所示。所有样品均表现出初始阶段消化速度快,约60 min后消化速度就趋于平稳。对超高压处理前后淀粉-脂质复合物的快消化淀粉、慢消化淀粉、抗性淀粉和评估血糖指数进行计算结果见表3。
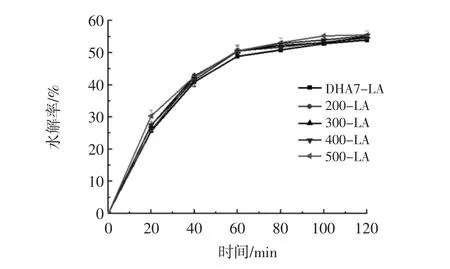
图3 淀粉-脂质复合物经超高压处理前后的体外消化图谱Fig.3 In vitro starch digestograms of starch-lipid complexes before and after HPP-treated

表3 超高压处理前后淀粉-脂质复合物体外消化性和评估血糖指数Table 3 In vitro digestibility and estimated glycemic index of starch-lipid complexes before and after HPP-treated
从表3可以看出DHA7-LA复合物的最终消化率为 54.0%,评估血糖值数(eGI)为 56.4±0.6,淀粉-脂质复合物为中eGI食物[37]。超高压提高DHA7-LA的消化性,主要因为超高压处理影响了DHA7-LA复合物的结晶结构类型,破坏复合物的长程-短程有序性,导致DHA7-LA复合物结构变得疏松,更易于与淀粉酶接触发生水解,另外淀粉-脂质复合物含量降低,所以RDS含量呈现上升趋势,RS含量呈下降趋势。
3 结论
本文研究了一种重要的非热加工方式——超高压对DHA7-LA处理后结构和体外消化性的影响。研究结果显示,DHA7-LA为V型晶体和B型晶体混合物,超高压处理后的DHA7-LA晶体类型未发生明显变化,但是结晶度显著减少,XRD衍射峰明显变宽完美晶体结构遭到破坏,短程分子有序性变差,复合物类型由II型转变成I型直至消失。同时超高压处理后RDS升高,RS含量下降,eGI升高。结果表明超高压处理能对新型抗性淀粉(RS5)结构和体外消化性造成显著影响,研究结果对于深入理解抗性淀粉在超高压加工过程中的变化具有重要的理论和实践意义。

