胰岛素超多孔水凝胶控释制剂的制备及其检测
胡等慧,王秀丽,任蕾蕾 (北京中医药大学中药学院,北京 102488)
超多孔水凝胶(SPF)是一种三维结构的亲水性高分子聚合网格,在水中能够溶胀但不溶解,且因其具有良好的生物相容及生物可降解性,被广泛应用于医学、药学等领域。与传统水凝胶相比,超多孔水凝胶通过致孔剂、模板等方法调整孔隙率,从而改变溶胀速率以及释药速率[1-3]。胰岛素等生物大分子类药物不仅体内稳定性差、易被酶解、生物半衰期短、不易透过生理屏障,故现有给药方式多以注射为主,患者依从性差[4]。有研究显示[5],超多孔水凝胶承载胰岛素灌胃后可以显著降低大鼠血糖:给药2 h 后血糖显著下降,4~6 h 降至最低,但12 h 即回至最初血糖的80%,说明该制剂起效快但持续时间短,血糖波动大,需频繁给药,患者依从性差。上述情况,结合胃肠道对胰岛素的灭活等原因,本实验拟合成具有缓释作用的聚(丙烯酸-丙烯酰胺)/O-羧甲基壳聚糖[P(AA-co-AM)/O-CMC]互穿网络聚合物超多孔水凝胶(SPH-IPN),以期通过皮下给药包载胰岛素的SPH-IPN 后,实现长效、减小血糖波动的目的。
1 材料与仪器
1.1 材料与试剂
丙烯酰胺(AM)、丙烯酸(AA)、N,N′-亚甲基-双丙烯酸胺(Bis)、过硫酸铵(APS)、N,N,N′,N′-四甲基乙二胺(TEMED)均购自上海阿拉丁生化科技股份有限公司;泊洛沙姆127(PF127,北京化工厂);O-羧甲基壳聚糖(O-CMC,大连美仑生物技术有限公司);戊二醛(GA,上海阿拉丁生化科技股份有限公司);姜黄素(宝鸡国康生物科技有限公司);牛胰岛素(上海源叶生物有限公司);十二烷基硫酸钠(SDS)、乙二胺四乙酸二钠(EDTA)、碳酸氢钠、盐酸、乙醇、甲醇、乙酸乙酯、氢氧化钠均为分析纯,实验用水为去离子水。
1.2 仪器
85-2 型恒温磁力搅拌器(上海司乐仪器有限公司);恒温水浴锅(余姚市东方电工仪器厂);透析袋(Viskase,美国);Nicolet iS50 傅里叶变换红外光谱仪(Thermo,美国);AVANCE III 400 核磁共振谱仪(Bruker,德国);FE28 型pH 计(Mettler Toledo,美国);Waters UPLC:二元溶剂管理系统、在线脱气机、自动进样器、PDA 检测器(Waters 公司,美国);TTL-DC 型多功能氮吹仪(北京同泰联科技发展有限公司);SHA-B 双功能恒温水浴振荡器(常州金坛良友仪器有限公司)。
1.3 实验动物
雄性SD 大鼠,体重范围(220±20)g,合格证号:SCXK(京)2017-0002,购自北京斯贝福实验动物科技有限公司,饲养于北京中医药大学动物房。
2 方法与结果
2.1 超多孔水凝胶(SPH-IPN)的制备[5]
依次向西林瓶中加入50% AM 和AA 溶液,以10 mol/L NaOH 调节pH 至5.0。随后再加入2.5% Bis 溶液、10% PF 127 溶液、20%APS 溶液和50 μl 16.7% TEMED 溶液,磁力搅拌混匀。室温放置15 min 后,逐滴加入 6% O-CMC 溶液,使溶液中O-CMC/单体比(w/w)为0.144,迅速加入NaHCO3粉末,搅拌约20 s 使其产生气泡,将其置于40 ℃水浴加热5 min,室温固化30 min,即得半互穿网络水凝胶(semi-IPN)。将所得semi-IPN 置于GA/OCMC 比(w/w)为2∶10 的GA 溶液(用0.2 mol/L的盐酸溶液调节pH 至1.0)中至将其吸干,室温放置1 h,得粗P(AA-co-AM)/O-CMC 超多孔水凝胶(SPH-IPN)。将SPH-IPN 置于0.1 mol/L 盐酸溶液中,透析5 d,无水乙醇中脱水透析2 d,30 ℃烘干至恒重,干燥密闭保存,即得纯化后的SPH-IPN。
2.2 SPH-IPN 的结构表征
将样品充分干燥,KBr 压片法制样,使用傅里叶变换红外光谱仪测定500~4 000 cm-1波数的SPHIPN 的IR 谱。将样品置于氧化锆样品管(A=4 mm),转速5 000 Hz,固体碳谱测定。
2.3 SPH-IPN 的溶胀性能测定
取干燥的SPH-IPN,室温下浸于过量水中(pH 7.0),于不同时间点用筛网取出SPH-IPN,吸去表面残余水后称重,根据以下公式计算SPH-IPN 在不同时间点的溶胀比(QS):
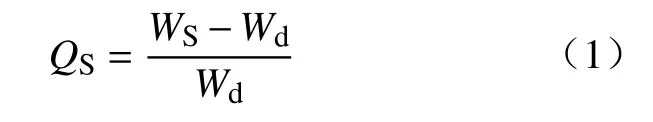
其中,WS为溶胀后SPH-IPN 质量(g);Wd为干SPH-IPN 质量(g)。
2.4 SPH-IPN 孔隙率测定
采用乙醇替代法测定SPH-IPN 的孔隙率[6]。取干燥的SPH-IPN,置无水乙醇中浸泡12 h,取出后吸去表面残余乙醇,称重,根据以下公式计算孔隙率:
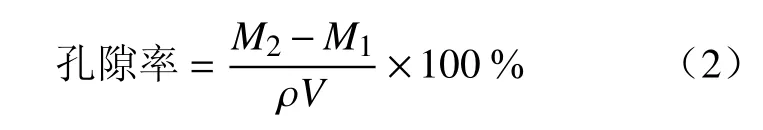
其中,M1为干SPH-IPN 质量(g);M2为乙醇浸泡后的SPH-IPN 质量(g);ρ 为乙醇密度(g/cm),V 为SPH-IPN 体积(cm3,以游标卡尺测量长方体SPH-IPN 的长、宽、高后计算而得)。
2.5 载胰岛素SPH-IPN 的制备及含量测定
2.5.1 载胰岛素SPH-IPN 的制备
取胰岛素15 mg,精密称定,置10 ml 量瓶中,加0.1 mol/L pH 7.4 PBS 溶解并定容至刻度,得1.5 mg/ml的胰岛素溶液。称取50 mg SPH-IPN 置装有10 ml胰岛素溶液的西林瓶中,37 ℃温浴放置2 h,取出,置烘箱内,30 ℃恒温干燥。
2.5.2 载药量的测定
取胰岛素SPH-IPN 适量,研磨粉碎,取20 mg,精密称定,置10 ml 量瓶中,加入0.1 mol/L pH 7.4 PBS,定容至刻度。37 ℃温浴2 h,超声10 min,精密量取上清液20 μl 注入HPLC 仪,记录色谱图,计算胰岛素含量,并根据以下公式计算载药量:

其中,c 为测得胰岛素的浓度(mg/ml),V 为量瓶体积(ml),M 为SPH-IPN 的质量(mg)。
2.6 载胰岛素SPH-IPN 降血糖实验
2.6.1 不同方法载药SPH-IPN 的制备
按“2.5.1”项下方法制备载胰岛素SPH-IPN,采用冷冻干燥法将其冻干即得含胰岛素的冻干SPHIPN。称取空白凝胶200 mg 置于1.5 mg/ml 的胰岛素溶液37 ℃中溶胀2 h,备用,即得含胰岛素的预溶胀SPH-IPN。
2.6.2 糖尿病大鼠模型的建立
给大鼠喂食高脂饲料(88.8%基础饲料、1%胆固醇、10%猪油和 0.2%胆盐[7])喂养4 周,动物自由进食和饮水,每周记录体重。于喂养的第28 天晚禁食,在第29 天一次性腹腔注射链脲佐菌素(STZ)35 mg/kg,将一次性注射STZ 3 d 后大鼠空腹血糖≥11.1 mmol/L 或随机血糖≥16.7 mmol/L作为成模标准[8]。对照组大鼠则腹腔注射无菌生理盐水(0.3 ml/100 g)。注意测血糖前应禁食12 h,空腹测血糖。造模期间要防止感染,注意消毒。未造模成功的大鼠再次注射STZ35 mg/kg,3 d 后测血糖验证是否造模成功。
2.6.3 分组、给药及血糖测定
取糖尿病大鼠12 只,按随机数字表分为2 组,即模型1 组和模型2 组;取正常大鼠12 只,按随机数字表分为2 组,即正常1 组和正常2 组。模型组1 组和正常1 组皮下埋植含胰岛素的预溶胀SPH-IPN,模型2 组和正常2 组皮下埋植含胰岛素的冻干SPH-IPN。给药后分别于1、2、4、6、8、10、12、24、28、32、36、48、60、72 h 不同时间间隔大鼠尾部取血0.02 ml,用血糖仪测定血糖值,考察不同时间血糖值的变化情况。
3 实验结果
3.1 IPN 结构表征
3.1.1 傅立叶变换红外光谱(FTIR)
图1 为SPH-IPN 的FTIR 图。在1 651 cm-1处有-COOH 的伸缩振动峰,且1 615 cm-1附近无AA 和AM 的C=C 双键吸收峰,说明已聚合成P(AA-co-AM),SPH-IPN 中存在P(AA-co-AM),图中3 335 和2 922 cm-1处分别为-O-H 和-C-H 的伸缩振动峰;1 604 和1 416 cm-1处分别为羧酸盐-COO-的反对称伸缩振动峰和对称伸缩振动峰;1 086、1 044 和1 171 cm-1处分别为O-CMC 中糖环羟基-CH-OH、一级羟基-CH2-OH 和醚基C-OC 中的C-O 伸缩振动峰。以上结果表明SPHIPN 中存在P(AA-co-AM),还存在的一些杂峰可能是还有一些未反应单体未被除尽。
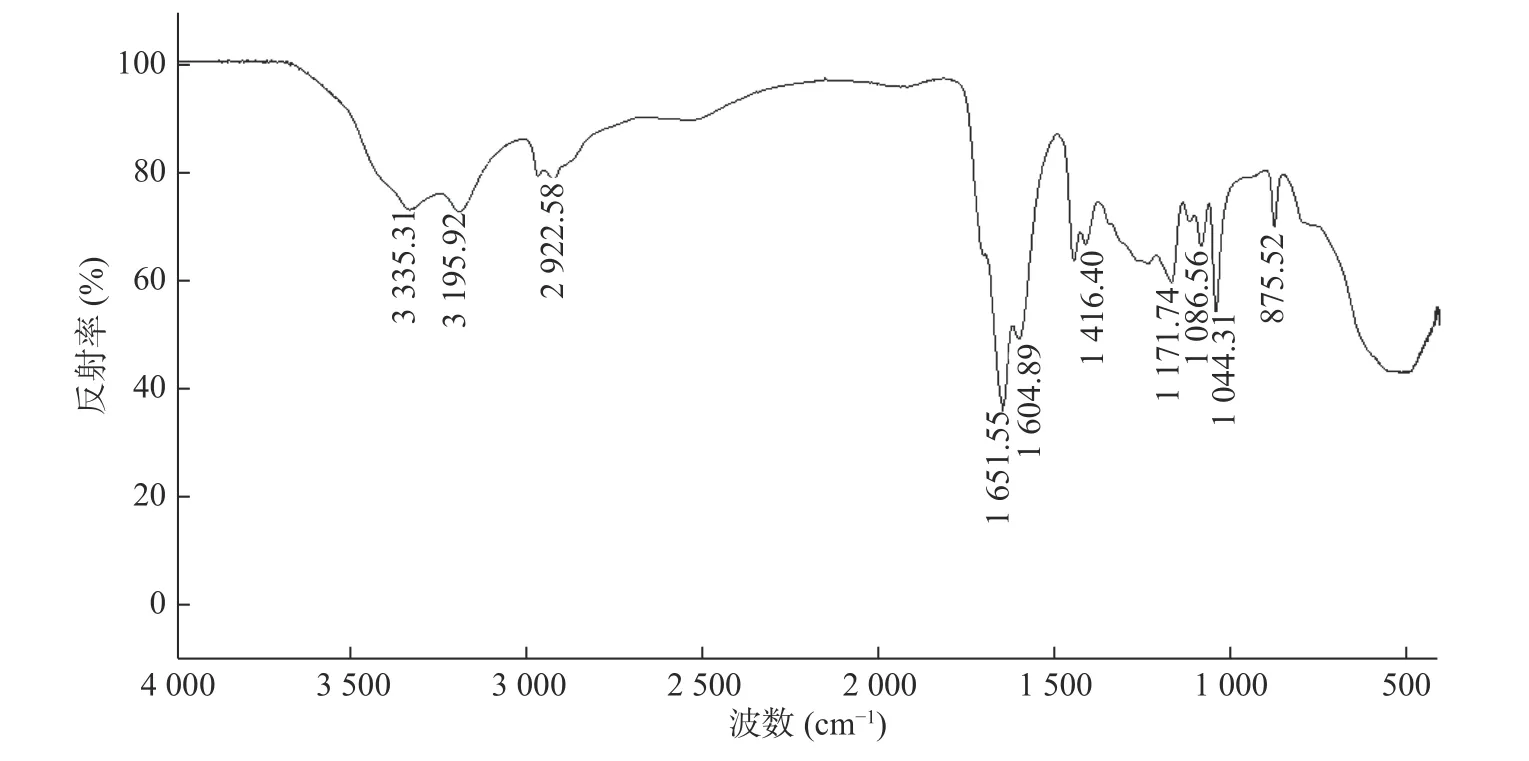
图1 SPH-IPN 的傅立叶变换红外光谱
3.1.2 核磁共振(13C-NMR)
图2 为SPH-IPN 的13C-NMR 图。图中41.926×10-6为P(AA-co-AM)上主链碳原子的化学位移峰;179.499 处为羧基碳原子的化学位移峰,说明结构中含有羧基官能团,AA 与AM 已聚合形成P(AAco-AM)。
由于制得的水凝胶未找到合适的溶液将其溶解,因此在测定核磁共振图谱时,采用的是固体核磁技术[9]。
综合红外和碳谱结果可知,通过该方法可聚合形成P(AA-co-AM)结构,而该结构又是超多孔水凝胶SPH-IPN 的主要结构,由此可说明已成功聚合SPH-IPN。
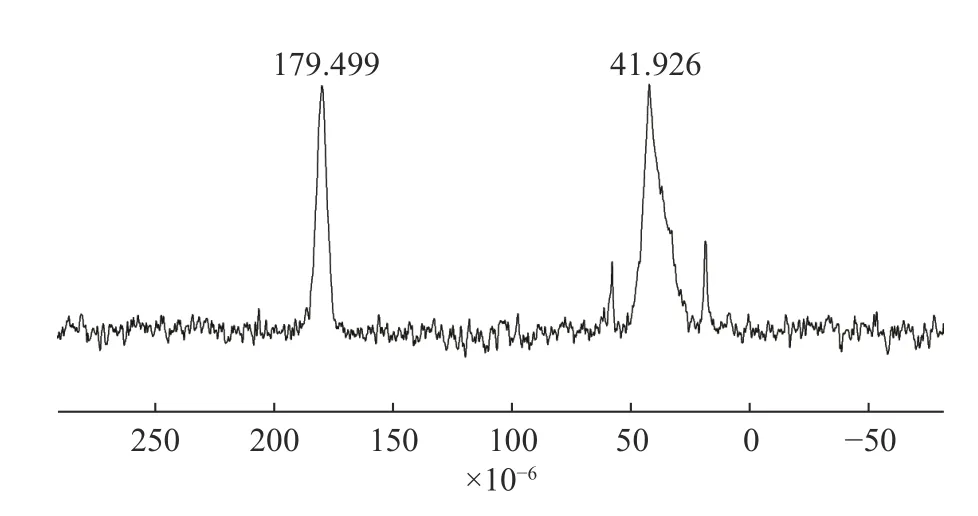
图2 SPH-IPN 的核磁共振碳谱
3.2 SPH-IPN 的溶胀性能
图3 为不同温度介质中SPH-IPN 的溶胀曲线,可见随着温度升高,SPH-IPN 的溶胀速率加快,平衡溶胀比增大,原因是温度较高时相互缠绕的聚合物链松开,破坏分子间的氢键,增加链运动,水分子在凝胶骨架内外的扩散速率加快,从而促进了聚合物的溶胀[10]。
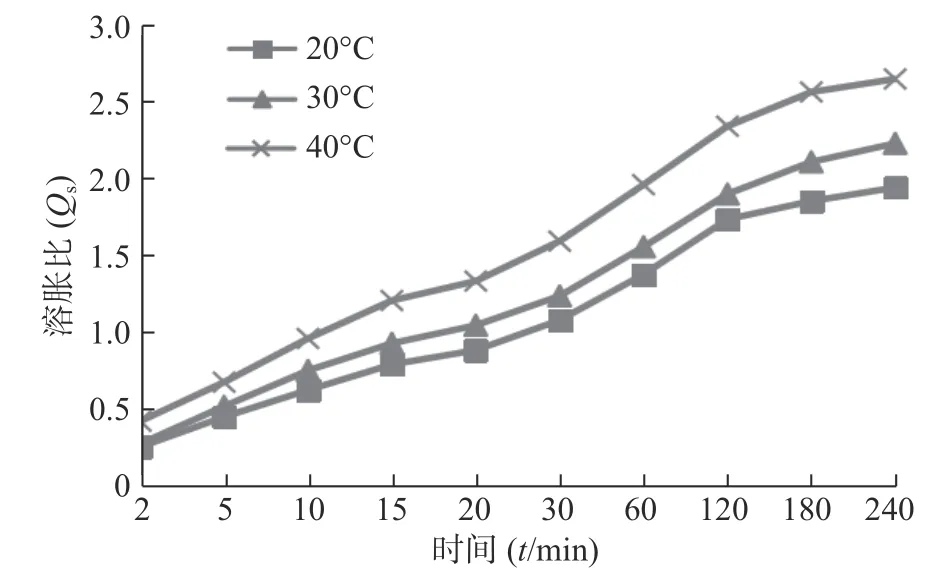
图3 不同温度下SPH-IPN 的溶胀性
3.3 SPH-IPN 孔隙率的测定
表1 为SPH-IPN 孔隙率测定结果,所制SPHIPN 超多孔水凝胶空隙分布均匀。除此之外,与传统水凝胶相比[11],孔隙率高,更利于药物的释放。
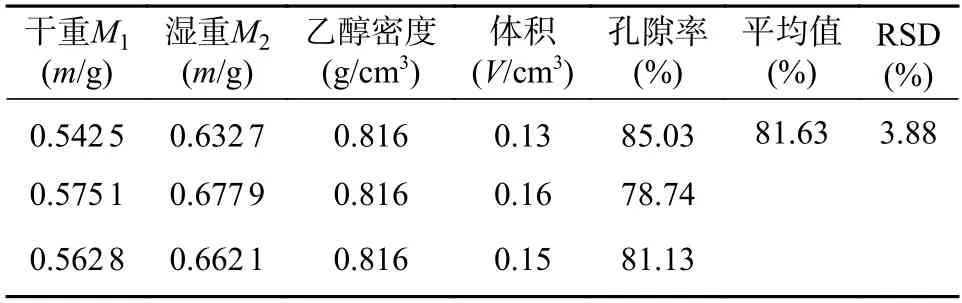
表1 SPH-IPN 的孔隙率测定结果
3.4 SPH-IPN 载胰岛素含量测定结果
37 ℃时SPH-IPN 溶胀比较大,温度过高易引起胰岛素变性,故选择37 ℃温度载药,胰岛素的载药量试验结果见表2。
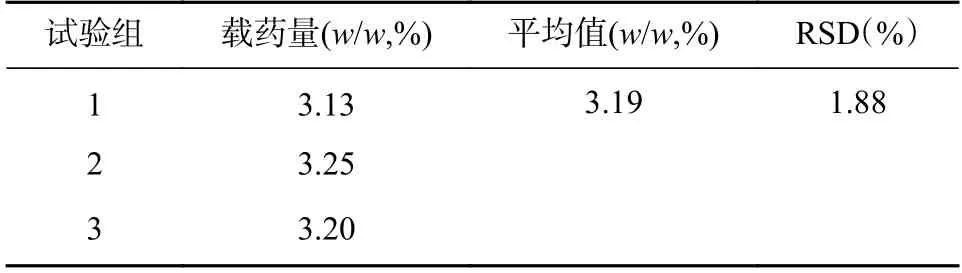
表2 SPH-IPN 对胰岛素的载药量
3.5 载胰岛素凝胶降血糖实验
图4 是含胰岛素的预溶胀SPH-IPN 和冻干SPH-IPN 对糖尿病大鼠和正常大鼠降糖作用的比较。图中预溶胀模型组在10 h 时血糖值才有所降低,最低值为10 h 的16.8 mmol/L,之后血糖又开始慢慢升高;预溶胀正常大鼠组在给药4 h 后血糖开始降低,到24 h 时血糖达到7.3 mmol/L,之后维持平稳状态;冻干模型组在包埋1 h 后血糖便开始下降,血糖值降到6.7 mmol/L,在24 h 后血糖开始慢慢升高,冻干正常大鼠组在1 h 后血糖降至5.3 mmol/L,之后虽有起伏,但也一直在正常范围内。说明冻干凝胶的降糖作用较预溶胀组好,冻干凝胶在1~24 h时间段内的降糖作用较平稳。
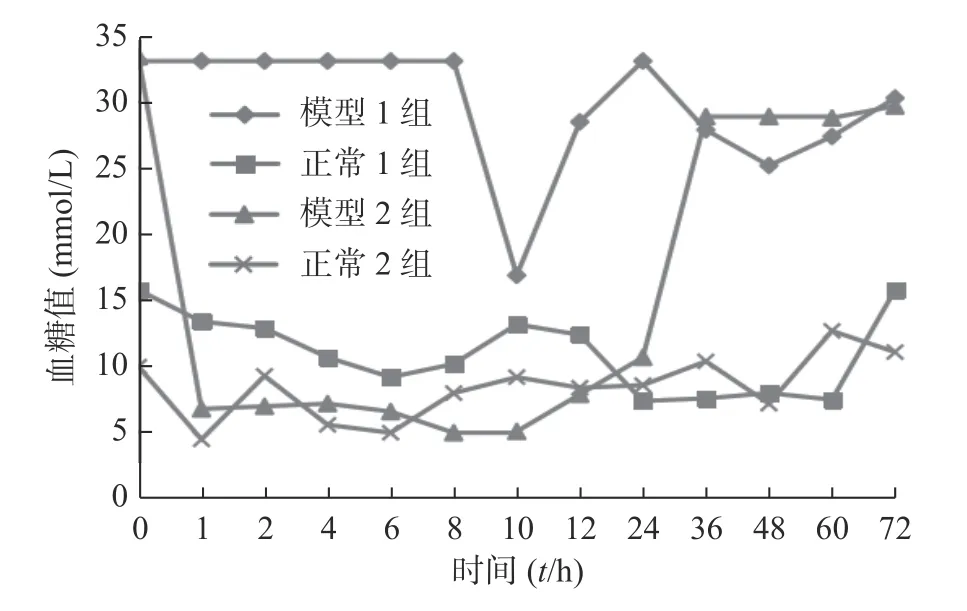
图4 载胰岛素SPH-IPN 的降糖作用
4 讨论
4.1 SPH-IPN 的制备
本实验选用了能够迅速聚合的水溶性原料AA、AM 为聚合反应单体;以APS/TEMED 为引发体系;PF127 为泡沫稳定剂,使产生的泡沫稳定时间更长;NaHCO3为起泡剂;O-CMC 在合成过程中作为增稠剂,维持合适的起泡速率,使产生的气泡均匀、稳定,不致产生的气泡过快逸散[12]。采用溶液聚合法制备了含semi-IPN 的水凝胶。因为该聚合反应在反应过程中会产生大量热量,这对泡沫的稳定极为有利,因此在常温条件下便能进行聚合反应,条件温和。以pH 1.0 的GA 溶液交联O-CMC时,可避免过度溶胀对孔隙结构的破坏,且pH 1.0时GA 的交联能力较好。除此之外,相较于参考文献[5],本实验中O-CMC/单体比较高,当O-CMC/单体比为0.144 时,虽然可形成具有大量相互贯通孔隙的聚合物,但会导致其溶胀速率减慢,溶胀比降低,从而影响载药量和释药速率。随着溶胀速率减慢,药物溶出速率也相应减慢;随着溶胀比的降低,吸收的药物溶液减少,载药量随之降低。本实验提高O-CMC/单体的目的是希望通过减慢SPHIPN 的溶胀速率,从而尝试制备缓释制剂。
4.2 水凝胶的载药方法
水凝胶的载药方法通常有2 种:一是将药物与单体溶液混合,随着单体聚合、交联将药物包埋于水凝胶中[13];另一种方法为吸附载药,即凝胶在被载药液中溶胀,将载药水凝胶干燥,实现药物包埋[14]。姜黄素属于脂溶性药物,课题组前期研究结果表明,0.5%的SDS 对姜黄素有一定的增溶效果;0.1 mol/L pH 7.4 PBS 中SPH-IPN 的溶胀比较大,对胰岛素具有一定的增溶作用,故分别选用这两种溶剂配制胰岛素溶液。
4.3 超多孔水凝胶的释药性能
文献[5]表明,超多孔水凝胶载药后的释药性能与O-CMC 的含量、pH、离子强度、温度等多个因素有关,同时也有可能与载药SPH-IPN 的制备过程有关。
笔者曾用SPH-IPN 包载姜黄素,并开展探索性实验。结果发现20、40、60 目不同粒径的凝胶累积释放率不同,前13 h 三者的累积释放率均几乎一样(接近0),13 h 后累积释放率逐渐增加,以40 目凝胶的效果最佳,48 h 后达到6.00%,明显高于其他组,但其释放速度慢,见图5。灌胃给予载姜黄素SPH-IPN 后,部分大鼠排泄物中可见载姜黄素SPH-IPN,说明SPH-IPN 在体内溶胀速率很慢;而载姜黄素SPH-IPN 组和姜黄素原药组,灌胃后大鼠眼眶血中均未检出姜黄素,也进一步体现SPH-IPN 未促进姜黄素的吸收。
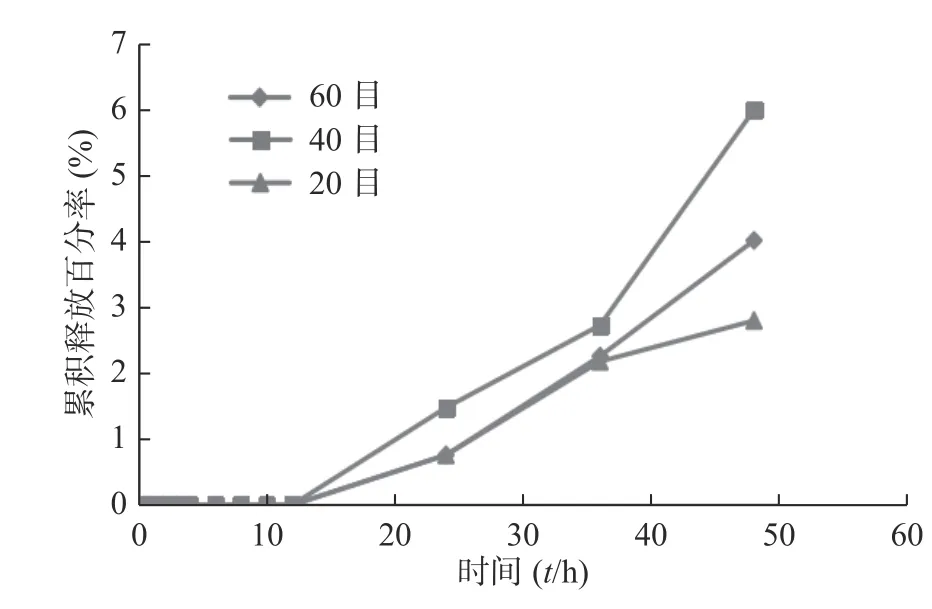
图5 不同粒径载姜黄素SPH-IPN 的释药情况
将载胰岛素SPH-IPN 予灌胃给药溶胀很慢,降糖效果极不明显,为延长SPH-IPN 溶胀时间,最终考虑将其进行皮下包埋给药。
载胰岛素SPH-IPN 皮下包埋给药发现,载胰岛素冻干SPH-IPN 组的降糖效果优于载胰岛素溶胀SPH-IPN 组,表明载药SPH-IPN 的释放性能除与溶胀比有关外,其制备过程也会一定程度影响被载药物的疗效,与文献[5]报道一致。实验中将冻干组和溶胀组均进行包埋,均可延长溶胀时间,但冻干SPH-IPN 组的降糖效果优,皮下包埋2 h 后表现出明显的降糖作用,相比溶胀组而言,起效时间快(8 h 左右)且持续时间长,24 h 之内均具有良好的降糖作用。提示我们在制备载药SPH-IPN 的过程中应该时刻关注被载药物的活性及稳定性,应在适当的条件下对药物进行包载以提高药物疗效,同时也说明载胰岛素冻干SPH-IPN 可作为控释制剂,实现调节大鼠血糖的目的。结合实验结果分析可知,SPH-IPN 能够增强药物的稳定性,提高生物利用度,比较适合作为蛋白质药物给药载体。
4.4 SPH-IPN 载胰岛素的微针给药展望
文献研究发现,胰岛素经皮给药具有不错的疗效,与皮下给药效果几无差异,且依从性好,成为最新、有效、方便的给药方式。Norduist 等[15]将微针贴剂用于胰岛素给药,结果发现,血浆胰岛素浓度变化与传统的皮下注射并无太大差异,但微针贴剂能极大地提高实验大鼠的依从性。无痛中空微针皮内胰岛素给药系统已获得 FDA 批准,进入II 期临床,相关产品有以色列纳米通道技术公司采用MEMS 技术开发的中空微针器具,其中包括用于无痛释放胰岛素薄片与胰岛素微型泵相结合。Liu 等[16]将可溶性材料透明质酸制备成负载胰岛素的微针阵列。在体实验发现,负载胰岛素的微针能够在1 h 内完全溶解,携带的胰岛素快速释放入体内。
与上述研究及应用相比,本实验的载胰岛素SPH-IPN,释放药物无需微型泵,皮下包埋给药可以24 h 内保持平稳、正常的血糖浓度,适合作为一日一次给药的控释制剂。为了提高患者的依从性,进一步研究将载胰岛素SPH-IPN 制备为微针阵列的形式,以期得到一种方便、快捷、安全的胰岛素缓释递药系统。

