辣木叶多糖对过氧化氢诱导奶牛乳腺上皮细胞氧化损伤的保护作用
马广明 刘 骥 姜 鑫 张永根
(东北农业大学动物科学技术学院,哈尔滨150030)
奶牛乳腺上皮细胞(BMECs)是奶牛乳腺组织中唯一具有高分化能力的细胞,起着合成与分泌乳脂和乳蛋白的作用[1],其活力是决定奶牛健康状况和产奶能力的关键[2]。奶牛在泌乳高峰期乳腺代谢旺盛,容易产生过多的活性氧(ROS),引起细胞氧化应激,对细胞结构造成严重损害,破坏生物膜系统及其功能,使得BMECs大量凋亡,最终影响奶牛正常泌乳[3]。此外,乳腺细胞中氧化自由基的过量产生会破坏乳腺抗氧化机能的动态平衡,从而提高了奶牛乳房炎的发病率[4]。乳房炎的发生不仅会降低牛奶的营养成分,还会影响牛奶的质量和风味[5]。目前缓解和治疗奶牛氧化应激的方法普遍采用人工合成的抗生素疗法[6],然而持续大量的使用抗生素,会导致一些药物残留于奶牛乳房中,从而危害人类健康[7]。因此,寻找一种新型安全高效的抗生素替代物,以缓解奶牛氧化应激,对于提高奶牛泌乳性能具有重要意义。
近年来,植物提取物因具有高效、安全、无药物残留等特点,已被广泛应用于饲料添加剂中以减少抗生素的使用[8]。辣木是一种多年生热带落叶乔木,广泛分布于我国南方,是一种新兴的饲料资源[9],辣木营养成分及活性物质丰富,具有广泛的生理活性及医学用途[10]。已有研究指出,辣木叶乙醇提取物具有清除氧化自由基的能力,并且能够提高小鼠肝脏谷胱甘肽过氧化物酶(GSH-Px)活性[11]。辣木叶水提取物具有提高小鼠机体抗氧化能力的作用[12]。此外,张幸怡等[13]研究发现,以辣木梗叶替代苜蓿饲喂奶牛,可以提高奶牛血浆抗氧化能力。以上研究表明,辣木提取物中含有某种抗氧化物质。植物多糖是由相同或不同的单糖以α-或β-糖苷键所组成的聚合糖,又称植物多聚糖,是植物内重要的活性成分[10]。国内外研究指出,各种植物多糖均具有一定的抗氧化功能[14]。杨玲等[15]研究表明,植物多糖作为饲料添加剂,具有提高机体抗氧化能力的作用;杨明峰[16]研究发现,植物多糖具有清除1,1-二苯基-2-三硝基苯肼(DPPH)和抗油脂氧化的能力。Amagase等[17]通过小鼠饲喂试验发现植物多糖能够提高小鼠肝脏细胞的GSH-Px与超氧化物歧化酶(SOD)活性,降低丙二醛(MDA)含量。因此,我们推测辣木叶多糖(MLP)可能是辣木叶提取物中发挥抗氧化功能的主要活性物质。
目前已有研究指出,MLP对自由基具有很强的清除能力[18]。然而,MLP是否具有缓解BMECs氧化损伤的潜力尚不清楚。因此,本试验以过氧化氢(H2O2)为氧化剂建立BMECs氧化损伤模型,研究MLP对BMECs氧化应激和凋亡的保护作用,为MLP作为奶牛功能性添加剂提供参考。
1 材料与方法
1.1 试验材料
本试验所用BMECs由东北农业大学反刍动物实验室提供。F12培养基(DMEM/F12)购买于Hyclone公司;胎牛血清(FBS)购买于Wisent公司;胰酶消化液、磷酸盐缓冲液(PBS)固体和ROS检测试剂盒均购买于Solarbio公司;青霉素和链霉素与二甲基亚砜(DMSO)均购买于Sigma Aldrich公司;细胞培养瓶购买于康宁公司;Hoechst-33258试剂盒购买于Beyotime生物技术研究所;CCK-8活力检测试剂盒购买于Dojindo分子技术公司;MDA含量及GSH-Px、SOD、过氧化氢酶(CAT)活性检测试剂盒购买于南京建成生物工程研究所。MLP冻干粉(多糖纯度为60%)由西安全澳生物科技有限公司提供。
1.2 试验方法
1.2.1 建立氧化损伤模型
在96孔板内培养BMECs,将细胞培养至对数生长期(约为105个/mL),待细胞贴壁后,在培养基中分别加入100 μL浓度为20、60、100、200、500 μmol/L的H2O2,继续培养细胞2 h,每种浓度4个重复。使用CCK-8活力检测试剂盒检测各组细胞存活率,以确定H2O2适宜浓度。
1.2.2 MLP适宜浓度筛选
按照不同浓度(1、2、3、4、5、6 mg/mL)将MLP溶于蒸馏水中,随后用0.22 μm的滤膜进行过滤。在96孔板内培养细胞至对数生长期(约为105个/mL),待细胞贴壁后加入100 μL浓度为1、2、3、4、5、6 mg/mL的MLP溶液,继续培养2 h,每种浓度4个重复。使用CCK-8活力检测试剂盒检测各组细胞存活率,以确定MLP适宜浓度。
1.2.3 试验设计
将培养好的细胞随机分为4组,分别为对照组1(未经处理、正常培养的细胞)、对照组2(用200 μL浓度为1 mg/mL的MLP溶液处理BMECs 2 h)、损伤组(用200 μL浓度为500 μmol/L的H2O2处理BMECs 2 h)、保护组(用200 μL浓度为1 mg/mL的MLP溶液处理BMECs 2 h后,再使用500 μmol/L H2O2处理BMECs 2 h),每组3个重复。
1.2.4 Hochest33258法检测细胞凋亡数
将BMECs接种于6孔板中,在37 ℃,含有5%二氧化碳(CO2)和95%空气的培养箱中培养,待细胞贴壁后用PBS溶液进行清洗并添加1.5 mL细胞培养液(目的是洗掉接种过程中凋亡的细胞,避免对试验结果产生影响)。在6孔板内将细胞培养至对数生长期(约为105个/mL)后,根据1.2.3的分组进行下一步试验处理。按照试剂盒说明书,于6孔板内加入200 μL Hoechst33258,室温和黑暗的条件下静置20 min,用PBS清洗3遍,使用荧光显微镜检测荧光强度,并对细胞核形态进行评价。
1.2.5 细胞中ROS数量的检测
按照1.2.4的步骤将BMECs进行培养和处理。根据试剂盒说明书进行操作,将二氯二氢荧光素-乙酰乙酸酯(DCFH-DA)探针加入4组,在37 ℃黑暗中孵育20 min。用荧光显微镜观察二氯二氢荧光素(DCF)荧光。
1.2.6 细胞氧化应激的透射电镜观察
按照1.2.4的步骤将BMECs进行培养和处理。用1.5 mL胰酶消化液消化BMECs,2.5%戊二醛固定2 h。用0.1 mol/L PBS(pH 7.2)冲洗混合物2次,每次15 min。然后将混合物在1%柠檬酸中固定10 min,用0.1 mol/L PBS冲洗,用50%~100%乙醇溶液将样品脱水后,再用丙酮和包埋液浸泡样品1 h。包埋、聚合、修复后,用透射电镜观察。
1.2.7 BMECs氧化应激指标检测
按照1.2.4的步骤对BMECs进行培养和处理。使用细胞刮刀将处理后的细胞从6孔板壁上刮下,并使用2.5 mL EP管收集孔内溶液,最后按照试剂盒的指示操作,测定BMECs中CAT、GSH-Px、SOD的活性和MDA含量。用酶标仪(spectraMax M5)测定各组的吸附率。
1.3 统计分析
首先通过Excel 2018软件对数据进行整理,随后采用SAS 9.4软件包中的单因素方差分析对试验数据进行分析。采用Turkey作显著性检验,其中P<0.05表示差异显著。
2 结果与分析
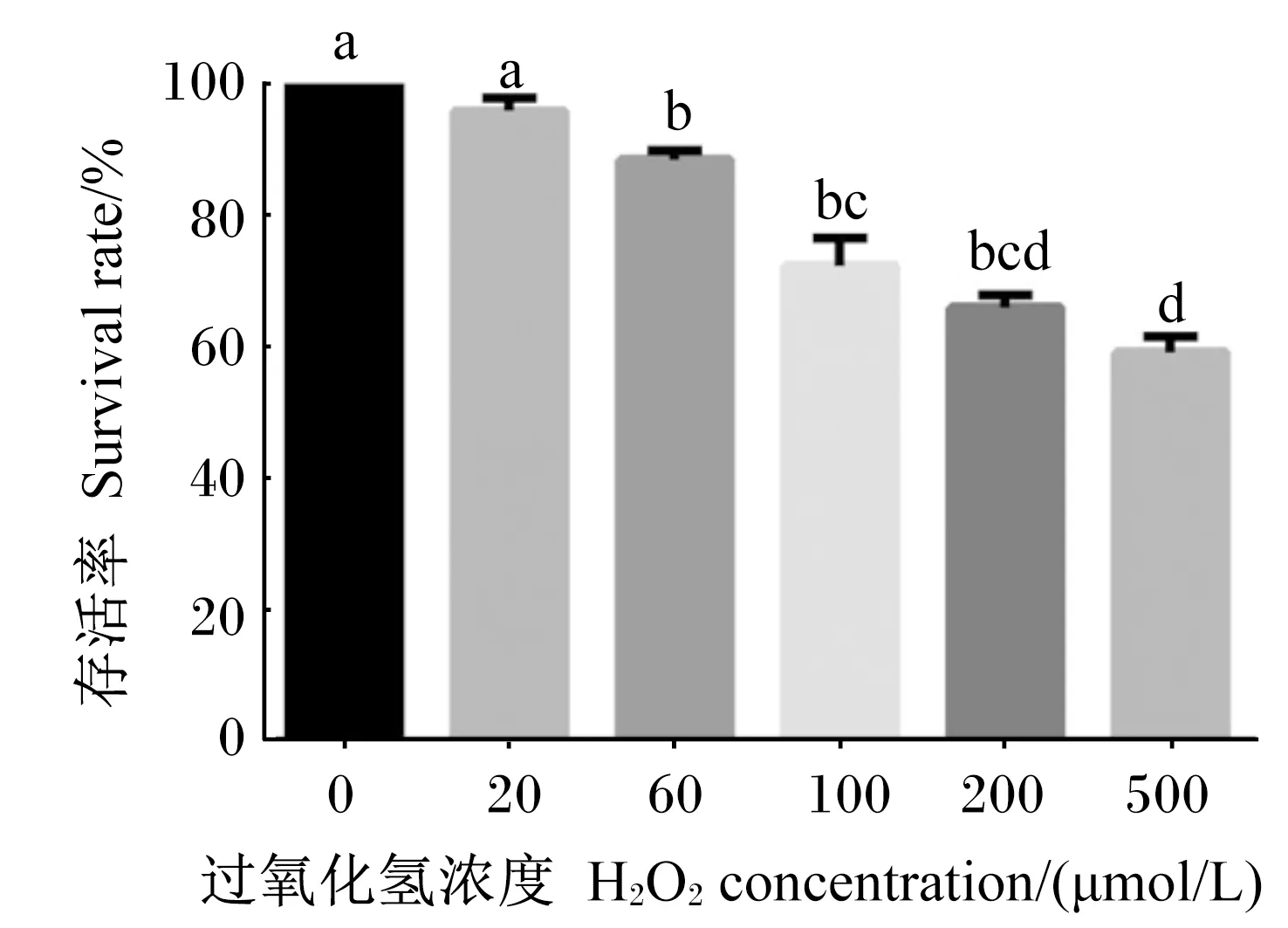
2.1 H2O2对BMECs存活率的影响
H2O2诱导BMECs的存活率检测结果见图1。H2O2降低了BMECs的存活率,当H2O2浓度超过20 μmol/L后,随着H2O2浓度的增加,细胞存活率显著降低(P<0.05)。其中,用500 μmol/L H2O2培养时细胞存活率为59.13%,因此,选择H2O2的适宜浓度为500 μmol/L。
2.2 MLP对BMECs存活率的影响
如图2所示,在前4种浓度下,细胞存活率无明显下降趋势,当MLP浓度达到5 mg/mL时,细胞存活率显著下降(P<0.05),此时MLP浓度为细胞致死浓度,因此,选择MLP的适宜浓度为4 mg/mL。
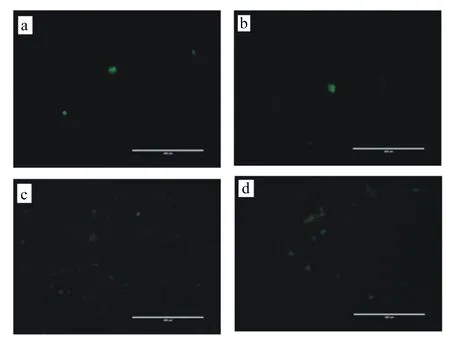
2.3 BMECs内ROS数量的检测
BMECs内ROS的检测结果见图3。根据ImageJ软件计算结果显示,对照组1和对照组2测到的荧光亮点分别为5和3个,损伤组为47个,保护组荧光亮点多于对照组而低于损伤组。
不同字母表示差异显著(P<0.05)。图2、图6同。
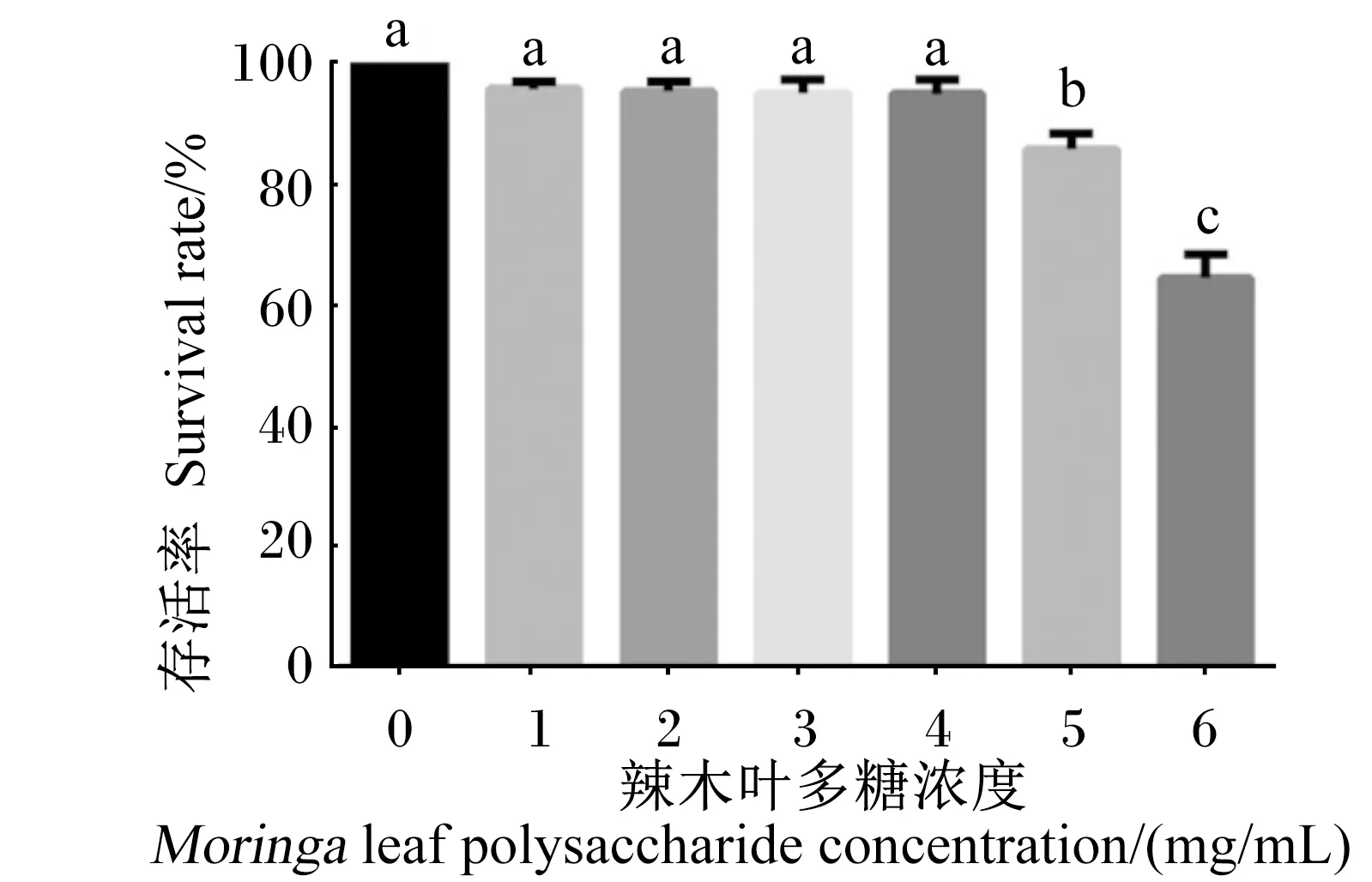
图2 MLP对BMECs存活率的影响
2.4 BMECs凋亡检测
由图4可知,对照组1和对照组2的蓝色荧光点呈现规则的圆形或椭圆形,表现为低强度荧光,为轻度凋亡现象(图4-a、图4-b中出现极少数破碎细胞可能是因为接种或染色过程中细胞出现死亡);而损伤组呈现较亮的荧光,并且由于细胞结构的破坏,导致光点形状发散且不规则;保护组圆形荧光亮点的数量与荧光强度弱于损伤组,但强于对照组1和对照组2,且图片中存在规则的圆形或椭圆形亮点和不规则形态的亮点。
2.5 不同处理下BMECs形态观察
如图5所示,对照组1和对照组2的细胞膜完整,核仁形态正常;而损伤组中细胞膜破裂、凋亡小体释放(箭头标注处为凋亡小体)、染色质浓缩并且核仁形态发生变化,标志着细胞发生凋亡;保护组中细胞核皱缩但未破裂,细胞形态发生改变,表现为中度凋亡的迹象。
a:对照组1;b:对照组2;c:损伤组;d:保护组。图4、图5同。
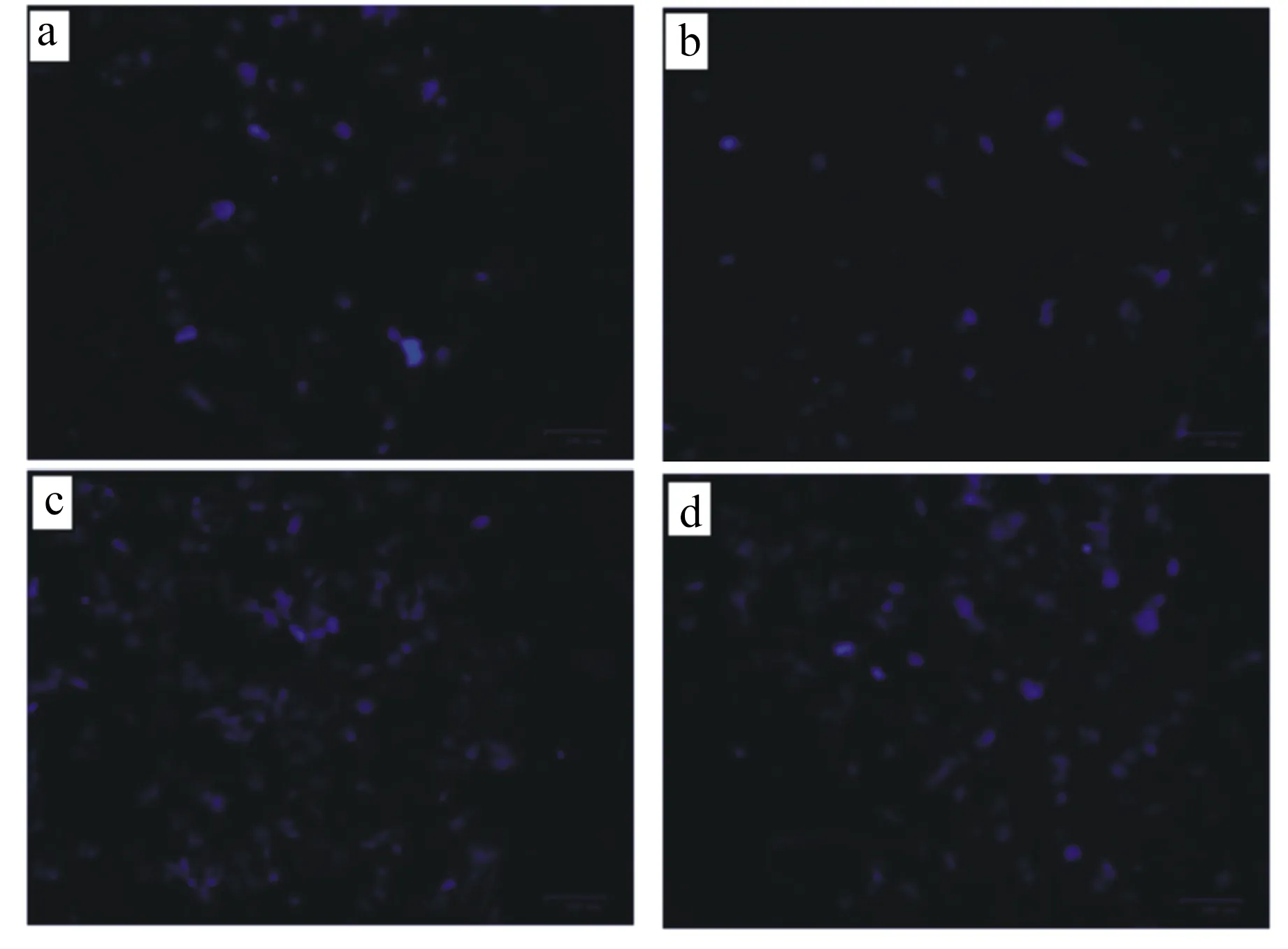
图4 BMECs Hoechst33258观察
2.6 BMECs中CAT、GSH-Px和SOD活性及MDA含量测定
如图6所示,对照组1和对照组2细胞中CAT、GSH-Px和SOD活性均较损伤组显著升高(P<0.05),而MDA含量显著降低(P<0.05)。保护组细胞中CAT、GSH-Px和SOD活性均显著低于对照组1和对照组2(P<0.05),但显著高于损伤组(P<0.05)。相反,保护组细胞中MDA含量显著高于对照组1和对照组2(P<0.05),但显著低于损伤组(P<0.05)。
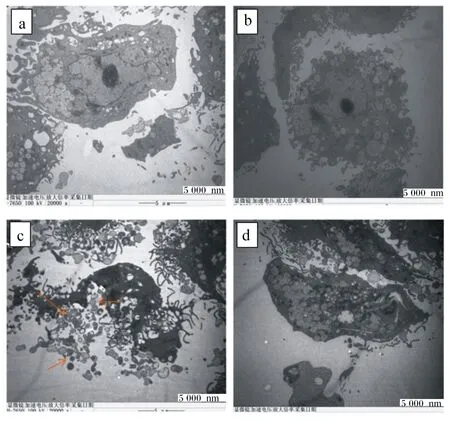
图5 投射电镜下BMECs的观察
3 讨 论
3.1 H2O2和MLP适宜浓度的筛选
为进一步揭示MLP对BMECs的保护作用,本试验建立了氧化应激模型。细胞内ROS的过量产生是发生氧化应激的重要因素,其主要物质为一氧化氮(NO)、H2O2和羟基自由基等[19],由于H2O2性质相对稳定、操作简便且容易获得,因此选用H2O2作为氧化剂建立氧化应激模型[20]。氧化应激模型普遍选用的细胞存活率在50%~70%,一方面可以避免细胞氧化应激不明显,而影响试验的准确性,另一方面可防止由于细胞存活率过低而发生不可逆损伤[21],使细胞大量死亡,这可能会导致MLP的保护作用失效。本试验中,当H2O2浓度为500 μmol/L、诱导时间为2 h时,细胞存活率为59.13%,满足氧化应激模型的建立条件。MLP虽然营养价值和药用价值极高,但其使用浓度尚未完全了解。有研究指出,当植物多糖超过一定浓度后,会对细胞生长产生抑制作用[22],例如,当黄芪多糖浓度为2.5 mg/mL时,对人静脉内皮细胞凋亡无明显影响,但当浓度达到5 mg/mL时,会导致细胞凋亡[23]。因此我们需要对MLP的作用浓度进行筛选,确定MLP的适宜浓度,本试验结果发现4 mg/mL的MLP溶液为适宜浓度,对BMECs无不良影响。
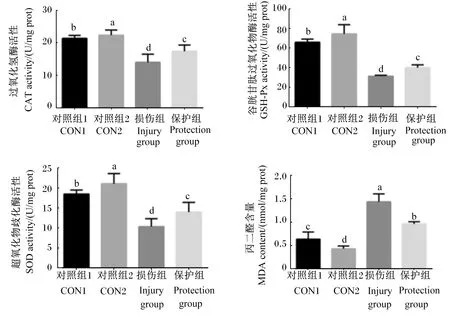
图6 BMECs中CAT、GSH-Px、SOD活性和MDA含量的测定
3.2 MLP对BMECs凋亡的影响
BMECs发生氧化损伤后,其生物膜系统遭到破坏,细胞中的核酸、DNA等生物大分子受到攻击,最终导致细胞凋亡[24],表现为细胞质中线粒体模糊、细胞内染色质明显浓缩[25]、细胞破裂并出现凋亡小体[26]。Hochest33258是一种蓝色荧光染料,能穿透细胞膜,在荧光显微镜下使活细胞呈现出深蓝色、规则的圆形或椭圆形[27],而在凋亡过程中,细胞核变得凝集并呈现出明亮且不规则的蓝色形状[28]。在透射电镜下,发生凋亡的细胞形态发生改变甚至破裂,并且出现凋亡小体[26]。本试验Hochest33258细胞凋亡检测和透射电镜结果显示,保护组的荧光亮点明显多于损伤组并少于对照组1和对照组2,在透射电镜下损伤组细胞破裂,形成大小不等的凋亡小体,而保护组细胞形态虽然发生改变,细胞体积缩小、核膜不清、核染色质分布密集,细胞内出现空泡状物质,但并未出现破裂的现象,其原因可能是MLP通过减少ROS的生成减缓细胞凋亡[29]。本研究结果说明MLP具有减缓细胞凋亡的作用。
3.3 MLP对BMECs抗氧化能力的影响
在奶牛泌乳期,由于泌乳的需要,奶牛乳腺组织需要大量的能量维持其生理活动,导致其细胞代谢迅速,进而加大ROS的产生。ROS是评价机体氧化损伤程度和自由基攻击程度的重要指标[30],当其产生速度大于抗氧化剂的清除速度时,过量的ROS会攻击核酸主链、破坏氢键并阻止生物蛋白质聚合,引发细胞发生氧化应激反应,从而导致其代谢功能紊乱、衰老甚至凋亡[31],最终危害奶牛健康和泌乳能力[32],同时,过量的ROS产生会导致不饱和脂肪酸积累,最终生成MDA[33],MDA的含量间接体现了机体的氧化损伤程度[22]。当机体内ROS大量产生时,抗氧化酶便会起到防御作用,消除过多的ROS,以维持机体正常生理功能[34]。因此,CAT、GSH-Px和SOD的活性反映了机体清除ROS能力[34]。
植物多糖是植物中重要的活性成分,可有效清除羟基自由基[35],并减缓或抑制脂质过氧化反应,对脂质过氧化反应产生的ROS有很强的清除能力,能够增强机体抗氧化能力[33]。此外,有研究表明,许多植物多糖具有提高机体CAT、GSH-Px和SOD活性的能力,同时能够减少MDA的生成[36]。例如,黄芪多糖可有效提高罗曼雏鸡血清中CAT、GSH-Px和SOD活性,并且降低了MDA含量[37]。在BMECs内ROS的检测结果发现,添加MLP可降低H2O2处理的BMECs中ROS的数量;在试剂盒检测结果中发现,损伤组细胞CAT、GSH-Px和SOD活性显著低于保护组,而MDA含量显著高于保护组。其原因可能是MLP通过羟基与二价铁离子(Fe2+)等金属离子发生络合并清除脂质过氧化反应链中产生的ROS,从而中断脂质过氧化反应的进行,提高抗氧化酶活性且减少脂质过氧化产物MDA的产生[38]。
以上研究结果表明MLP具有减缓或抑制细胞内ROS产生的功能,并对细胞的氧化损伤具有保护作用。
4 结 论
MLP缓解了氧化应激对BMECs造成的损伤,增强了细胞的抗氧化能力,因此,MLP具有作为饲料添加剂应用于奶牛生产的潜力。

