DiGeorge综合征伴生长激素缺乏症1例报告并文献复习
苟 鹏,程昕然,鄢 力,李中会,冷 洁,何卫兰,苏 娜,唐 芳,龚春竹,许 珂
(成都市妇女儿童中心医院儿童内分泌遗传代谢科,四川 成都 610074)
1病例资料
1.1基本情况
患儿,女,5岁5月龄,系“发现生长迟缓,智力发育落后5年余”,于2019年11月就诊于成都市妇女儿童中心医院儿童内分泌遗传代谢科。出生后,婴儿的身长和体重都低于同年龄同性别的儿童,并伴有语言发育迟缓和智力发育迟缓,特殊面容(见图1)。现患儿年生长速度约2~4cm/年。患儿为足月剖宫产(母孕期患妊娠期糖尿病、神经纤维瘤病),产重1.6kg,否认窒息史,6月龄因“室间隔缺损”行“瓣膜修补术”,3岁时行“腭裂修补术”,平素易患“感冒”。患儿父亲身高165cm,母亲身高147cm。该患儿的监护人知情同意自愿参与研究。

注:该患儿的监护人知情同意自愿参与研究。
1.2体格检查
患儿体温36.2℃,呼吸32次/分,脉搏98次/分,血压96/62mmHg,身高91cm(P3=102.9cm,身高Z评分为-3.2),体重10kg(P3=15.0kg,体重Z评分为-3.4),身高百分位曲线见图2。其中身高监测方法为晨9至10时,同一身高测量仪,患儿两脚并拢,脚尖成65°,头、肩、臀、腿四点一致靠测量仪站立,双耳下缘与双眼下缘保持一线,读取数据并记录。查体:皮肤无黏液性水肿,对答问题组织语言多用单字或双字节。下颌小,牙齿排列异常,左眼内斜视,眼间距离正常,耳位正常,鼻梁未塌陷,腭弓低,背部发际正常。无颈璞,无盾状胸,无肋缘外翻,四肢长骨不弯曲,腹部柔软,胸前剑突偏左可见陈旧手术瘢痕,双乳B1(Tanner分期),乳腺间隙正常,心肺听诊未见异常,肝脾未扪及,腋窝浅表淋巴结及腹股沟淋巴结未见肿大,外阴幼稚,外阴形态无异常,左右肢体对称。
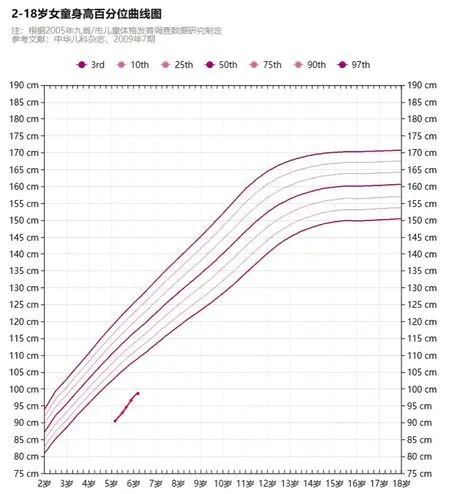
图2 患儿身高的百分位曲线
1.3辅助检查
该患儿的辅助检查结果见表1。

表1 部分辅助检查结果
1.4基因检测
结合患儿身高位于同年龄、同性别3个标准差以下,智力障碍、特殊面容、先天性心脏病、腭裂等多系统异常,临床考虑有遗传性疾病可能,根据患儿病史、临床表型、体格检查对患儿评分,评估结果临床不支持Sliver-Russell、Noonan、Turner综合征,建议行基因检测。在征得患儿家属知情同意后,抽取患儿静脉血2mL送本科检测。检测步骤:①取患儿静脉血2mL,EDTA抗凝剂,分全血230μL,提取基因组DNA;②基因组DNA片段化;③DNA小片段文库构建;④使用仪器为Llumina NextSeq 550AR测序平台进行测序;⑤数据比较与计算。将高通量测序结果与软件进行比较,每个测序Reads与其染色体匹配(参考基因组样本:GRCh37),然后进行相应的标准化Z值分析,通过Z值确定染色体异常,检索参考拷贝数变异(copy number variation,CNV)数据库,包括OMIM、DECIPHER、ISCA、DGV及GeneCards,分析样本是否存在致病性CNV。患儿高通量测序染色体异常检测结果见图3,显示该患儿22q11.21—22q11.23存在1.95Mb缺失(chr22:g.21900005-23850004del)。

图3 儿童染色体异常检测报告
数据库及文献显示:该片段包含RIMBP3B、RIMBP3C、UBE2L3等几十个基因或片段。该片段与DiGeorge综合征(22q11.2 distal deletion syndrome)有关,此综合征的症状包括外形特殊、智力发育迟缓、身材矮小、胸腺发育不良、先天性心脏畸形等。
1.5诊断、治疗及随访
本病例依据高通量染色体报告及生长激素激发试验结果,诊断为DiGeorge综合征伴生长激素缺乏症。每晚睡觉前皮下注射重组人生长激素,剂量为0.13mg·kg-1·w-1,出院后第3、6、9、12月本科门诊随访身高共增长12.8cm,随访时间和项目是按照2013年中华医学会儿科内分泌与遗传代谢学组制定的《基因重组人生长激素儿科临床规范应用的建议》执行,项目包括身高、体重、骨骼年龄、空腹血糖、空腹胰岛素、甲状腺功能、胰岛素样生长因子-1(insulin-like growth factor 1,IGF-1)、IGF-BP3。
2文献复习
以“DiGeorge综合征,生长激素缺乏症”为关键词检索中国期刊全文数据库(CNKI),以“DiGeorge syndrome,growth hormone deficiency”为关键词检索PubMed,时间均从建库至2020年5月31日。共检索英文文献3篇,报道7例患DiGeorge综合征伴生长激素缺乏的儿童[1-3]。结合本病例,所有患儿的临床特点及生长发育情况见表2,临床主要表现均为生长发育迟缓,同时存在心血管畸形(如法洛四联症、室间隔缺损、主动脉弓分离、肺动脉瓣闭锁、主动脉异位等)、顽固性低钙、矮小、智力障碍,多数伴有免疫功能异常的表现,包括反复感染、慢性中耳炎、慢性鼻窦炎、T细胞缺失、甲状旁腺功能减退等;面部特征异常主要表现为腭裂、唇裂、小嘴、双眼小、双眼距离宽、鼻梁宽、鼻头突出、鼻管狭窄、耳小、耳垂缺失、下颌小[4]。

表2 患儿临床特征和生长发育情况表
3讨论
3.1发病机理
DiGeorge综合征1965年由DiGeorge首次报道并命名,又称22q11.2微缺失综合征,是一种遗传基础上在22号染色体的长臂缺失3Mb的片段,发病机理是在胚胎发展的6~8周第3、4对咽囊发育障碍引起的胸腺和甲状腺发育不全。其临床表型不同,表现也不同,以不同的临床特征命名,如DiGeorge syndrome(DiGeorge syndrome,DGS)、Vellar-heart-surface综合征(VCFS)、圆锥动脉干-异常面容综合征(conotruncalanomaly face syndrome,CAFS)等[5]。人群中发病率为1:4 000[6]。这种疾病是常染色体显性遗传,93%的祖细胞突变是denovo,患病个体22q11.2缺失遗传给子代的概率为50%[7]。
3.2临床表型
随着分子机制的发现,越来越多非典型病例被报道,统计约超过180种临床表现被报道[8-9],涉及系统广泛,如甲状旁腺功能下降、甲状腺功能减退、甲状腺功能亢进、心脏和大血管的结构异常、矮小、低智商、胸腺发育不良、严重的免疫缺陷、低钙性抽搐、唇腭裂和语言发育障碍[10]、精神障碍、特殊的外观、畸形(肾脏、眼睛、骨骼和喉咙)、听力损失等[11]。较少见的临床表现包括生殖泌尿系统异常、视觉缺陷、垂体异常等[7],其中垂体先天发育异常是致使生长激素缺乏和/或胰岛素生长因子-1缺少的主要原因。
DiGeorge综合征是一种发病率较高的遗传综合征。由于其临床表型多样,患儿在儿童内分泌遗传代谢科、心脏内科、免疫科、危重症医学科被识别,且没有统一的诊断指南和共识。DiGeorge综合征临床可分为完全型、部分型[12]、Ⅲ-Ⅳ咽囊和DiGeorge异型综合征,不同类型预后不同。完全性DiGeorge综合征定义为胸腺或外周血T细胞缺乏,常伴有严重感染,临床表现类似于严重免疫缺陷,发病率低、死亡率高。目前,大多数临床报道为部分型DiGeorge综合征。本科室报告的此例患儿有特殊面容、腭裂、眼发育畸形、先天性心脏病史、生长迟缓、智力落后,患儿甲状腺功能正常、血钙正常、T细胞亚群正常,基因检测显示存在22q11.21微缺失,应为部分型(残存有胸腺组织,无明显免疫缺陷)。
DGS患儿根据临床表型,依靠基因技术不难诊断。现有学者指出在不符合临床诊断标准的前提下,亦因考虑到DiGeorge综合征可能,荧光原位杂交(fluorescent in situ hybridization,FISH)方法是诊断的金标准[13]。2011年,廖灿等[14]运用微阵列比较基因组杂交技术诊断了1例产前DiGeorge综合征,提示该综合征的诊断年龄已经扩展到胎儿医学。
3.3合并生长激素缺乏的可能机制
文献报道DiGeorge综合征45%的患儿有矮小症的临床表型[15],矮小症以前被认为是由免疫缺陷、心脏病和儿童甲状腺功能减退引起。近年来在一些患儿中有生长激素缺乏的报道[16],并认为生长激素治疗可改善此类儿童的成年身高,指出此综合征伴进行性生长衰减的患儿,应重视生长轴的评估及垂体影像学检查[17]。
脑垂体是人体内分泌腺的“统帅”,它的组织学起源来自原始外胚层叶片顶部凸起的颊囊和第三脑室底部发育向下的间脑底部小泡的结合。颊囊的下端形成垂体管(颅咽),它与嘴的顶部通过头骨的封闭分离,故垂体的解剖位置同胸腺、甲状腺、甲状旁腺,亦处于面中部,且有相近的胚胎起源。DiGeorge综合征是由于基因片段缺失致使胚胎发育的第6周至第8周咽喉上皮囊胚发育障碍[4],而咽喉上皮囊胚为垂体的胚胎起源。因此,推测DiGeorge综合征生长激素缺乏的可能机制是垂体发育不良和垂体前叶生长激素分泌不足。无矮小表型的DiGeorge综合征患儿是否无垂体解剖结构异常还需多样本例数的观察及对比。此患儿垂体MRI测值偏小,是否因胚胎发育过程中垂体发育不良,致生长激素分泌不足,待证据支撑。
3.4治疗中的监测随访
本科报道此例DiGeorge综合征并生长激素缺乏症,为DiGeorge综合征患儿内分泌靶腺的评估提供了新的思路。此综合征患儿除关注甲状腺轴及甲状旁腺轴,亦应重视生长轴及垂体影像学评估,是否此类患儿还需进行其他靶腺,如肾上腺轴的评估、青春期时性腺轴的评估,需要未来进一步考虑。治疗上因DiGeorge综合征多有甲状腺功能异常,在运用基因重组人生长激素改善身高治疗后,临床医师应重视甲状腺功能的随访、影像学评估及长期安全性。
3.5重视矮小症遗传背景分析
“矮小”为临床表型的儿童,如合并一种或多种下述异常临床表型:特殊面容、骨骼发育畸形、智力发育落后、性腺发育异常,不能只凭借于生长激素激发试验结果,做出诸如“生长激素缺乏症”或“特发性矮小”的诊断,而应重视此类患儿的遗传背景分析,追根溯源,争取找到多种临床表型的真正原因。
- 中国妇幼健康研究的其它文章
- 儿童慢性肉芽肿合并反复肺部感染1例报告
- 中日两国水痘及其疫苗接种管理的比较与启示

