腹腔镜脾切除治疗门静脉高压症及术后并发症的危险因素分析
蒋富兵,卢锦君
(惠州市第三人民医院普外一区,广东 惠州 516002)
门静脉高压症在临床肝胆外科中较为常见,以门静脉压力上升为主要特征,伴有血流动力学异常改变,容易降低患者的健康水平,甚至因为出现肝功能亢进症、腹腔积液、肝衰竭等并发症威胁到患者的生命安全[1]。腹腔镜脾切除术是治疗门静脉高压症的主要方法,在临床上已被广泛应用,能够有效降低门静脉压力,纠正脾功能亢进症,进而促进肝功能的恢复正常[2]。腹腔镜技术融入了微创理念,可有效减轻对患者的创伤,缩短术后恢复的时间,但是术后并发症仍旧存在,导致术后的恢复速度和效果受到影响,而降低术后并发症的关键在于并发症发生因素的分析,从危险因素着手给予重点防治[3]。本研究采用回顾性分析法,纳入2018年1月~2019年2月期间在我院接受腹腔镜脾切除术治疗的90例门静脉高压症患者,针对术后并发症的发生情况及其影响因素进行分析。现报告如下。
1 资料与方法
1.1一般资料:回顾性分析2018年1月~2019年2月我院收治的行腹腔镜脾切除术治疗的90例门静脉高压症患者的临床资料,其中乙型肝炎(乙肝)肝硬化63例,酒精性肝硬化20例,其他肝硬化7例。全部患者中,男48例,女42例;年龄23~78岁,平均(56.93±4.27)岁;体重指数18~26 kg/m2,平均(20.31±2.75)kg/m2;脾脏直径18~45 cm,平均(24.61±3.20)cm。
纳入标准:①符合肝硬化门静脉高压症的诊断标准;②满足腹腔镜脾切除术的手术指征,白细胞计数<3×109/L或血小板计数<30×109/L;③无药物成瘾或滥用史;④签署手术知情同意书;⑤经医院伦理委员会批准。
排除标准:①其他类型门静脉高压症(肝前性或肝后性);②合并严重内科疾病;③伴有精神异常和认知障碍;④肝功能为Child-Pugh C级[4];⑤临床资料不完善者。
1.2方法
1.2.1全腹腔镜脾切除术:行气管插管全身麻醉,取仰卧位,保持头高脚低右侧倾斜姿势。实施四孔操作法,利用腹腔镜对腹腔进行全面探查,离断脾脏周围韧带,充分游离脾脏。将脾门充分暴露在视野中,使用直线切割闭合器离断脾蒂。取脾脏并保存于标本袋,通过剪刀剪碎脾脏并分块取出。观察是否出现活动性出血,检查周围脏器是否出现副损伤,术闭后脾窝放置引流管。
1.2.2手助式腹腔镜脾切除术:行气管插管全身麻醉,取仰卧位,保持头高脚低右侧倾斜姿势。于剑突下正中行一切口,长度约5 cm,从切口置入手助器,建立二氧化碳气腹,余下操作同全腹腔镜脾切除术。若患者既往有上消化道出血史或胃镜证实食管胃底静脉曲张达中重度,则联合行贲门周围血管离断术。
1.3评估因素
1.3.1并发症分级:观察术后1个月内的并发症情况,主要有出血(腹腔出血、上消化道出血等)、腹腔积液、肺部感染、肝衰竭等,计算并发症的发生率,分析并发症的分级情况。根据Clavien术后并发症诊断和分级标准[5],将术后并发症分为1~5级,其中1级和2级为轻度,3级为中度,4级和5级为重度。若患者合并多种并发症,只记录并计算最高级别的并发症。
1.3.2观察指标:分析对比术后发生并发症和未发生并发症患者性别、年龄、体重指数、脾脏直径、ASA分级、Child-Pugh分级、术前实验室检查指标(总胆红素、白细胞计数、血小板计数)、手助器使用、手术时间、术中出血量、贲门周围血管离断术使用等单因素情况。采用Logistic多因素回归分析术后并发症的独立危险因素。
1.4统计学分析:采用SPSS18.0软件处理数据。通过方差分析进行计量资料数据正态分布组间比较,行χ2检验;利用Kruskal-Wallis检验进行偏态分布组间比较。独立危险因素分析采用Logistic多因素回归分析法。若P<0.05表示差异有统计学意义。
2 结果
2.1术后并发症的发生情况分析:总共90例门静脉高压症患者,均顺利完成腹腔镜脾切除术治疗。术后1个月内,发生并发症15例,并发症发生率为16.67%。并发症类型方面,腹腔出血2例,上消化道出血1例,腹腔积液4例,肺部感染5例,门静脉血栓形成1例,肺不张1例,肝衰竭1例。并发症级别方面,1级占比13.33%(2/15),2级占比33.33%(5/15),3级占比20.00%(3/15),4级占比20.00%(3/15),5级占比13.33%(2/15)。见表1。
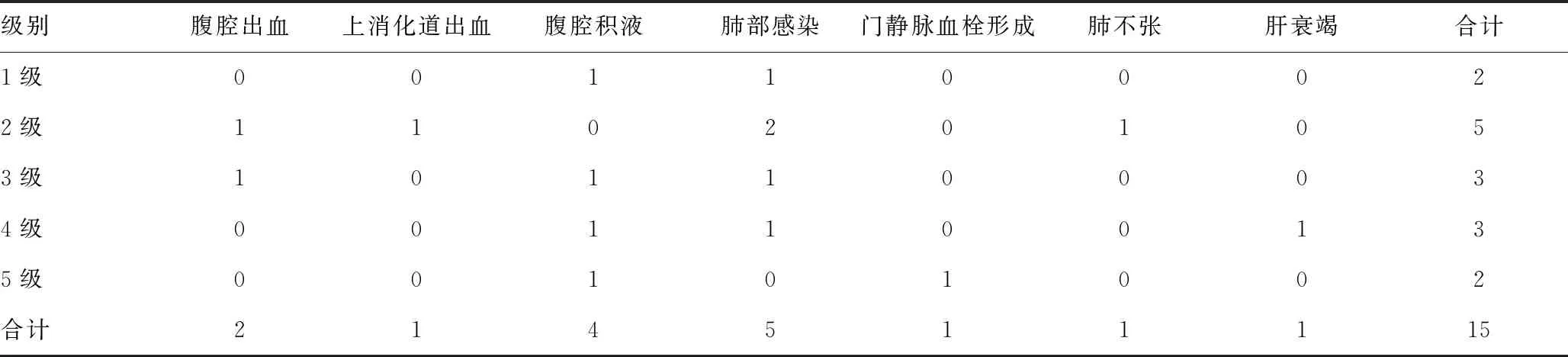
表1 术后并发症的发生情况分析(例)
2.2术后并发症单因素情况分析:在ASA分级、Child-Pugh分级、是否使用手助器方面,术后发生并发症和术后未发生并发症的患者相比较,差异有统计学意义(P<0.05)。在性别、年龄、体重指数、脾脏直径、术前实验室检查指标、手术时间、术中出血量方面,术后发生并发症和术后未发生并发症的患者相比较,差异无统计学意义(P>0.05)。见表2。

表2 术后并发症单因素情况分析
2.3术后并发症多因素情况分析:将发生术后并发症视为因变量,各项单因素视为自变量,行Logistic多因素回归分析显示,ASAⅢ级、Child-Pugh B级、未使用手助器是腹腔镜脾切除术患者术后并发症的独立危险因素(P<0.05)。见表3。
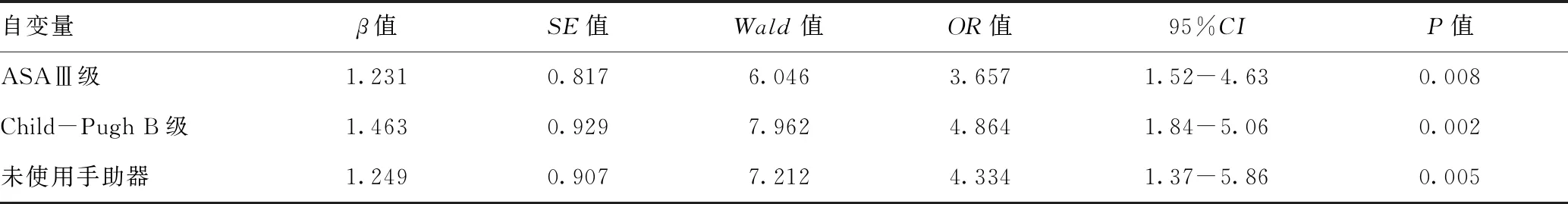
表3 术后并发症多因素情况分析
3 讨论
目前,随着腹腔镜技术的不断发展和应用,以及手术治疗微创理念的不断融入和深入,肝硬化门静脉高压症的手术治疗中,常采用腹腔镜脾切除术的手术方法,该术式的应用可有效改善患者的病情,缓解疾病症状表现,促进患者肝功能的恢复,以此帮助患者重新恢复健康。但是有研究报道认为,腹腔镜脾切除术治疗肝硬化门静脉高压症也存在一定的局限,特别是术后并发症的出现,会极大地影响手术的效果和患者的术后安全,而这也得到了临床实践的证实,并且被欧洲内镜外科学会视为腹腔镜脾切除术的禁忌证之一[6]。本研究中,对90例肝硬化门静脉高压症患者实施腹腔镜脾切除术,术后实施1个月的随访和观察发现,出现了15例并发症,并发症发生率为16.67%,主要以腹腔积液和肺部感染为主,这与临床相关报道类似。因此,必须加强对腹腔镜脾切除术治疗术后并发症的预防,而对其诱发因素的分析显得至关重要。
本研究结果显示,ASAⅢ级、Child-Pugh B级、未使用手助器是腹腔镜脾切除术患者术后并发症的独立危险因素(P<0.05)。研究表明,ASA分级与术后并发症有着密切的联系,也是手术实施的主要禁忌证之一[7]。一般而言,ASA分级较高的患者,合并多个器官功能不全的可能性比较高,肝硬化门静脉高压症患者往往合并肝脏、肾脏以及肺部等器官功能衰退,由此增加了术后并发症的可能。Child-Pugh 分级是评定肝硬化患者严重程度的重要标准,通常情况下Child-Pugh C级患者不适宜手术,而Child-Pugh A级和部分B级患者适宜手术治疗。因此,相较于Child-Pugh A级患者,Child-Pugh B级患者发生并发症的可能性更高。手助器的应用,其目的在于提升手术的效果,将其应用在手术治疗中,能够减轻手术造成的创伤,促进术后恢复,也可减少并发症的发生[8]。肝硬化门静脉高压症患者,在实施腹腔镜脾切除术时,因为操作的空间比较有限,再加上患者往往合并脾周围血管曲张,这就进一步延长了手术时间,增加了术中出血量,因而增加术后并发症的风险。
综上所述,腹腔镜脾切除术治疗门静脉高压症,术后发生并发症的可能性比较大,主要集中在ASAⅢ级、Child-Pugh B级、未使用手助器等情况患者中,因而要重点做好预防工作,减少术后并发症的发生。

