黑木耳发酵产物对HepG2细胞脂质代谢及糖代谢的影响
孙凯峰,包怡红
(东北林业大学林学院 哈尔滨150040)
随着现代人们生活水平的不断提升,高血脂症及高血糖症成为威胁人类健康的两大流行疾病。高血脂症的出现与脂质代谢异常密切相关,除遗传因素外,高脂高热量食物的摄入,过量饮酒与缺乏锻炼等不健康的生活方式使得血脂异常症状的患病率逐年上升[1]。据统计,我国血脂异常人群达1.6 亿以上[2]。由高血脂症引发的脑血栓、心肌梗塞以及冠心病等一系列心脑血管疾病,更是威胁人类生命健康的重要因素。而高血糖症同样是威胁人类健康的杀手,以高血糖继发的脂肪、蛋白质、电解质紊乱为特征,高血糖症会引发糖尿病。糖尿病患者典型的症状为多饮、多食、多尿以及消瘦[3]。糖尿病对人类健康威胁极大,可导致病人心脏病变,肾功能衰竭进而致死、致残[4]。截至2017年,全世界糖尿病患者数目共4.25 亿,我国人口基数较大,糖尿病患者人数逾4 700 万,据估计,到2045年,全世界糖尿病患者数目将达7 亿,且大部分集中在发展中国家[5]。高血脂症与高血糖症相互关联,高血糖症导致的糖尿病会导致糖尿病人体内胰岛素含量降低,进而导致体内脂酶活性降低,血脂增高。糖尿病还会使病人体内游离脂肪酸从脂肪库中动员出来,使血液中甘油三酯及游离脂肪酸浓度升高。而高脂血症除引发肥胖症、脂肪肝外,还是引发糖尿病的关键因素[6]。
黑木耳(Auricularia auricular)具有降血脂,降血糖,抗癌等作用,可作为药材在临床中使用,在食品和药品领域受到广泛关注[7]。刘荣等[8]发现黑木耳中的多糖能够显著降低小鼠体内TC 与TG的含量。张燕燕等[9]提出黑木耳中含有的多糖及膳食纤维等营养物质能够调节人体内的糖代谢,促进肝糖原合成,发挥降血糖作用。课题组前期研究发现,双歧杆菌与面包酵母混合发酵能够显著提升黑木耳的降血脂功能特性[10],分析发酵液所含成分,发现发酵液中的主要成分为多糖类物质,还含有还原糖、多酚以及黄酮类物质。本试验通过活性跟踪法,将黑木耳发酵产物按分子质量进行分级,以HepG2 细胞作为研究载体,对降血脂与降血糖功能差异进行验证,分析HepG2 细胞中的总胆固醇、总甘油三酯、葡萄糖、肝糖原含量及总脂酶、己糖激酶活性变化,研究不同分子质量黑木耳发酵产物降血脂及降血糖功能特性的变化,为黑木耳功能性产品的开发提供理论基础。
1 材料与方法
1.1 材料与试剂
黑木耳,黑龙江省大兴安岭地区加格达奇林业局提供,经黑龙江省科学院微生物研究所张丕奇研究员鉴定为木耳(Auricularia auricular(L.ex Hook.) Underwi)的干燥子实体;人肝癌细胞系HepG2 细胞株,东北林业大学实验室提供。
DMEM 培养基,通用电气医疗集团生命科学部;胎牛血清(FBS),浙江天杭生物科技股份有限公司;二甲基亚砜(DMSO),天津市寰宇精细化工有限公司;噻唑兰(MTT)、油红O、胰蛋白酶、青链霉素混合液,北京博奥拓达科技有限公司;蒽酮,上海化学试剂采购供应五联化工厂;TC、TG、总脂酶、总蛋白、葡萄糖、HK 测定试剂盒,南京建成生物工程研究所;其它试剂均为分析纯级。
1.2 仪器与设备
CKX4 倒置显微镜,奥林巴斯工业有限公司;Spetramax 2e 全自动酶标仪,美国MD 公司;超净工作台,北京亚泰科隆仪器技术有限公司;二氧化碳培养箱,美国赛默飞世尔科技有限公司;722 型可见分光光度计,上海光谱仪器有限公司;TGL-16G 离心机,上海安亭科学仪器厂;Satorius 超滤离心管Vivaspin 10 mL,北京赛多利斯仪器系统有限公司。
1.3 试验方法
1.3.1 不同分子质量黑木耳发酵产物的制备 采用双歧杆菌与面包酵母混合菌发酵黑木耳,菌种比例为2∶1,接种量为3%,发酵时间60 h,发酵温度30°C,获得黑木耳发酵上清液。采用超滤法分离出不同分子质量黑木耳发酵上清液,80 ℃恒温干燥,最终获得0~10,10~50,50~100,100~300 ku以及>300 ku 分子质量的黑木耳发酵产物,前期研究发现发酵产物中的主要成分为多糖类物质。
1.3.2 细胞培养 HepG2 细胞置于含有10%FBS,1%青链霉素混合液的DMEM 完全培养基中,37 ℃,5%CO2饱和湿度细胞培养箱中培养,隔天换液。对数生长期汇合度大于80%可以传代,4 mL PBS 清洗2 次,0.25%胰蛋白酶消化细胞10~15 min,至细胞脱离瓶壁,转移至离心管中,无菌针头吹至单细胞,以1∶3 的比例传代培养。取对数生长期细胞进行试验[11]。
1.3.3 细胞分组及处理 将1×105个/mL 的细胞悬液1 mL 接种到24 孔板中,采用油酸终浓度为1 mmol/mL 的培养基(100 μL 油酸溶于3.06 mL 0.1 mol/L 的NaOH 中,与10%PBS 溶液混合配成油酸浓度为10 mmol/L 的溶液,用含1%FBS 的DMEM 高糖培养基稀释至1 mmol/mL) 进行高脂模型的建立[12]。将HepG2 细胞分为5 组,分别为对照组(高脂模型组),0~10 ku 黑木耳发酵产物处理组(1~4 mL),10~50 ku 黑木耳发酵产物处理组(1~4 mL),50~100 ku 黑木耳发酵产物处理组(1~4 mL),100~300 ku 黑木耳发酵产物处理组(1~4 mL),>300 ku 黑木耳发酵产物处理组(1~4 mL),培养24 h 后做后续的细胞试验。
1.3.4 细胞存活率测定(MTT 法) 小心吸取培养后各孔培养液丢弃,加入含有MTT 的培养液1 mL(5 mg/mL MTT 溶液100 μL,900 μL 培养液),并设置空白调零组,继续培养4 h,终止培养。小心吸弃培养液,每孔加入150 μL DMSO,小心振荡10 min,使结晶物充分溶解。全自动酶标仪于490 nm 波长处测定其吸光值,来判断活细胞数量[13]。细胞存活率按式(1)计算。
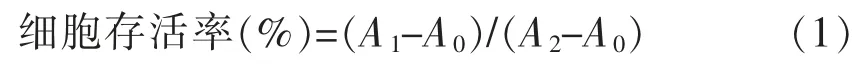
式中,A0——调零组的吸光度;A1——样品组的吸光度;A2——对照组的吸光度。
1.3.5 油红O 染色 小心吸弃培养液,2 mL PBS溶液清洗细胞,并吸弃PBS。加入2 mL 10%福尔马林溶液,室温放置10 min。换新的10%福尔马林溶液,室温放置1 h,吸弃福尔马林,以2 mL 蒸馏水清洗细胞2 次。加2 mL 60%异丙醇,室温放置5 min,吸弃异丙醇,室温放置或用电吹风小心吹干细胞。每孔加1 mL 油红O 工作液,室温放置10 min,弃去油红O,用1 mL 蒸馏水清洗细胞4 次,用显微镜观察染色情况;吸弃蒸馏水后,放置待细胞干。每孔加1 mL 100%异丙醇,轻柔摇晃10~15 min 使染剂溶解充分,以100%异丙醇调零,于500 nm 波长下采用分光光度计比色[14]。
1.3.6 TG 含量测定 小心吸弃培养液,2 mL PBS溶液清洗细胞,并吸弃PBS。0.25%胰蛋白酶消化细胞5~10 min,至细胞悬浮,转移至离心管中,1 000 r/min 离心10 min。弃去上清液,留细胞沉淀。加入0.2 mL PBS,冰水浴条件下超声破碎[15]。制备好的匀浆液用TG 试剂盒测定TG 含量。
1.3.7 TC 含量测定 匀浆液制备操作同1.3.6 节的方法,将制备好的匀浆液用TC 试剂盒测定TC含量[16]。
1.3.8 总脂酶(LPL+HL)活性测定 匀浆液制备操作同1.3.6 节的方法,制备好的匀浆液用总脂酶试剂盒测定总脂酶活性。
1.3.9 葡萄糖含量测定 匀浆液制备操作同1.3.6 节的方法,制备好的匀浆液用葡萄糖氧化酶法测定葡萄糖含量[17]。
1.3.10 肝糖原含量测定 匀浆液制备操作同1.3.6 节的方法,制备好的匀浆液用BCA 法蛋白浓度测定试剂盒测定蛋白含量,剩余的细胞匀浆液进行糖原含量测定,参照文献[18],稍加改进。细胞匀浆液以无水乙醇沉淀过夜,然后采用蒽酮法测定糖原含量,计算肝糖原含量。肝糖原含量按式(2)计算。

式中,C1——糖原浓度(mmol/mL);C2——蛋白质量浓度(mg/mL)。
1.3.11 HK 活性测定 匀浆液制备操作同1.3.6节的方法,制备好的匀浆液用HK 试剂盒测定HK活性。
1.4 数据分析处理
采用Origin 8.6 软件对数据进行处理及绘制,试验结果以平均值±标准误差(±s)表示,采用SPSS 20.0 软件进行相关性与显著性分析,P<0.05 具有显著性差异。
2 结果与分析
2.1 MTT 试验结果
不同分子质量和质量浓度的黑木耳发酵产物对正常HepG2 细胞存活率的影响如表1所示。由表1可知,黑木耳发酵产物分子质量和质量浓度的变化均不影响HepG2 细胞的活力,与空白组之间无显著差异(P>0.05),对细胞增殖无显著影响。根据后续细胞试验的要求及安排,发酵产物作用于HepG2 细胞时,既要保证其产生相应的功能特性,同时还应当不影响细胞正常的生长发育,以免影响试验结果的准确性[19]。因此选择表1中的5个分子质量,4 mg/mL 质量浓度作为之后试验的条件。
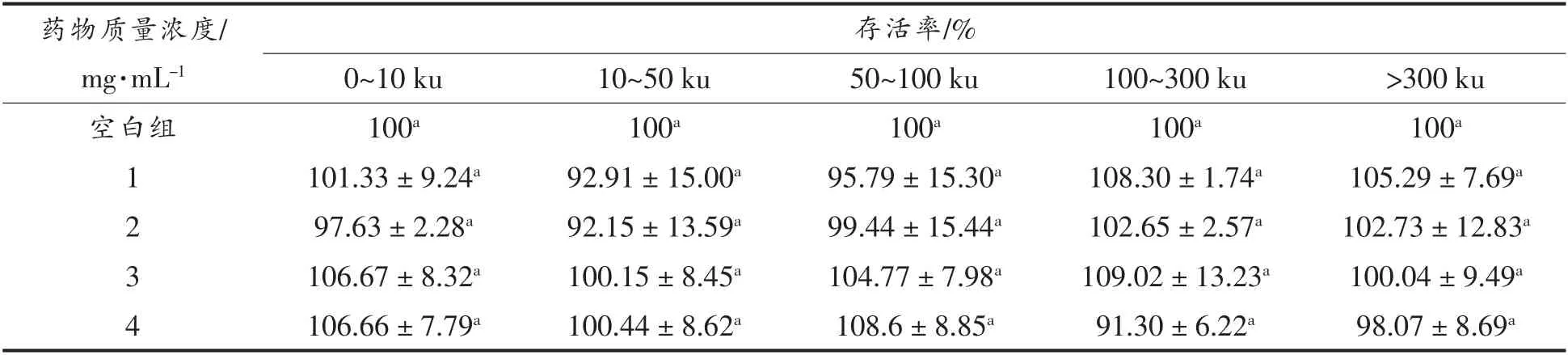
表1 MTT 试验细胞存活率Table 1 Cell survival rate of MTT experimental
2.2 油红O 染色与OD 值测定结果
图1为倒置显微镜下观察的细胞形态。经过油红O 染色的HepG2 细胞呈不规则的椭圆球型,边缘较粗糙,细胞间存在一定间隙,红色脂滴颗粒清晰,见图1空白组。通过添加不同分子质量黑木耳发酵产物作用于HepG2 细胞后,红色脂滴在不同程度上有所减少。油红O 染色OD 值测定结果见表2。由表2可知,不同分子质量黑木耳发酵产物对HepG2 细胞模型中脂质含量均有下调效果。下调模型中脂质含量变化较为明显的分子质量集中在100~300 ku 之间,其与10~50 ku 和>300 ku无显著性差异(P>0.05),与空白组及其它组之间差异显著(P<0.05)。由此可见,黑木耳发酵产物能够降低高脂细胞模型内的脂质含量,调节细胞脂质代谢。这可能与黑木耳发酵产物中的多糖类物质有关,覃玉娥等[20]通过研究发现竹节参多糖作用于HepG2 高脂模型细胞后,细胞内脂滴数明显减少,细胞肿胀减轻,对脂肪变性肝细胞起到了保护作用。
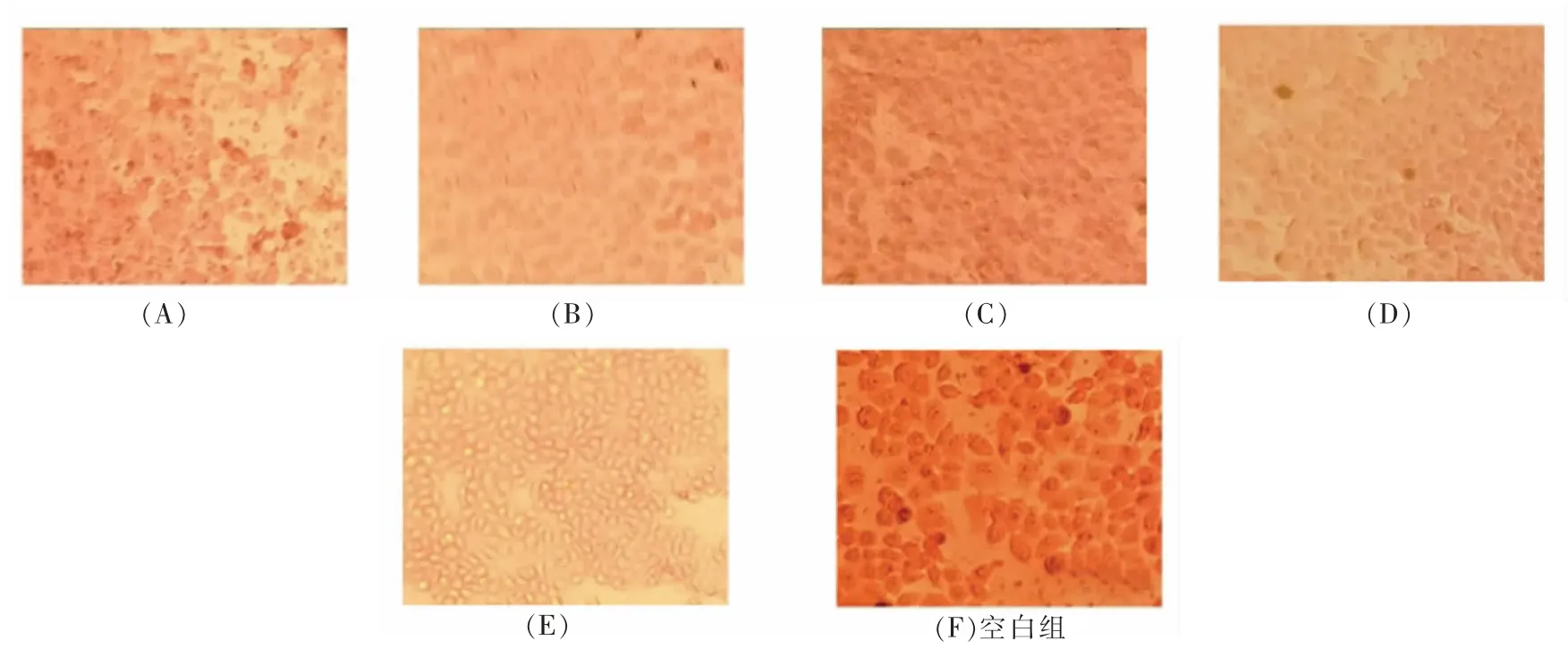
图1 油红O 染色后观察细胞内脂质含量Fig.1 Observation of intracellular lipid content by oil red O staining

表2 油红O 染色OD 值测定结果Table 2 Determination results of OD value by oil red O staining
2.3 不同分子质量黑木耳发酵产物对TG 含量的影响
由图2可知,不同分子质量黑木耳发酵产物作用于HepG2 细胞24 h 后,细胞内的TG 含量均下降。其中,对TG 含量影响最为明显集中在分子质量>300 ku,可达0.87 mmol/g 蛋白,其与空白组之间差异显著(P<0.05),与其它组之间无显著性差异(P>0.05)。栾淑莹[21]在黑木耳的研究中发现,黑木耳多糖能够有效抑制高脂模型小鼠血清内TG 含量的升高,加速水解脂质和水溶性底物,调节甘油三酯代谢,并与高脂组差异显著(P<0.05)。黑木耳发酵产物对TG 含量的影响可能是由于发酵产物中的多糖组分在起作用,且较高分子质量的黑木耳发酵产物作用于HepG2 细胞后使TG 含量更低。

图2 不同分子质量黑木耳发酵产物对TG 含量的影响Fig.2 Effect of fermentation products of A.auricular with different molecular weights on TG content
2.4 不同分子质量黑木耳发酵产物对TC 含量的影响
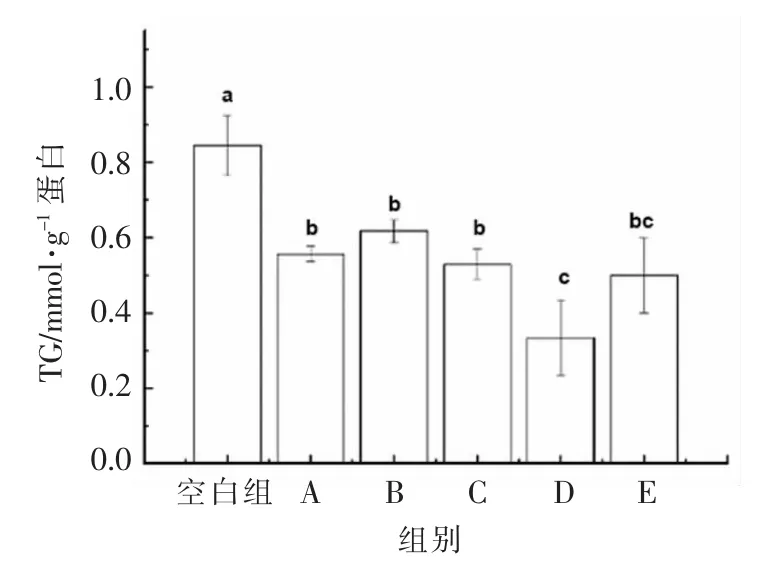
图3 不同分子质量黑木耳发酵产物对TC 含量的影响Fig.3 Effect of fermentation products of A.auricular with different molecular weights on TC content
由图3可知,不同分子质量黑木耳发酵产物作用于HepG2 细胞24 h 后,细胞内的TC 含量均下降。其中,对TC 含量影响最为明显的分子质量集中在100~300 ku 之间,可达0.34 mmol/g 蛋白,其与E 组之间不存在显著性差异(P>0.05),与空白组以及其它组之间差异显著(P<0.05)。于美汇等[22]研究发现,黑木耳中的酸性多糖可以明显降低高血脂症小鼠的总胆固醇水平,达到降低小鼠血脂水平的目的。这与黑木耳发酵产物对TC 水平调节的研究结果相吻合,且较高分子的黑木耳发酵产物作用于HepG2 细胞后使TC 含量更低。
2.5 不同分子质量黑木耳发酵产物对总脂酶活性的影响
由图4可知,不同分子质量黑木耳发酵产物作用于HepG2 细胞24 h 后,细胞内的LPL 活性均上升。其中,对LPL 活性影响最为明显的分子质量集中在100~300 ku 之间,可达1.81 U/mL,其与空白组之间差异显著(P<0.05),与其它组之间无显著性差异(P>0.05)。LPL 主要在心脏、骨骼肌和脂肪组织中合成,是管理血脂水平的一种关键酶。能够水解富含TG 的脂蛋白中的核心TG,调节细胞脂质代谢平衡[23]。黑木耳发酵产物通过作用HepG2 细胞,提升细胞中LPL 活性,促进脂蛋白中的TG 代谢,降低TG 含量,这与2.3 节中的研究结果相吻合。
由图5可知,不同分子质量黑木耳发酵产物作用于HepG2 细胞24 h 后,细胞内的HL 活性均上升。其中,对HL 活性影响最为明显的分子质量集中在100~300 ku 之间,可达3.77 U/mL,其与空白组和A 组之间差异显著(P<0.05),与B,C,E 组之间无显著性差异(P>0.05)。肝脂酶属于与血液循环中内源性TG 代谢有关的酶之一,与LPL 在功能上有相似之处。HL 主要作用于极低密度脂蛋白残粒中的TG,降低TG 含量[24],达到降低血脂的目的,这与上述的研究结果相吻合。由此可见,黑木耳发酵产物可能是通过提升细胞内总脂酶的活性,加速对TC、TG 的代谢消耗,进而调节脂质代谢,达到降脂的目的。且对细胞内脂质代谢影响较为明显的黑木耳发酵产物的分子质量集中在100~300 ku 与>300 ku 之间。真菌多糖的生物活性与其一级结构和高级构象密切相关,多糖分子在溶液中的链构象又受其分子质量的影响,一般具有100~200 ku 的高分子质量组分呈较强的活性[25]。
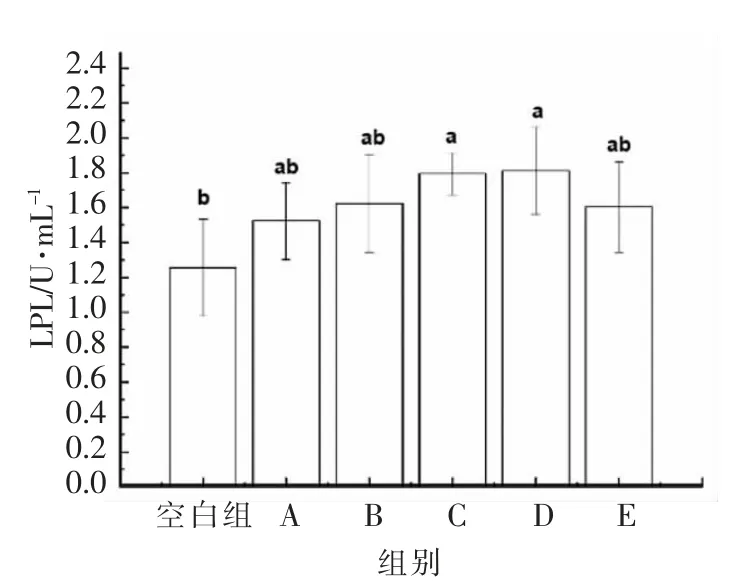
图4 不同分子质量黑木耳发酵产物对LPL 活性的影响Fig.4 Effect of fermentation products of A.auricular with different molecular weights on LPL activity
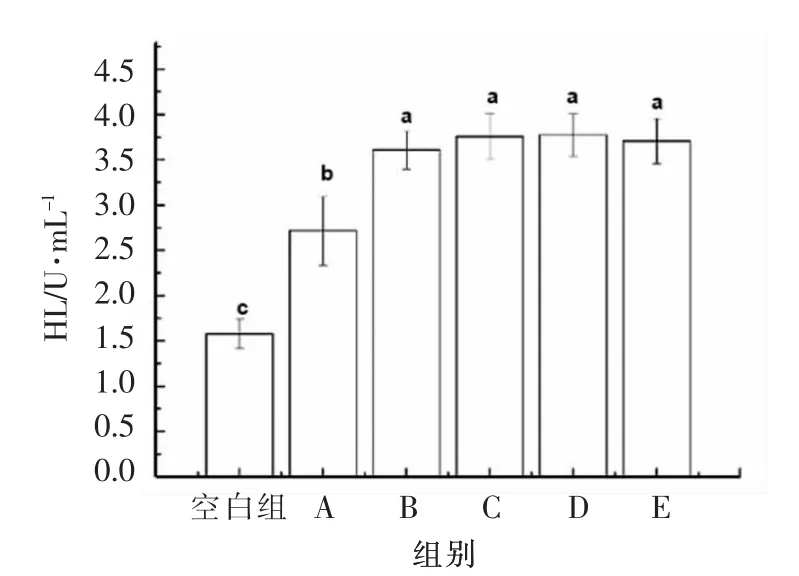
图5 不同分子质量黑木耳发酵产物对HL 活性的影响Fig.5 Effect of fermentation products of A.auricular with different molecular weights on HL activity
2.6 不同分子质量黑木耳发酵产物对葡萄糖含量的影响
由图6可知,不同分子质量黑木耳发酵产物作用于HepG2 细胞24 h 后,细胞内的葡萄糖含量均下降。其中,对葡萄糖含量影响最为明显的分子质量>300 ku,可达0.44 mmol/L,其与空白组和C组之间差异显著(P<0.05),与A,B,D 组之间无显著性差异(P>0.05)。研究发现,百合中所含有的多糖成分能够显著促进组织对葡萄糖的利用,抑制肝糖异生及糖原分解,减少肝糖输出,使血糖下降,达到降糖的目的[26]。冯雁波等[27]的研究发现松仁粕膳食纤维能够延迟葡萄糖的吸收,降低葡萄糖浓度,从而达到降糖的目的。且较高分子质量的黑木耳发酵产物作用于HepG2 细胞后使葡萄糖含量更低。
2.7 不同分子质量黑木耳发酵产物对肝糖原含量的影响
由图7可知,不同分子质量黑木耳发酵产物作用于HepG2 细胞24 h 后,细胞内的肝糖原含量均上升。其中,对肝糖原含量影响最为明显的分子质量>300 ku,可达1.42 μmol/mg,其与E 组之间无显著性差异(P>0.05),与空白组及其它组之间差异显著(P<0.05)。张众一等[28]的研究发现玉米须多糖能够明显促进葡萄糖转化为肝糖原,以减少糖原异生作用,减少葡萄糖含量,起到降低血糖的作用。这与2.6 节的研究中葡萄糖含量降低的结果相吻合。且较高分子质量的黑木耳发酵产物作用于HepG2 细胞后使肝糖原含量更高。

图6 不同分子质量黑木耳发酵产物对葡萄糖含量的影响Fig.6 Effect of fermentation products of A.auricular with different molecular weights on glucose content
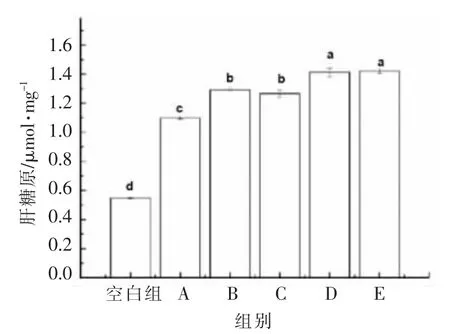
图7 不同分子质量黑木耳发酵产物对肝糖原含量的影响Fig.7 Effect of fermentation products of A.auricular with different molecular weights on hepatic glycogen content
2.8 不同分子质量黑木耳发酵产物对HK 活性的影响
由图8可知,不同分子质量黑木耳发酵产物作用于HepG2 细胞24 h 后,细胞内的HK 活性均上升。其中,对HK 活性影响最为明显的分子质量集中在100~300 ku 之间,可达5.02 U/g 蛋白,其与空白组之间差异显著(P<0.05),与其它组之间无显著性差异(P>0.05)。通过研究发现,多糖类物质能够改善糖脂代谢,调节葡萄糖的吸收利用。其中的一条代谢通路便是通过提高己糖激酶的活性,促进周围组织对葡萄糖的吸收利用,将葡萄糖转化为肝糖原,达到降低血糖的目的[29]。王黎明等[30]的研究发现茶多糖能够显著提升己糖激酶的活性,加快糖代谢,使血糖降低,促进糖原合成。由此可见,黑木耳发酵产物可能是通过调节己糖激酶的活性影响细胞糖代谢,加速葡萄糖的消耗,促进肝糖原的转化,达到调节糖代谢的目的。且对细胞内糖代谢影响较为明显的黑木耳发酵产物的分子质量集中在100~300 ku 与>300 ku 之间。薛令坤等[31]在研究中发现分子质量>100 ku 的杏鲍菇水提物具备更强的生理活性。杨阳等[32]的研究中也发现灰树花子实体多糖的活性部位主要位于100~1 000 ku 范围之间,这与本试验的研究结果相吻合。
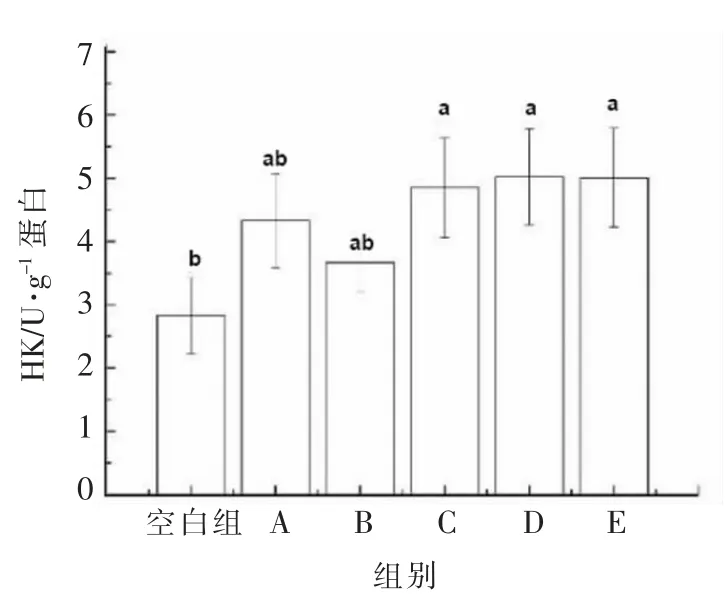
图8 不同分子质量黑木耳发酵产物对HK 活性的影响Fig.8 Effect of fermentation products of A.auricular with different molecular weights on HK activity
3 结论
前期研究发现黑木耳发酵产物中含有多糖、多酚以及类黄酮等活性物质,本试验就发酵产物的降脂功能及降糖功能进行研究,结果表明黑木耳发酵产物具备降脂降糖功能。孟繁龙[33]对桦褐孔菌发酵工艺的研究发现,桦褐孔菌的胞内多糖能够显著降低实验小鼠的血糖水平。尚红梅[34]对小刺猴头菇的发酵浸膏多糖的研究发现,小刺猴头菇的发酵浸膏多糖能够减少肉鸡体内胆固醇的合成,达到降脂的目的。然而,针对不同分子质量发酵产物的功能性质,国内外的相关研究较少。因此,本研究通过超滤法获得不同分子质量黑木耳发酵产物,并通过建立体外HepG2 细胞脂肪累积模型及正常HepG2 细胞模型,以MTT 值、油红O染色、TG 值、TC 值、LPL 与HL 活性、葡萄糖含量、肝糖原含量、HK 活性为指标,评价不同分子质量黑木耳发酵产物对HepG2 细胞脂质代谢及糖代谢的影响。结果表明,100~300 ku 的黑木耳发酵产物对TC 含量以及LPL、HL、HK 活性的影响显著;>300 ku 的黑木耳发酵产物对TG、葡萄糖以及肝糖原含量的影响显著。本研究发现较高分子质量的黑木耳发酵产物对HepG2 细胞脂质代谢及糖代谢的影响显著,这为黑木耳的开发应用提供了新途径,更为降脂、降糖药物与功能性食品的开发提供了理论基础,具有应用指导意义。

