裂谷热病毒Gn 蛋白主要抗原区的串联表达和多克隆抗体制备
恽佳蕾,李文良,毛 立,杨蕾蕾,孙 敏,张纹纹,刘茂军
(1.江苏省农业科学院兽医研究所,农业农村部兽用生物制品工程技术重点实验室,江苏省食品质量安全重点实验室-省部共建国家重点实验室培育基地,江苏南京 210014;2.江苏大学食品与生物工程学院,江苏镇江 212013)
裂谷热(Rift Valley fever,RVF)是由裂谷热病毒(Rift Valley fever virus,RVFV)引起的一种人兽共患传染病。蚊虫是其重要的传播媒介,易感动物可通过接触发病或感染动物的体液、血液、排泄物和分泌物等被感染[1]。该病的主要感染对象为反刍动物,可导致反刍动物流涕、厌食、腹泻、高热等症状,犊牛和羔羊的病死率可达90%。同时,若母畜感染,流产概率可高达80%~90%。人类对该病同样易感,严重情况下可导致致命性出血热[2-3]。自发现之日起,由RVFV 引起的疫情不断发生[4]。起初该病仅在非洲撒哈拉以南地区出现,随后(1977—1978 年)在非洲东北部的埃及暴发,造成大规模人类感染,18 000 多个报道病例中约有600 人死亡;2000 年,也门、阿拉伯半岛和中东地区也暴发了RVF 疫情[5];2016 年,我国出现首例输入性RVF 确诊病例[6]。
RVFV 属于布尼亚病毒科(Bunyaviridae)白蛉病毒属(Phlebovirus)[7],具有典型的布尼亚病毒特性。RVFV 基因组为单股负链RNA,可分为L(大)、M(中)、S(小)3 个节段,其中:S 节段采取双义编码方式,编码核蛋白N 和非结构蛋白NSs;M 节段编码两种囊膜糖蛋白(Gc 和Gn),以及NSm 和未知功能的结构蛋白;L 节段编码RNA 依赖的RNA 聚合酶[8-10]。囊膜糖蛋白对于布尼亚病毒在高尔基体的成熟具有重要作用,Gc 和Gn 蛋白参与高尔基体的定位过程,而病毒表面的Gc 和Gn 蛋白含有中和表位,也可刺激机体产生抗体,是病毒的主要免疫原结构蛋白[11-12]。国内已有研究[3,13-16]通过不同的表达系统对Gn 或Gc 蛋白进行表达,但此类研究多采用真核表达系统,虽有研究对其主要抗原片段进行原核表达,但并未开展深入鉴定与检测。
本研究通过分析Gn 蛋白抗原位点分布情况,选取RVFV Gn 两个主要抗原区域基因片段进行串联,构建原核表达质粒,转化至BL21 感受态细胞,经IPTG 诱导表达后鉴定重组蛋白的表达情况,进而用重组蛋白免疫小鼠制备多克隆抗体并鉴定多抗的反应性,以期为后续Gn 蛋白的免疫学功能研究和RVFV 检测方法建立奠定基础。
1 材料与方法
1.1 试剂
质粒提取试剂盒,购自Axygen 公司;HRP标记的羊抗小鼠IgG、His 标签单抗、蛋白质Marker,购自北京全式金生物技术有限公司;大肠杆菌BL21(DE3)感受态细胞,购自南京擎科生物科技有限公司;DAB 显色试剂盒,购自武汉博士德生物工程有限公司;转染试剂Lipofectamine 2000,购自Invitrogen 公司;免疫染色固定液、封闭液、抗体稀释液、DAPI、flag 标签单抗和Alexa Fluor 555 标记驴抗小鼠IgG,购自碧云天生物技术研究所。其他试剂均为国产或进口分析纯。
1.2 质粒构建
根据Genbank 中公布的RVFV ZH501 株基因组信息(DQ380200),通过DNAstar Protean 软件分析蛋白抗原性。选取两个主要抗原区域(1~265 aa 和297~411 aa,图1),由南京钟鼎生物技术有限公司合成这两个区域的串联基因片段,通过EcoR I 和XhoI 酶切位点克隆至原核表达载体pET-28a(+),获得重组质粒pET-28-Gn。同时,由南京擎科生物科技有限公司合成完整的Gn基因,通过EcoR I 和BamH I 酶切位点克隆至载体p3×flagcmv-14,获得重组质粒p14-Gn。重组质粒通过双酶切和测序鉴定正确。

图1 Gn 蛋白主要抗原区分析选择
1.3 目的蛋白诱导表达及表达形式分析
将重组质粒pET-28-Gn 转化至BL21 感受态细胞,随后涂布于LB 琼脂平板(含50 μg/mL 卡那霉素),37 ℃过夜培养;挑取单菌落于LB 培养液中,37 ℃震荡培养过夜,按1:100 比例接种于新鲜LB 培养液中,37 ℃震荡培养2 h;待OD600为0.6~0.8 时加入终浓度为0.5 mmol/L 的IPTG,进行诱导表达,5 h 后收集菌液;将诱导后的菌液离心、取沉淀,加入原菌液1/10 体积的PBS 重悬,然后置于冰上进行超声破碎直至菌液澄清,离心分离上清及沉淀(包涵体)。分别取诱导前后以及超声后的上清和沉淀样品,加入SDS-PAGE 蛋白上样缓冲液(5×)煮沸10 min,用12% SDS-PAGE 分离胶分析鉴定目的蛋白表达情况与表达形式。
1.4 蛋白诱导表达条件优化
1.4.1 诱导浓度优化 按照上述方法接种菌液,震荡培养至OD600为0.6~0.8 时,分别加入终浓度为0.10、0.25、0.50、0.75、1.00 mmol/L 的IPTG,37 ℃震荡培养5 h 后,离心收集菌体,加入蛋白上样缓冲液煮沸,进行SDS-PAGE,分析确定最佳诱导浓度。
1.4.2 诱导时间优化 按照上述方法接种菌液,震荡培养至OD600为0.6~0.8 时,加入终浓度为0.50 mmol/L 的IPTG,37 ℃分别震荡培养2、3、4、5、6 h 后,离心收集菌体,加入蛋白上样缓冲液煮沸,进行SDS-PAGE,确定最佳诱导时间。
1.5 Western Blot 检测
蛋白样品经SDS-PAGE 电泳后,使用半干法转印至硝酸纤维素膜,随后将膜放入新鲜配制的5%脱脂乳中,37 ℃封闭2 h;使用PBST 洗涤3次,加入1:1 000 稀释的抗His 标签鼠源单抗,37 ℃孵育2 h;使用PBST 洗涤3 次,加入1:4 000 稀释的HRP 标记羊抗小鼠IgG,37 ℃孵育2 h;使用PBST 洗涤3 次后,进行DAB 显色。
1.6 多克隆抗体制备与鉴定
按照最佳诱导条件表达重组蛋白,分离包涵体。用原菌液体积1/10 的含8 mol/L 尿素的PBS 4 ℃溶解过夜,10 000 r/min 离心5 min,吸取上清测定蛋白浓度后与ISA 201 佐剂混合乳化(蛋白终浓度为500 µg/mL),免疫6 周龄雌性BALB/c 小鼠。采用背部皮下多点注射免疫,每只100 µg/次。每次免疫间隔2 周,共免疫3 次。免疫后采血分离血清,使用间接ELISA、Western Blot 和间接免疫荧光试验(IFA)检测小鼠抗体滴度与反应性。
1.7 间接ELISA
用碳酸盐包被缓冲液稀释重组Gn 蛋白至1 μg/mL,ELISA 检测板每孔包被100 μL,4 ℃过夜;PBST 洗涤3 次,每孔加入200 μL 含0.5%BSA 的PBST,置于37 ℃中封闭2 h;PBST 洗涤3 次,加入倍比稀释的免疫血清(1:100~1:51 200)和阴性对照血清,37 ℃孵育1 h;PBST 洗涤3 次,分别加入1:4 000 稀释的HRP 羊抗小鼠IgG 二抗,37 ℃孵育1 h;PBST 洗涤3 次,以TMB 底物液避光显色10 min,加入2 mol/L 硫酸终止,用酶标仪测定OD450,计算抗体滴度。
1.8 间接免疫荧光试验(IFA)
将293T 细胞接种于24 孔细胞培养板,当细胞达到80%融合度时进行转染。按照说明书制备质粒p14-Gn 与脂质体的混合物,静置5 min 后加入细胞孔;转染24 h 后,弃去培养液,加入免疫染色固定液固定细胞15 min,然后加入封闭液37 ℃孵育1 h;加入1:1 000 稀释的flag 抗体或制备的多抗,37 ℃孵育1 h;洗涤后加入1:500 稀释的Alexa Fluor 555 标记的驴抗小鼠IgG,37 ℃孵育30 min,DAPI 染色5 min;PBS 洗涤3 次后,置于荧光显微镜下观察。
2 结果
2.1 目的蛋白诱导表达
重组质粒转化至BL21 感受态细胞中,使用IPTG 诱导表达后,对表达产物进行SDS-PAGE 鉴定。结果(图2)显示,在45 kDa 处有符合预期大小的目的条带出现,表明Gn蛋白正确表达。同时,经过超声破碎的菌液沉淀(包涵体)中目的条带明显,而上清中条带很淡,说明蛋白主要存在于包涵体中。
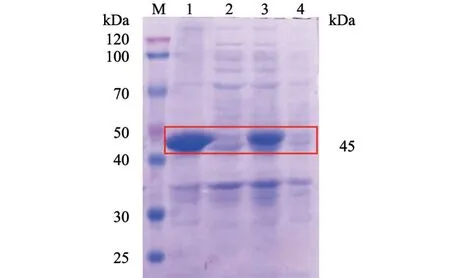
图2 Gn 蛋白诱导表达及表达形式的SDS-PAGE 分析结果
2.2 表达条件优化
加入终浓度分别为0.10、0.25、0.50、0.75、1.00 mmol/L 的IPTG 进行诱导表达。SDS-PAGE结果(图3)显示,Gn 蛋白的最佳诱导浓度为0.25 mmol/L。分别诱导2、3、4、5、6 h 后,收集菌体样品进行SDS-PAGE 鉴定。结果(图4)显示,Gn 蛋白的最佳诱导时间为5 h。
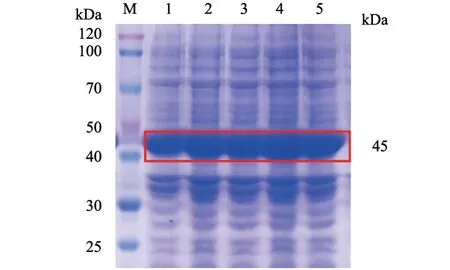
图3 不同诱导浓度Gn 蛋白表达的SDS-PAGE 分析结果

图4 不同诱导时间Gn 蛋白表达的SDS-PAGE 分析结果
2.3 重组蛋白Western Blot 鉴定
蛋白样品经SDS-PAGE 并转印至硝酸纤维素膜后,使用抗His 标签鼠源单抗作为一抗检测重组蛋白反应性。结果(图5)显示,诱导表达的菌液在45 kDa 处出现与目的蛋白大小一致的条带,而对照样品未出现条带。
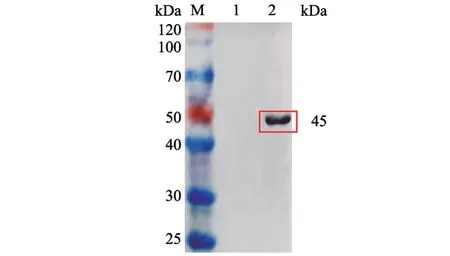
图5 Gn 重组蛋白Western Blot 鉴定结果
2.4 ELISA、Western Blot 和IFA 鉴定多克隆抗体反应性
免疫小鼠3 次后,分离鼠血清并通过间接ELISA 检测血清抗体滴度。结果显示,重组蛋白免疫可诱导产生高水平抗体,抗体滴度可达1:51 200以上。进一步通过Western Blot 检测多克隆抗体的反应性。结果(图6)显示,制备的多克隆抗体与目的蛋白有良好的反应性,检测到分子量大小约为45 kDa 的蛋白条带。
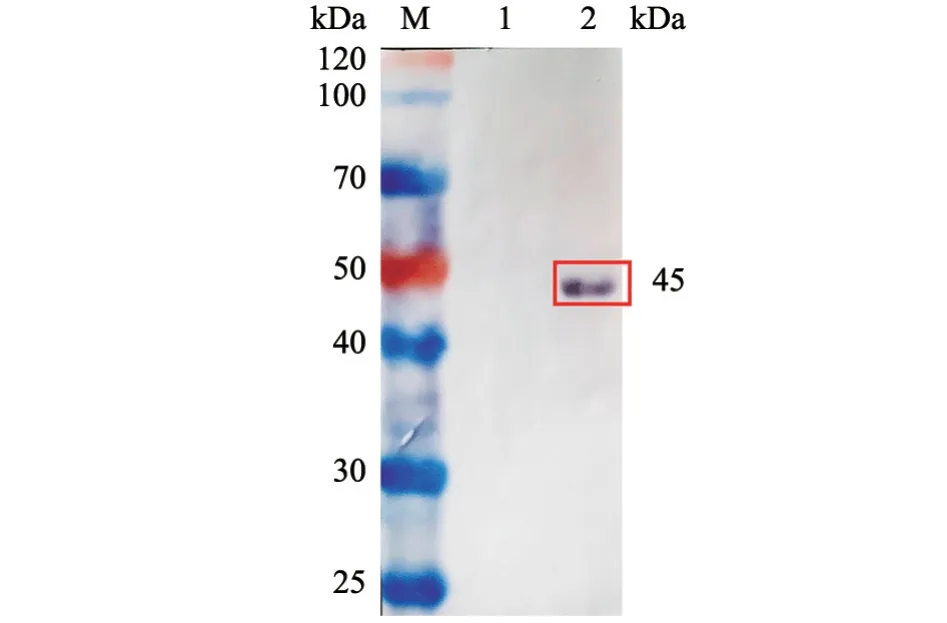
图6 Western Blot 检测Gn 多克隆抗体反应性结果
将表达Gn 蛋白的真核表达质粒p14-Gn 转染293T 细胞,转染24 h 后固定细胞,采用IFA 检测多克隆抗体的反应性。结果(图7)显示,制备的多克隆抗体可与细胞中表达的Gn 蛋白反应,在胞浆中呈现特异的红色荧光,与flag抗体检测结果一致。
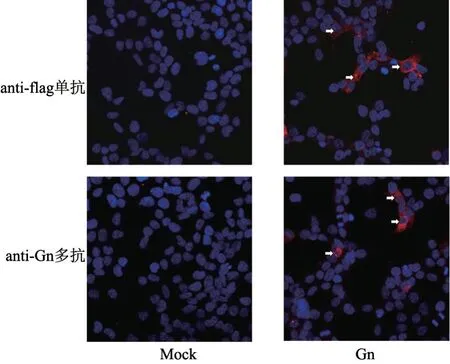
图7 IFA 检测Gn 多克隆抗体的反应性结果
3 讨论
RVF 主要经蚊媒传播,但不能排除其通过气候转移、游客携带或食物链向欧洲、亚洲或美洲地区传播的可能性[17-18]。随着全球化推进、各国间经济交流以及动物产品进出口贸易的频繁,RVFV 传入我国的风险日益增加。2016 年7 月,我国出现首例输入性RVF 病例[6]。因而需要建立简便特异的检测技术,做好技术储备,并加强检疫,防范该病传入。
RVFV 囊膜蛋白Gc 和Gn 是病毒的保护性抗原,可诱导机体产生中和抗体,能作为疫苗和检测方法研究的靶抗原。目前,我国已有研究[3,13-15]通过大肠杆菌或杆状病毒表达系统表达Gn 和Gc,但对表达蛋白及诱导抗体缺乏进一步鉴定。夏鹏等[3]对Gn 蛋白的两个优势抗原片段分别使用pCold I载体表达,发现蛋白以包涵体形式存在,但未对其进行深入鉴定和应用。国外已有研究[19],利用原核表达的囊膜蛋白制备单抗并用于病毒检测,这提示原核表达系统也可用于囊膜蛋白的表达及检测方法研究。真核表达系统虽然可以获得接近天然结构的蛋白,但表达量较低,纯化难度大,成本也较高。原核表达系统可以更加高效、简便地获得高纯度、高含量的重组蛋白。因此,为获得原核表达的Gn 重组蛋白并检验其抗原性,以用于建立RVF 检测方法和制备单抗等后续研究,本试验首先通过DNAstar 软件分析蛋白抗原性,结合在线分析结果(德泰生物在线分析工具),分别选取抗原性较好的两个区域(1~265 aa 和297~411 aa 区域),将对应序列拼接后进行基因合成,构建串联表达载体,转化至BL21 感受态细胞进行重组Gn 蛋白表达。经鉴定表达产物主要以包涵体形式存在,上清中仅有少量表达。将表达的重组Gn 蛋白免疫小鼠,收集血清后进行ELISA 检测,发现多抗血清效价可达1:51 200 以上。Western Blot 检测显示,制备的Gn 多克隆抗体能与重组蛋白产生特异性反应,说明所表达蛋白可诱导产生良好的体液免疫反应,具有良好的免疫原性。由于Gn 是RVFV 的囊膜蛋白,具有翻译后的修饰和空间构象,因此为了后续的单抗制备和检测方法研究,必须检测制备的多克隆抗体与天然病毒蛋白的反应性。但由于缺乏可用的毒株以及生物安全条件限制,本研究构建了表达完整Gn 蛋白的真核表达质粒(融合flag 标签),转染293T 细胞模拟真实的病毒蛋白,通过flag 标签抗体和制备的多抗分别进行IFA 检测,结果发现在胞浆中均呈现特异的红色荧光,表明制备的重组蛋白可诱导与天然病毒蛋白相似的抗体反应,制备的多克隆抗体有望与天然病毒蛋白产生反应,因此制备的重组蛋白及多克隆抗体为以后Gn 蛋白免疫学功能研究和RVFV 检测方法的建立奠定了基础。

