不同品系大肠杆菌营养成分分析及其对线虫发育的影响
杨 楠, 鲍 斌
(合肥工业大学 食品与生物工程学院,安徽 合肥 230601)
0 引 言
大肠杆菌是一种生活在肠道中的细菌[1-2]。早在19世纪80年代,德国的生物学家 Escherich 就通过实验将大肠杆菌分离出来,自发现以来,越来越多的专家学者对其进行深入研究。多年来,对大肠杆菌的研究主要有医学和物理化学2个方向,主要针对大肠杆菌的检测方法进行研究[3]。除此之外,在实验室中,大肠杆菌还可用作秀丽隐杆线虫的食物来源。
秀丽隐杆线虫个体简单,存在雄虫和雌雄同体2种状态。雌雄同体成虫体细胞有959个细胞,雄虫成虫1 031个体细胞[4]。线虫具有饲养条件简单、易操作、生命周期较短以及遗传操作便利等优势,因此成为生物学研究中的重要模式动物。在野外,线虫以生存环境中的各种细菌为食物来源[5-6],然而在实验室中主要以大肠杆菌为食[7]。实验室中用于喂养线虫的大肠杆菌主要有OP50、 HT115、 HB101、 MG1655。大肠杆菌菌株OP50形成的是一个薄的菌落,可以最佳地展示秀丽隐杆线虫的发育[8];MG1655是可诱导耐高压菌株,且近年在以线虫为模式生物来研究肠道菌群代谢中逐渐被采用[9];HB101是一种B x K12杂种,可形成比OP50明显更厚的菌落[10],相比于其他大肠杆菌而言是线虫最喜爱的菌株;HT115(DE3)是一种K12衍生的RNAse Ⅲ菌株,常被用作进行RNA干扰实验[11-12]。
由于线虫的发育周期短,一般3 d左右,基本生理指标易受饮食的影响[13]。为了研究不同大肠杆菌对线虫生长发育的影响,本文对实验室中常用的不同大肠杆菌品系的营养物质质量、能量和总能量,及其对线虫进食速率、发育速率、生殖能力、寿命进行了分析。
1 材料与方法
1.1 实验材料
大肠杆菌菌株OP50、 MG1655、 HT115、 HB101均来自于本实验室;野生型秀丽隐杆线虫(N2)购自国际线虫中心(CGC)。
1.2 主要试剂
胰蛋白胨、酵母粉、琼脂粉、油红O、BCA均购自Sigma试剂公司;氯化钠、硫酸镁、氯化钙、无水乙醇、苯酚、硫酸、石油醚、1,2-丙二醇等试剂均购自国药集团化学试剂有限公司。
1.3 实验方法
1.3.1 大肠杆菌的培养
液体LB(Luria-Bertani)培养基1 L中,需称取10 g胰蛋白胨、5 g酵母粉、10 g氯化钠,121 ℃,灭菌30 min。将大肠杆菌接种到冷却后的LB后放置摇床中,37 ℃,220 r/min,培养12 h。接种时需要根据大肠杆菌的抗性添加1/1 000相应的抗生素:OP50添加30 g/L链霉素,HT115添加100 g/L氨苄青霉素,MG1655、HB101不添加抗生素。
1.3.2 线虫的培养
线虫生长型培养基(nematode growth medium, NGM)的配置。600 mL NGM培养基中需称取琼脂粉12 g、氯化钠1.8 g、蛋白胨1.5 g;加蒸馏水585 mL,121 ℃,灭菌30 min;冷却到65 ℃后分别加入600 μL的1 mol/L MgSO4、1 mol/L CaCl2、5 g/L胆固醇,磷酸钾缓冲液15 mL,根据大肠杆菌抗性添加抗生素同1.3.1所述,混匀后倒板。
线虫的同步化。将正在产卵的线虫用M9缓冲液洗至1.5 mL离心管中,自由沉降,多次使用M9去除大肠杆菌,最后留约700 μL M9;加入现配5 mol/L NaOH和5%NaClO体积比为1:2混合的裂解液300 μL,混合均匀;震荡,反复2次,约5 min观察到虫子裂解至2/3后立即6 000 r/min离心1 min 30 s,弃上清;用M9洗2遍,将卵铺在含有大肠杆菌的NGM培养基上。
1.3.3 大肠杆菌3种营养物质的检测
碳水化合物的检测采用苯酚-硫酸法。称取葡萄糖于60 ℃烘箱烘12 h至恒重,再称取恒重后的葡萄糖配制100 μg/mL葡萄糖标准溶液。制作葡萄糖标准曲线:准确吸取100 μg/mL的葡萄糖标准溶液,分别取0、0.2、0.4、0.6、0.8、1.0 mL于干燥的试管中,补加蒸馏水至1.0 mL。 同时取1.0 mL待测大肠杆菌菌液至干燥的试管中;吸取25 μL的80%苯酚,快速冲洗待测液,加入2.5 mL浓硫酸,在旋涡混合器上混合15 s,35 ℃反应15 min,降温至再次震荡混合不再放热即可,在波长490 nm处测吸光度,根据葡萄糖标准溶液的质量浓度与相对应的OD490值绘制标准曲线。依据大肠杆菌OD490值、大肠杆菌总体积、葡萄糖标准曲线即可得知所测大肠杆菌含葡萄糖的总质量,通过平板菌落计数法(CFU)统计待测大肠杆菌总个数,大肠杆菌的葡萄糖总质量与大肠杆菌总个数的比值即为每个大肠杆菌中葡萄糖的质量。
蛋白质的检测中采用Bradford法。细菌蛋白提取:在4 ℃,12 000 r/min下菌液离心5 min,弃上清,收集菌体,用PBS洗菌体2次,按每20 mg湿重菌体加入500 μL蛋白酶抑制剂体积比1∶100)及磷酸酶抑制剂(体积比1∶100)预冷的蛋白裂解液,吹打混匀,冰上放置30 min;300 W,10 s超声,10 s间隔,冰浴超声至菌液变清;4 ℃,12 000 r/min 菌液离心5 min,上清转入冷的干净离心管,即得到细菌蛋白。
制作蛋白标准曲线:向干净灭菌的EP管中依次加入0.5 g/L牛血清白蛋白(BSA)0、5、15、20、25、30 μL,分别加入双蒸水补至100 μL,混匀,然后各个试管中分别加入1 mL考马斯亮蓝G-250试剂,立即混匀,不要太剧烈;2 min后,测定各个样品在595 nm处的光吸光值,空白对照为一号EP管,以蛋白质量浓度和吸光度作标准曲线。
样品测定。把待测样品稀释至10~100 μg/mL,取50 μL稀释后的样品,加入150 μL考马斯亮蓝,后续步骤同上,测得A595值后,在标准曲线上找到对应的质量浓度。根据样品质量浓度、体积得到样品总蛋白质量。因此依据大肠杆菌的总蛋白、总个数可得到每个大肠杆菌的蛋白质量。
脂肪的检测采用索氏提取法。大肠杆菌菌液置于蒸发皿中,加入约20 g石英砂,于沸水浴上蒸干后,在电热鼓风干燥箱中于100 ℃干燥30 min后取出,全部移入滤纸筒内。抽提:将滤纸筒放入索氏抽提器的抽提筒内,连接已干燥至恒重的接收瓶,由抽提器冷凝管上端加入石油醚至瓶内容积的2/3处,于水浴上加热,使石油醚不断回流抽提(6 ~8次/h),抽提10 h。提取结束时,用磨砂玻璃棒接取1滴提取液,磨砂玻璃棒上无油斑表明提取完毕。称量:取下接收瓶,回收石油醚,待接收瓶内溶剂剩余1 ~2 mL时在水浴上蒸干,再于100 ℃干燥1 h,放干燥器内冷却0.5 h后称量。重复以上操作直至恒重。
1.3.4 线虫发育相关指标的检测
发育速率。挑取20~30条正在产卵的线虫,放在NGM上自由产卵20 min,大约有30颗卵产生时,移除产卵的线虫,记录时间为T0。30颗卵产生第1颗卵时间为Tn。Tn与T0的时间差即为线虫发育所需的时间。
寿命统计。准备普通NGM培养基和FUDR NGM培养基2种,加入等量的4种大肠杆菌,挑取20~30条正在产卵的线虫放入含有大肠杆菌的普通NGM培养基上,20 ℃,让其自由产卵,待其产卵大于50颗时,将成虫挑走;上述NGM培养基板20 ℃培养,卵自由发育至L4时期,此时线虫转到FUDR的NGM培养基上,2~3 d换1次FUDR培养基,并统计线虫死亡数目,直至每组样本线虫全部死亡。
进食速率统计。在光学显微镜100倍条件下,随机选取发育至早期成虫时期的线虫,于30 s记1次时间,统计线虫咽部的跳动速率,每条线虫重复3次,每1组样本挑取10~20条线虫。
产卵量统计。准备直径30 mm食物充足的NGM培养基,挑取1条早期成虫时期的线虫放入NGM中,从第1天产卵开始,记录每天产卵数目,并转移该条线虫到新的NGM上,直至线虫不再产卵,所有天数产卵之和即为该条线虫的产卵量,每组样本数30条,重复3次。
1.3.5 统计学处理
所有数据以均数±标准差(x±se)表示,重复3次。不同组之间使用t检验,当P<0.05视为具有统计学差异。
2 结果与分析
2.1 不同品系大肠杆菌的营养物质质量水平
当4种大肠杆菌作为线虫食物时,需要对4种大肠杆菌的营养物质进行分析。因此本文对4种大肠杆菌每个菌株所含的三大营养物质的质量进行了检测,结果如图1所示。
由图1a可知,4种大肠杆菌中每个菌株中碳水化合物的质量从高到低依次为MG1655、 HT115、HB101、OP50。因此在这4种大肠杆菌中,MG1655为碳水化合物质量较高的菌株,OP50为较低的菌株。由图1b可知,4种大肠杆菌的蛋白质质量没有显著性差异,因此若依据蛋白质质量量的高低为选择标准,则无法区分4种菌株。由图1c可知,通过对脂肪质量的检测,HB101菌株脂肪质量最高,且远高于其他3种大肠杆菌,OP50与HT115在脂肪质量上相近,且两者大于HT115。同时,从图1整体来对比3种营养物质的质量,可以看出碳水化合物的质量最高,其次是蛋白质,最后是脂肪。因此,不同的大肠杆菌含有的营养物质的质量不同。
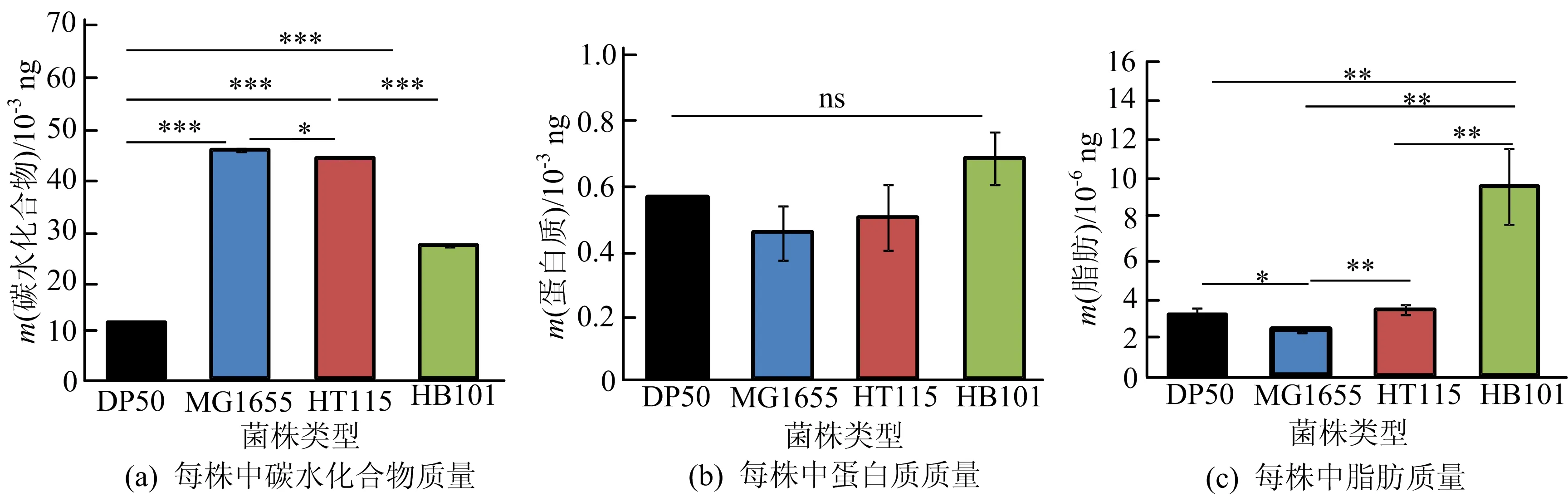
图1 4种大肠杆菌中的3种营养物质的质量
2.2 不同品系大肠杆菌的营养物质能量水平
本文对4种大肠杆菌营养物质能量情况进行分析。将碳水化合物、蛋白质和脂肪3种产能营养物质的含量水平乘以各自相应的能量系数,即碳水化合物、蛋白质的能量系数均为16.7 kJ/g,脂肪的能量系数为37.9 kJ/g,计算得出3种产能营养物质的能量。4种大肠杆菌的3种产能营养物质能量情况如图2所示。由图2a可知,在碳水化合物能量中MG1655最高,其次是HT115,再其次是HB101、最后是OP50。由图2b可知,在蛋白质所含能量中,3种营养物质没有显著差异。由图2c可知,在能量系数最高的脂肪中,HB101的能量最高,且远高于其他三者;OP50与HT115相似,同时高于MG1655。将3种营养物质的能量加和得出4种大肠杆菌的总能量,如图2d所示。由图2d可知,在总能量从高到低依次为MG1655、HT115、 HB101、OP50。通过对图2a、图2b、图2c的对比,3种供能营养物质能量系数最高的是脂肪,由于含量最少,因此能量也最少。由图2可知,4种大肠杆菌的总能量与碳水化合物能量的趋势一致。综上所述,4种大肠杆菌在碳水化合物的能量、蛋白质的能量、脂肪的能量以及总能量上都不同,主要由碳水化合物提供能量,且菌株总能量的水平也由碳水化合物决定。
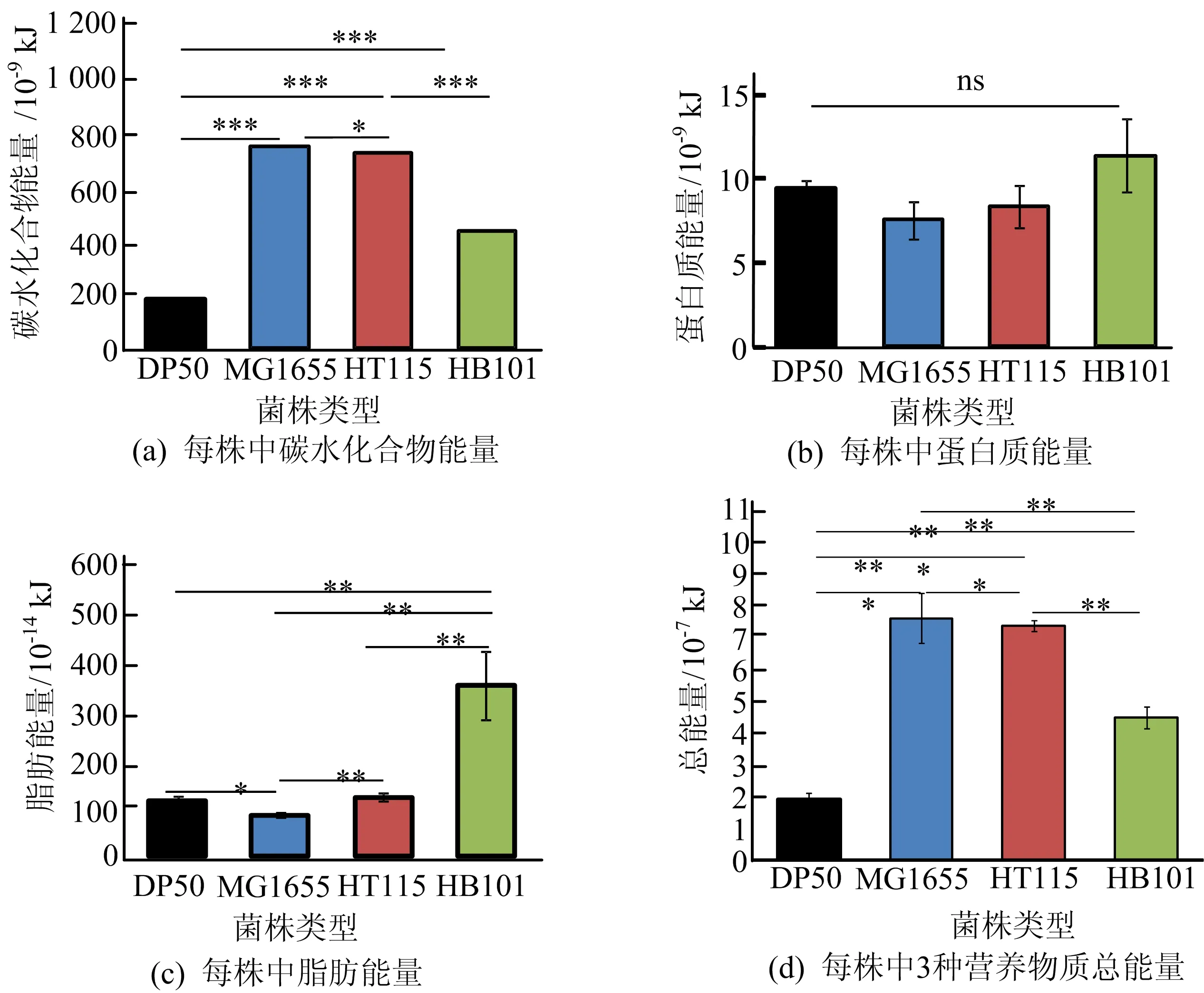
图2 4种大肠杆菌中的3种营养物质的能量
2.3 不同品系大肠杆菌对线虫发育的影响
鉴于4种大肠杆菌的能量不同,有可能会影响线虫的进食速率。本文首先调查了食用上述4种大肠杆菌的线虫进食速率,本文以单位时间内,线虫咽部跳动的次数视为线虫的进食速率,如图3所示,由图3可知,食用4种大肠杆菌的线虫的咽部跳动速率没有显著性差异,即进食速率没有差异,所以大肠杆菌的能量差异不改变线虫的进食量。

图3 4种大肠杆菌对线虫进食速率的影响
本文研究了线虫的生命周期长度,结果如图4所示。从图4可以看出,即线虫从卵开始孵化,发育直至再发育成成虫并产出第1颗卵的时间,发现食用HT115的线虫与食用OP50的线虫生命周期长度相类似,而食用MG1655或HB101的线虫生命周期较短,说明MG1655与HB101可以加快线虫的发育速率。
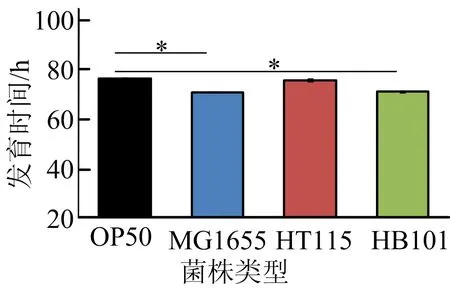
图4 4种大肠杆菌对线虫发育速率的影响
本文分析4种大肠杆菌对线虫寿命的影响如图5所示。由图5可知,食用不同的大肠杆菌在对线虫寿命上没有影响。

图5 4种大肠杆菌对线虫寿命的影响
本文通过统计线虫的产卵量对线虫的生殖能力进行了研究,结果如图6所示。

图6 4种大肠杆菌对线虫产卵量影响
由图6可知,与OP50比较,食用MG1655、HT115、HB101的线虫的产卵量没有区别。但是食用HT115的线虫较HB101有较多的产卵量,因此HT115的生殖能力高于HB101。
3 结 论
本文首先采用食品检测的方法分析了实验室常用4种大肠杆菌的碳水化合物、蛋白质、脂肪的质量、能量以及总能量。本文发现虽然不同的菌种具有不同量的营养物质,如HB101含有的蛋白质、脂肪最多,MG1655中的碳水化合物质量最多,但是在4种菌种中含量最高的营养物质是碳水化合物,是蛋白质的数十倍,脂肪的上千倍,因此总能量水平主要是由碳水化合物决定的。
本文进一步对食用4种大肠杆菌的线虫的进食速率、发育速率、寿命以及生殖能力进行探究,结果表明与OP50相比,其他3种大肠杆菌对线虫的进食速率、寿命、生殖能力没有影响。在发育速率方面,MG1655、HB101喂养的线虫比OP50喂养的发育速率快。在生殖能力上,食用HT115比食用HB101的线虫生殖能力强。HB101有最高的脂肪含量,且食用HB101的线虫有较快的发育速率以及较差的生殖能力,因此线虫的发育速率、生殖能力可能受到了脂肪的调控。从实验结果来看,其他营养物质对线虫的发育没有显著影响。但是本文提供的营养物质能量是根据各营养物质的能量系数得来的理论能量,不能代表线虫实际摄入能量情况,因此营养物质的能量对于线虫的影响需进一步研究。
本文的研究模型中线虫是自由进食的,可视为能量摄入是充足的,因此即使不同细菌的能量、含量不同,也未必能够改变线虫的发育速率及脂肪沉积的表型,并且细菌对宿主代谢的影响是复杂的,极有可能是通过一些特定代谢物(如脂肪酸、胆固醇[14]等)作为信号分子,对宿主进行调控,这些还有待后续实验的探究。

