Fenton氧化处理高含油工业废水实验及动力学分析
陈艺敏
(1.漳州职业技术学院食品工程学院,福建漳州 363000;2.福建省高职院校精细化工应用技术协同中心,福建漳州 363000)
随着我国污水的排放标准愈加严格,如何使来自石油化工、机械、冶金等难降解的高含油工业废水达标排放是摆在企业面前亟需解决的难题.高含油工业废水处理难度高,有效的预处理方法能够合理高效地去除废水的含油量和有机物含量,减轻后续处理的负担,提高出水的水质.氧化预处理技术是指利用强氧化剂来氧化或分解水中的污染物,同时能够削弱污染物对常规处理工艺的不利影响,具有反应速度快、能耗低等优点,用于处理含油工业废水可有效解决污泥量大、细菌抗药性强等问题,确保水质稳定达标[1,2].常见的处理工业含油废水的氧化工艺包括:电化学氧化技术、臭氧氧化、高锰酸钾氧化、Fenton氧化等[3-7].电化学氧化法虽然能将难降解有机物氧化成小分子物质,但是存在电极材料成本、有毒副产品等问题.臭氧氧化法能够提高含油废水的可生化性,但是臭氧发生器投资大,运行费用高.高锰酸钾法可以降解含油废水中大分子有机物并强化混凝的效果.Fenton法氧化能力比高锰酸钾法强[8],并由于其处理效果好,操作简单等优点而广泛用于难降解有机物的处理.
当地某废油再生提炼企业在生产过程中产生的废水具有成分复杂、含油量高、 COD值高、色度浊度高、可生化性差等特点,对人类健康和环境的影响较大.利用Fenton氧化处理此类高含油废水的工程实例较少,对其有机物降解的动力学模型的讨论更不多见.本文通过正交试验确定Fenton氧化最佳实验条件,并根据单因素实验数据建立有机物降解的表观动力学模型,找出制约降解速度的关键因子.
1 实验部分
1.1 废水来源
实验所用废水来自当地某废油再生提炼厂产生的高含油废水,用红外分光光度法(HJ637-2012)测得石油类含量约700 mg/L.该废水成分复杂、有明显的刺鼻性气味,色度大且有较多黑色悬浮物.在进行氧化反应之前,先对废水进行简单的过滤和隔油处理,去除水中较大漂浮物和悬浮物,以及浮油,以免影响Fenton氧化的效果.
1.2 实验方法、仪器及药品
Fenton氧化法是在酸性条件下,Fenton试剂中的Fe2+催化H2O2反应产生强氧化物质·OH,提高氧化效率降解有机物,同时Fe2+被氧化为Fe3+而具有一定的絮凝作用.Fenton法所需主要仪器和药品,以及测量水中pH值和CODCr值所采用的实验方法、仪器及药品详见表1.Fenton氧化实验前测得高含油废水的初始pH值为5.2,初始CODcr浓度为147 g/L.Fenton氧化实验步骤:首先调节废水的pH值,然后加入一定量的H2O2和Fe2+,再利用磁力搅拌器混合搅拌,反应一段时间后,离心过滤取上清液测量废水的CODCr值并计算CODCr去除率.

表1 实验方法、仪器和药品Tab.1 Experimental methods, instruments and medicines
1.3 正交试验
1.3.1 正交试验设计 正交试验就是利用规格化的正交表,选择影响因子和影响水平,恰当地进行试验设计,以较少的实验次数得到最优的组合信息.已有研究发现Fenton氧化受到水中pH值、H2O2投加量、n(H2O2)/n(Fe2+)和反应时间的影响[9].因此选择这四个因素作为主要的影响因子,每个因素取3个影响水平进行正交试验,因素水平表见表2.通过正交试验设计(表3),使得原本需要做34次试验才能得到的最优化组合信息,只需进行9组试验即可得到.


1.3.2 正交试验结果及分析 采用极差分析法分析正交试验的结果(表3).极差分析法又称为直观分析法,简单易懂、实用性强、应用广泛,能够得到试验的主次因素及最优组合.该方法需要计算各水平的均值Kij(i=1,3),以及各因素的极差R,即最大值和最小值之差,R=MAX(Kij)-MIN(Kij),计算结果见表4.根据极差R可以判断,Fenton氧化实验中pH值为关键因子,H2O2投加量为主要因子,n(H2O2)/n(Fe2+)和反应时间为次要因子.根据各水平均值Kij能够得到反应的最佳组合条件为A1B3C2D3,即pH=3,H2O2投加量为60 mL/L,n(H2O2)/n(Fe2+)=15,反应时间为90 min.在最佳Fenton氧化条件下,测得水中CODCr的去除率为49.2%.
1.4 单因素试验
1.4.1 pH值的影响 当pH值偏高,溶液中OH-浓度过高,不仅会抑制·OH的产生,而且Fe2+会与OH-反应生成沉淀[10];当pH值偏低时,溶液中H+浓度过高,不仅抑制Fe3+还原为Fe2+,使得产生的·OH量减少,而且H+还会与·OH反应生成H2O[11].因此确定Fenton氧化合适的pH值条件,对高效去除废水中的有机污染物具有重要意义.实验首先利用硫酸和氢氧化钠将废水pH值分别调节为2、3、4、5、6后,加入60 mL/L

图1 溶液pH值对Fenton氧化的影响Fig.1 Effects of pH value on Fenton oxidation
的H2O2和n(H2O2)/n(Fe2+)=15的Fe2+,反应90 min后离心过滤取上清液测量水中的CODCr值.从实验结果可以看到,pH在3~5范围时Fenton氧化高含油废水的效果较好,pH=3时反应对废水中有机物的去除率最高.废水pH值由6降至3时,有机物的降解效率提高了28.5%.
1.4.1 H2O2浓度变化的影响 固定废水pH=3,投加不同量的H2O2和相应的Fe2+,反应后取上清液测量废水中有机物的浓度随氧化时间的变化,得到图2.从图中可以看到,H2O2浓度对废水中有机物的去除率有较大影响.在Fenton氧化反应的前半小时内,废水有机物浓度迅速下降,之后有机物浓度降解的速度明显变慢,90 min后CODCr浓度基本处于稳定状态,很难再进一步被降解.

图2 H2O2浓度对Fenton氧化的影响Fig.2 Effects of H2O2 concentration on Fenton oxidation
当H2O2浓度较低时,反应速度较慢,随着H2O2浓度的增加,废水中有机物的浓度明显降低.这是由于随着H2O2浓度和Fe2+浓度的增加,促使 H2O2快速分解产生大量的·OH,从而加快有机物降解速度.但是当H2O2和Fe2+过量时,Fe2+会还原H2O2,且自身氧化形成Fe3+,在消耗药剂的同时还增加了废水的色度[12].当H2O2浓度变化从40 mL/L增加至60 mL/L 反应90 min后,测得有机物的去除率变化从33.1%增至49.2%,废水中有机物的浓度明显减少.但是当H2O2浓度继续增加至70 mL/L有机物氧化的速度明显变慢,有机物的去除率仅增至51.4%.
1.4.2 废水初始浓度变化的影响 将原有高含油工业废水稀释2、5、10倍,得到不同的初始浓度,不改变Fenton试剂投加量,测量废水中有机物浓度随反应时间的变化,得到图3.从图中可以看到初始浓度高的废水的去除率明显高于初始浓度低的废水,反应90 min后,初始CODCr浓度为147 g/L废水比初始浓度为14.7 g/L废水的有机物去除率高出了约4.3%.这是由于浓度高的废水有机物与Fenton试剂接触反应的机会比浓度低的更多,反应速度更快.有研究表明,污染物浓度越高,强氧化物质·OH的利用率也越高[13].
1.4.3 温度变化的影响 选择由正交试验得到的最佳反应条件,在不同温度下对废水进行Fenton氧化实验.从图4可以看到,随着温度的升高,Fenton氧化反应的速度加快.从分子动力学角度分析,温度升高使得分子动能增加,分子间相互碰撞的频率增大;同时升高温度可以加速Fenton试剂生成强氧化物质·OH,使得Fenton氧化的效率提高[14].但是温度从298 K上升到328 K,Fenton氧化效率也仅提高了约4%,说明温度对氧化效率的影响较小.

图3 废水初始浓度对Fenton氧化的影响Fig.3 Effects of the initial concentrationon Fenton oxidation图4 废水温度对Fenton氧化的影响Fig.4 Effects of the temperature onFenton oxidation
2 动力学分析
2.1 动力学模型
通过建立数学模型分析污水中有机物降解的动力过程,可以优化污水处理设计方案,指导污水处理的运营管理与控制.采用初始浓度法进行动力学研究,建立表观动力学模型[15]:
(1)
其中S为废水中有机物的浓度,mg/L;K为反应速率常数,L·(mg·min)-1;m,n,j分别为各底物反应级数.由于在正交试验中已经确定n(H2O2)/n(Fe2+)=15,因此方程(1)简化并取对数得到方程(2):
(2)
(3)
其中K1,k0为反应速率常数, L·(mg·min)-1;q为反应级数;E0为反应活化能,kJ/mol;R普适常数,8.314J/(mol·K);T为温度,K.
2.2 结果分析
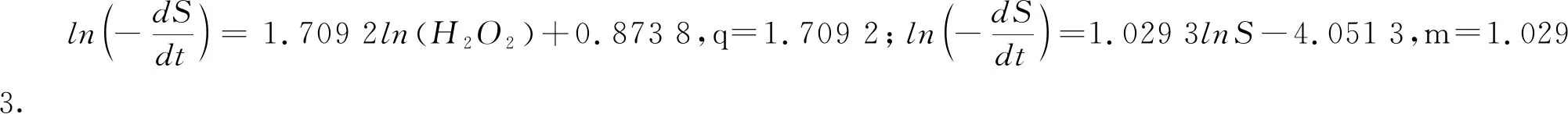
从各底物反应级数可以看出,H2O2的反应级数为1.709 2比有机物初始浓度的反应级数1.029 3大.这说明Fenton氧化反应中,H2O2浓度的影响比有机物初始浓度大,制约反应的主要因素是H2O2的浓度.反应的初始活化能为9.15 kJ/mol,较低的活化能说明反应相对容易进行.
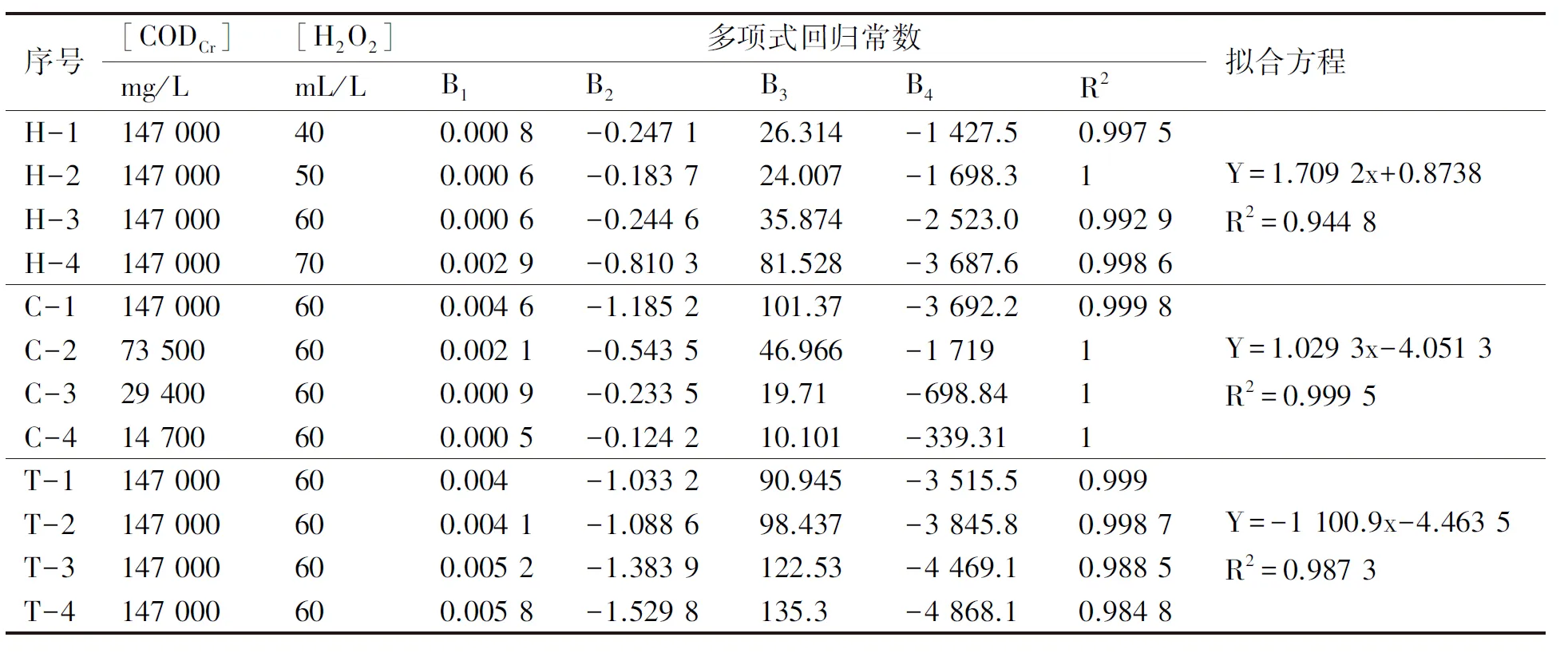
表5 不同操作条件对初始反应速率的影响Tab.5 Effects of various operating conditions on initial reaction rate

图5 拟合曲线图Fig.5 Fitting curves
3 结论
(1)选择Fenton氧化反应中pH值、H2O2投加量、n(H2O2)/n(Fe2+)和反应时间四个因素和三个影响水平设计正交试验.极差分析法分析得到Fenton氧化试验中pH值为关键因子,H2O2投加量为主要因子,反应最佳组合条件为pH=3,H2O2投加量为60 mL/L,n(H2O2)/n(Fe2+)=15,反应时间为90 min.在此条件下,测得Fenton试剂对废油提炼厂产生的高含油废水CODCr的去除率为49.2%.
(2)根据Fenton氧化反应的单因素实验结果,进行多项式拟合,建立表观动力学模型:
从模型的物理意义上看,制约Fenton氧化反应速率的主要因素是H2O2投加量,反应的初始活化能较低说明反应相对容易进行.

