肥胖大鼠袖状胃切除术后骨折风险增加的初步探讨
王 强,岑晓霞,温兴铸,李 伟,张 伟
(海军军医大学长征医院普外三科,上海 200003)
当前,减重手术治疗肥胖及相关并发症疗效确切且安全,但随着手术数量的增加,越来越多的临床证据表明,减重术后骨健康状态会出现变化[1-3],主要表现术后随着显著的生化、激素和机械应力的改变可能明显提升骨折风险。袖状胃切除术(sleeve gastrectomy,SG)已经成为当前国际上最流行的减重手术,目前虽有临床数据提示SG术后骨健康状态恶化[3],但关于SG术后骨健康状态变化和机制研究的动物实验尚较欠缺。本研究以肥胖SD大鼠为模型,初步探讨SG术后对大鼠骨折风险升高的主要表现以及可能的机制。
材料与方法
1 实验对象及分组
本研究共采购6周龄清洁级雄性SD大鼠40只,由海军军医大学实验动物中心提供[许可证号:SCXK(沪)2007-0003,动物伦理申请号:20175001126]。
构建肥胖大鼠模型:将40只SD大鼠随机分成高脂饲料组(30只)和普通饲料组(10只)。高脂饲料组大鼠给予高脂高糖饲料喂养,两组同时喂养8周后,高脂饲料组中体质量超过对照组平均体质量120%的大鼠定为饮食诱导的肥胖大鼠,最终共26只大鼠诱导成功。
26只肥胖大鼠再次随机分为肥胖组(10只),SG组(16只)。SG组大鼠施行SG术,共6只大鼠在术后围手术期死亡。故最终进入实验的三组:空白对照组(原普通饲料组),肥胖组(肥胖大鼠),SG组(肥胖大鼠+SG术),各10只。
2 实验方法
大鼠均术前24h禁食,术前10h禁水。严格称重后采用10%水合氯醛300mg/kg腹腔注射麻醉。
SG组:大鼠充分麻醉待检查疼痛反射及角膜反射消失后,取仰卧位固定于操作台上。备皮、常规消毒、铺无菌洞巾、换无菌手套。取腹部正中长2~2.5cm切口,以剑突下2~3cm为宜。进腹后以盐水纱布缝盖切口。用无菌医用棉签轻柔地牵拉开肝脏,以暴露大鼠胃。无损伤镊子将胃从腹腔中游离出,离断肝胃韧带及胃脾韧带,5-0丝线结扎、离断朝向脾门的胃短血管和幽门旁的胃网膜血管。用无损伤肠钳在胃大弯处夹闭,距幽门部3~5mm起向贲门his角下沿肠钳切除整个胃底和3/4胃体。盐水棉签清理残胃后用5-0可吸收缝线连续缝合胃切缘,出血处适当以间断缝合加固。检查无活动性出血,温热生理盐水冲洗腹腔2~3次后关腹。
大鼠术后立即予皮下注射葡萄糖生理盐水20mL,常规禁食禁水24h,术后1~3d给予半流质(氨素奶粉+少许饲料碎末搅拌而成)。术后第7天恢复各组术前饮食(不限量),术后第2周开始分别计算各组大鼠每周平均日进食量;实验结束后,动物均通过10%水合氯醛过剂量麻醉行安乐死。
3 观察以及检测指标
(1)术前1d及术后8周每天定时监测大鼠体质量;术后第2周起每天记录每只大鼠的摄食总量,计算每周日均摄食量。(2)术后8周通过ELISA法测定三组大鼠血清血钙、甲状旁腺素(parathyroid hormone,PTH)和25-羟基维生素D3[25(OH)D3],以上试剂盒均由上海研谨生物公司提供。(3)术后8周通过双能X线骨密度仪测定右侧股骨以及脊柱的骨密度(bone mineral density,BMD)。(4)术后8周通过ELISA法测定三组大鼠血清骨代谢相关指标:I型胶原蛋白C端末端肽(C-tenninal cross linked peptide,CTX)、I型前胶原氨基端前肽(Procollagen type ⅠN-terminal propeptide,PINP)、抗酒石酸酸性磷酸酶-5a(tartrate resistant acid phosphatase,TRACP-5a)、抗酒石酸酸性磷酸酶-5b(tartrate resistant acid phosphatase,TRACP-5b),以上试剂盒均由上海研谨生物公司提供 。(5)术后8周处死大鼠,取右侧股骨以及胫骨中上段,通过HE染色观察骨细胞、软骨细胞、骨小梁以及炎细胞浸润等情况。(6)通过取肥胖组和SG组胫骨中段骨髓组织石蜡包埋后HE染色,在高倍镜下选取3个不连续的视野,人工计算脂肪细胞数量并取平均值进行比较。
4 统计学分析

结 果
1 体质量以及摄食量的变化
空白对照组、肥胖组和SG组术前体质量分别为(374.51±15.68)g、(487.30±13.70)g和(483.51±11.19)g,肥胖组与SG组体质量比较差异无统计学意义。SG组术后第1周体质量迅速下降,最低体质量出现在术后第8天(411.23±14.87)g,随着术后不限量饮食的开放,SG组术后的体质量再次缓慢上升。至术后第8周,三组的体质量分别为(437.50±10.76)g、(550.78±10.76)g和(473.45±6.62)g。术后第1天至术后8周每日测定各组体质量,SG组体质量均显著低于肥胖组(P<0.05),提示SG手术干预成功。
三组术后第2周摄食量分别为(29.34±1.19)g、(32.11±0.94)g和(15.89±1.12)g,SG组显著降低(P<0.05)。随后SG组术后的摄食量缓慢增加,至术后第8周,三组的摄食量分别为(30.98±1.29)g、(32.17±1.17)g和(29.41±4.37)g,组间比较差异无统计学意义(P>0.05)。
2 BMD变化
双能X线BMD仪测定结果提示肥胖组股骨和脊柱BMD较空白对照组大鼠显著降低(P<0.05),SG组术后大鼠的BMD进一步降低,组间比较差异有统计学意义(P<0.05)。见图1a、b。
3 骨组织学的变化
股骨HE染色(图2a),SG组较其他两组骨小梁显著变细,部分出现断裂和穿孔,骨小梁间隔增宽和连接消失。同时部分大鼠股骨出现骨皮质变薄,炎细胞浸润增加。肥胖组和SG组胫骨骨皮质无显著肉眼可见的差异,但SG组的骨小梁同样显著变细(图2b)。
4 血钙、PTH和25(OH)D3
术后8周空白对照组、肥胖组和SG组血钙分别为(2.21±0.47)mmol/L、(2.33±0.59)mmol/L和(2.20±0.51)mmol/L,PTH各组分别为(32.85±4.18)ng/L、(34.55±6.42)ng/L和(35.01±8.91)ng/L,25(OH)D3分别为(18.21±3.95)μg/L、(18.58±4.44)μg/L和(19.34±6.73)μg/L,差异均无统计学意义(P>0.05)。结合SG后摄食量的结果,提示SG能有效控制体重,但对营养物质,特别是Ca吸收未造成显著影响。
5 骨代谢指标的变化
肥胖组和SG组CTX较空白对照组显著升高,但肥胖组和SG组组间无差异(P>0.05)。图1c。肥胖组和SG组的血清PINP亦较空白对照组显著升高,但两组组间无差异(P=0.09)。图1d。肥胖组TRACP-5a较另外两组显著升高,SG组与空白对照组比较差异无统计学意义(图1e)。SG组TRACP-5b显著高于空白对照组,但与肥胖组比较差异无统计学意义,空白对照组与肥胖组比较差异亦无统计学意义(图1f)。
6 骨髓脂肪细胞
肥胖组和SG组胫骨中段脂肪细胞数量分别为(11.2±2.8)个和(13.7±3.9)个,两组比较差异无统计学意义(P=0.11)(图3)。
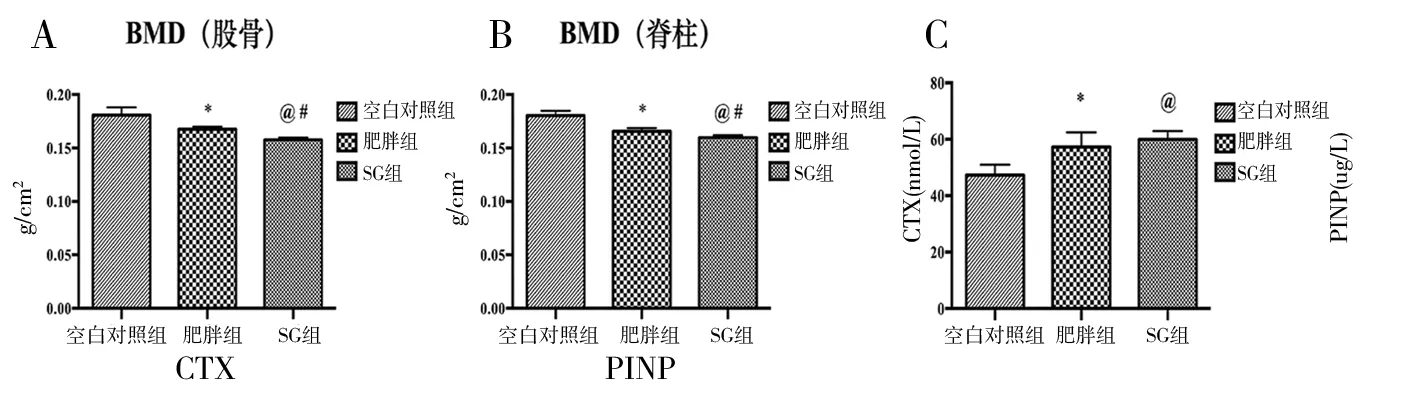
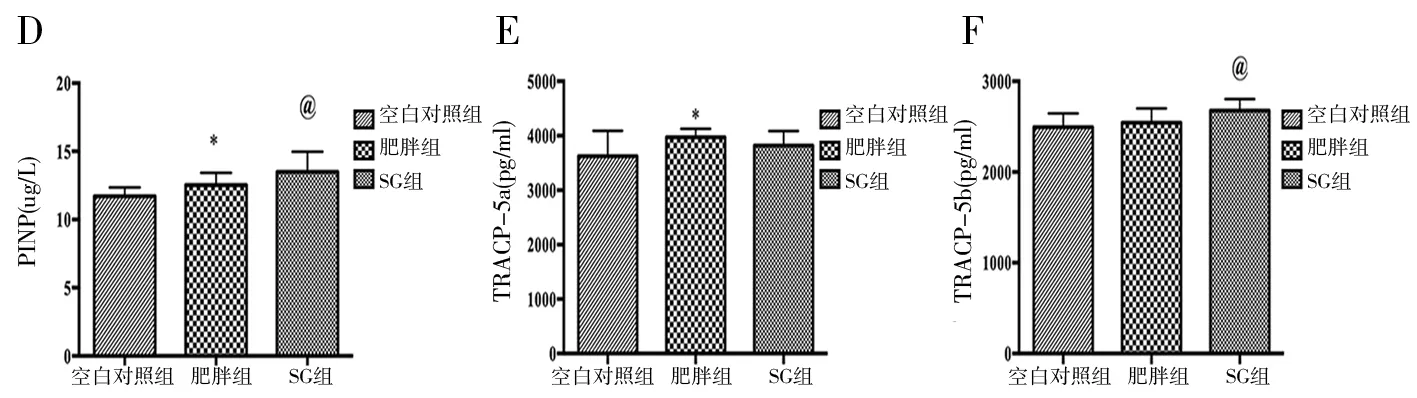
图1 术后8周三组BMD、CTX、PINP、TRACP-5a和TRACP-5b比较(*P<0.05空白对照组 vs.肥胖组;@P<0.05空白对照组 vs.SG组;#P<0.05肥胖组vs.SG组)

图2 术后8周股骨和胫骨HE染色(10×10)。a.三组右侧股骨HE染色(10×10,SG组较其它两组骨小梁显著变细,部分出现断裂和穿孔,同时部分大鼠股骨出现骨皮质变薄,炎细胞浸润增加);b.肥胖组和SG组胫骨HE染色(10×10,SG骨小梁显著变细,部分出现断裂和穿孔,炎细胞浸润增加)
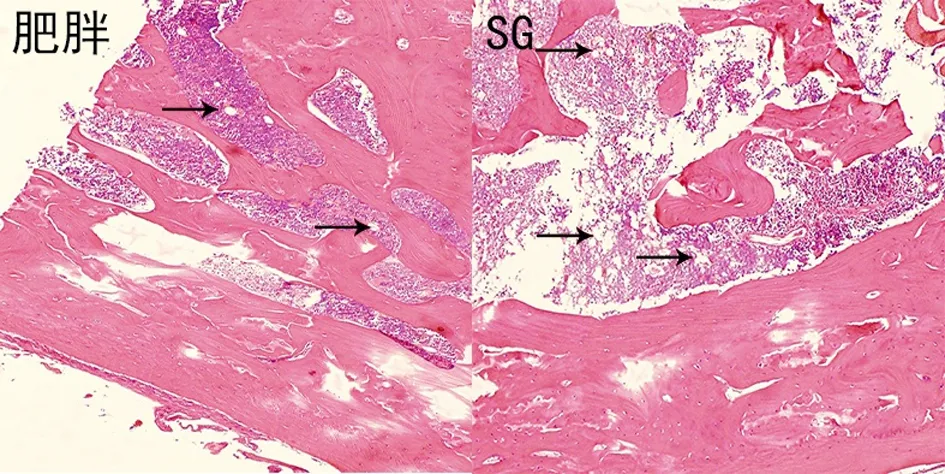
图3 术后8周肥胖组和SG组胫骨中段HE染色(10×40,黑箭头所示为骨髓中的脂肪细胞)
讨 论
2018年联合国粮农组织关于超重以及肥胖问题的报道指出,超重和肥胖已成为一种全球性的“流行病”。SG术由于其确切的疗效以及较少的并发症已经逐渐取代胃旁路手术,逐渐成为最流行的减重手术。已有报道指出SG术后会出现骨密度持续性降低和骨折风险的增加。本研究SG大鼠模型中发现SG可能导致骨折风险[1,3-5]升高,主要表现为大鼠股骨和脊柱的BMD显著下降,股骨和胫骨的骨小梁破坏明显,最初的理论常认为是SG术后能量摄入的减少导致了骨健康的恶化。但在本研究中术后第2周即恢复SG组不限量的高脂饮食,至术后第8周的摄食量已与其他两组比较差异无统计学意义。另一方面,三组的血钙、PTH以及25(OH)D3差异无统计学意义,因此不能以机体能量摄入和骨代谢原料[血钙和25(OH)D3]的减少来解释SG术后骨健康状态的变化。
骨代谢生化指标包括钙磷代谢调节指标、骨形成标志物、骨吸收标志物、激素与细胞因子。虽然骨代谢指标不能作为诊断骨相关疾病的金标准,但是常用于评价骨代谢状态、预测骨折风险等。CTX是骨吸收的重要指标,其升高程度与破骨细胞[6-7]活性增高相一致[8]。TRACP-5b作为第二代骨吸收标志物,是一个有特异和高敏感的骨吸收指标,主要来源于破骨细胞。CTX和TRACP-5b在骨质疏松患者中明显增高,对于骨折风险预测具有主要的意义[7,9]。PINP是新骨形成的特异性敏感指标,在儿童发育期、妊娠晚期、骨肿瘤和骨转移等情况下会明显升高。Ivaska等[6]报道19例糖尿病肥胖患者和27例非糖尿病肥胖患者行旁路手术和SG术,术后6个月检测CTX、PINP和TRACP-5b等骨代谢指标,发现旁路手术和SG术后骨代谢指标均明显增高,同时在体重减轻后2型糖尿病缓解的患者中骨代谢指标变化的更为显著。本研究中CTX、PINP以及TRACP-5b的结果提示肥胖个体骨代谢指标显著活跃,主要表现在骨吸收和骨形成的平行增加,而以骨吸收升高更为明显。由于检测时点为体重已达平台期,负重变化的影响可忽略。而SG术后增加能量摄入不可逆转骨损害,提示SG术所造成的骨损害不单单与能量平衡状态有关。
有研究指出SG术后造成显著的腰椎和股骨干骨髓脂肪组织积聚,并与骨密度降低显著相关[10],这提示SG术后体脂肪减少和骨髓脂肪组织异常积聚的重分布现象可能与骨健康恶化相关。骨髓脂肪细胞(bone marrow adipose tissue,BMAT)在同时参与能量代谢和骨重塑形成过程中是桥接能量和骨代谢的媒介,主要可以分为结构性BMAT(cBMAT)和调节性BMAT(rBMAT),两者在分布范围及造血潜能方面截然不同[11-12]。因此在特殊的能量状态下(如SG术后)可能会影响骨髓微环境的变化,并进一步影响骨髓间充质干细胞骨化/脂化的种系分化走向,从而影响骨的代谢与更新。本研究初步分析了胫骨骨髓中的脂肪细胞个数,虽然SG组的脂肪细胞数较高脂组高,但并未达到统计学差异。分析原因,一方面可能与实验时间以及样本数量有关,另一方面可能与选取标本的部位和采取计数方法的精密度不同有关。即便如此,研究结果提示了一个方向,即SG术后BMAT的变化是否是骨健康恶化的原因。进一步精确的分析BMAT数量、超微结构以及骨髓脂肪微环境的分子表达状况,如脂环素、瘦素和脂类组学,可能更为精确地判断SG术后骨髓脂肪细胞的变化,并对SG术后骨健康状态变化做出更全面的解释。

