胰岛素致外源性胰岛素抗体综合征患者的临床特点*
程运杰,王晓丽,张培培,常向云
(1.石河子大学医学院,石河子 832000;2.浙江省立同德医院之江院区内分泌科,杭州 310012;3.石河子大学医学院第一附属医院内分泌科,石河子 832002)
自从19世纪20年代胰岛素上市以来,糖尿病的治疗发生历史性变革,胰岛素拯救无数人的生命。然而,很快发现外源性动物胰岛素的应用可诱发机体产生胰岛素抗体(insulin antibodies,IA),导致超敏反应、胰岛素抵抗及低血糖[1]。后来,又发现重组人胰岛素、胰岛素类似物亦可以诱导机体产生IA,其程度低于动物胰岛素,这种现象被称之为外源性胰岛素抗体综合征(exogenous insulin antibody syndrome,EIAS)[2]。EIAS的特点为应用外源性胰岛素后出现高滴度的血清IA,高水平的血清胰岛素且与C肽水平不平行,严重的胰岛素抵抗,较大的血糖波动,餐后高血糖、夜间或早晨低血糖,严重者致昏迷等[3]。EIAS引起低血糖在临床上往往被误诊或漏诊,目前国内外报道较少。近年来,随着糖尿病患病率上升,胰岛素应用增加,EIAS的发病有增加趋势。笔者在本研究拟探讨EIAS患者临床特点及随访24周临床转归情况,复习相关文献,提高临床医师对本疾病的认识和诊治能力。
1 资料与方法
1.1资料来源 2015年1月—2018年6月于石河子大学医学院第一附属医院内分泌科临床确诊的注射胰岛素后导致EIAS的糖尿病患者,共收集病例16例,排除标准:感染急性期,严重肝、肾疾病,恶性肿瘤,自身免疫性疾病,服用含巯基药物史,服用免疫抑制药,妊娠或哺乳期妇女。
1.2方法 收集患者一般临床资料包括性别、年龄、体质量指数(BMI)、糖尿病病程、胰岛素使用时间、胰岛素使用种类、注射次数、低血糖发生情况。实验室检查包括:肝功能、肾功能、血常规、甲状腺功能、肿瘤标志物等。所有患者行100 g馒头餐试验,检测空腹血糖(FBG)、餐后2 h血糖(2hBG)、空腹胰岛素(FINS)、空腹C肽(FCP)、2 h胰岛素(2hINS)、2 hC肽(2hCP)、糖化血红蛋白(HbA1c)等;检测糖尿病相关抗体,包括IA、胰岛细胞抗体(islet cell antibody,ICA)、谷氨酸脱羧酶抗体(glutamic acid decarboxylase antibody,GADA)、蛋白络氨酸磷酸酶抗体(IA-2A)。完善腹部B超或CT检查,除外胰腺肿瘤。经调整治疗方案,于第12,24周随访,再次行100 g馒头餐试验,检测FBG、2hBG、FINS、2hINS、HbA1c水平,于第24周复查IA,记录低血糖发生情况及药物治疗情况。胰岛素自身抗体检测采用免疫印迹法(定性检查,正常为阴性);血清胰岛素及C肽测定采用化学发光法(正常参考范围为FINS 17.8~173 pmol·L-1,FCP 0.26~0.6 nmol·L-1);HbA1c采用高效液相色谱法(我院正常参考范围为<6.5%)。所有患者均完善胰腺B超或CT检查,排除胰腺肿瘤。
1.3仪器 全自动化学发光免疫分析仪(德国罗氏公司);全自动蛋白印迹仪(深圳亚辉龙公司);全自动糖化血红蛋白分析仪(日本爱科来公司);全自动生化分析仪(美国贝克曼公司);全自动模块式血液体液分析仪(日本希森美康公司)。
2 结果
2.1基本临床资料 16例患者中,男10例,女6例,男:女=5:3,年龄37~79岁,糖尿病病程5~22年,BMI19.3~29.4 kg·(m2)-1,超重/肥胖者[BMI ≥24 kg·(m2)-1]9例。肝、肾功能方面,除病例10的丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)轻度升高(考虑脂肪肝所致),其他患者ALT、AST均正常。所有患者血肌酐(creatinine,Cr)均在正常范围,肾小球滤过率(glomerular filtration rate,eGFR)在50.2~121.2 mL·min-1·(173 m2)-1。见表1。
2.2胰岛素使用、低血糖情况及自身抗体检测结果 16例患者中使用门冬胰岛素30者6例,使用精蛋白锌重组人胰岛素30/70者4例,使用鱼精蛋白锌胰岛素(NPH)者3例,使用精蛋白锌重组赖脯胰岛素25R 者2例,使用门冬胰岛素50者1例。使用胰岛素时间1~13年,胰岛素剂量16~52 U·d-1,注射次数每天1~3次,低血糖发生时间:空腹5例,早餐后2例,午餐前4例,晚餐前3例,夜间6例,晚餐后3例,IA均为阳性,GADA、ICA、IA-2A均为阴性。见表2。
2.3实验室检查及药物治疗调整情况 16例患者HbA1c为6.2%~13.2%,所有患者行100 g馒头餐试验,结果显示:FINS及2hINS均明显升高,存在胰岛素、C肽分离现象。住院期间给予调整治疗方案,所有患者均停用原胰岛素,改为口服药物或更换胰岛素剂型,其中单用二甲双胍1例,单用糖苷酶抑制剂2例,二甲双胍联合糖苷酶抑制剂 6例,噻唑烷二酮联合糖苷酶抑制剂1例,使用GLP-1受体激动剂 2例,使用长效胰岛素类似物联合口服药物治疗4例。见表3。教育患者少量多餐,鼓励进食燕麦、谷物、荞麦、大麦等没有加工的谷物。鼓励温和的有氧运动,如餐后散步,避免空腹剧烈的运动等。

表1 患者一般临床资料

表2 16例患者胰岛素使用、低血糖情况及自身抗体检测结果
2.4随访资料 16例患者均于调整治疗后12,24周进行门诊随访,再次行100 g馒头餐试验。第12周随访,1例(例5)失访,其余病例FINS、2hINS均明显下降,2例(例2,8)FINS、2hINS恢复正常;5例(例1,7,9,10,11)患者报告偶尔有低血糖症状发作,发作频率少于每周1次,主要为夜间及空腹出现,进食后症状可缓解,无严重低血糖发生。第24周随访,失访2例(例3,10),病例11拒绝行馒头餐试验;部分患者FBG、2hBG、HbA1c有升高趋势;12例患者FINS恢复至正常范围,1例FINS仍偏高;复查IA,4例阳性,9例阴性,无低血糖发生。见表4。
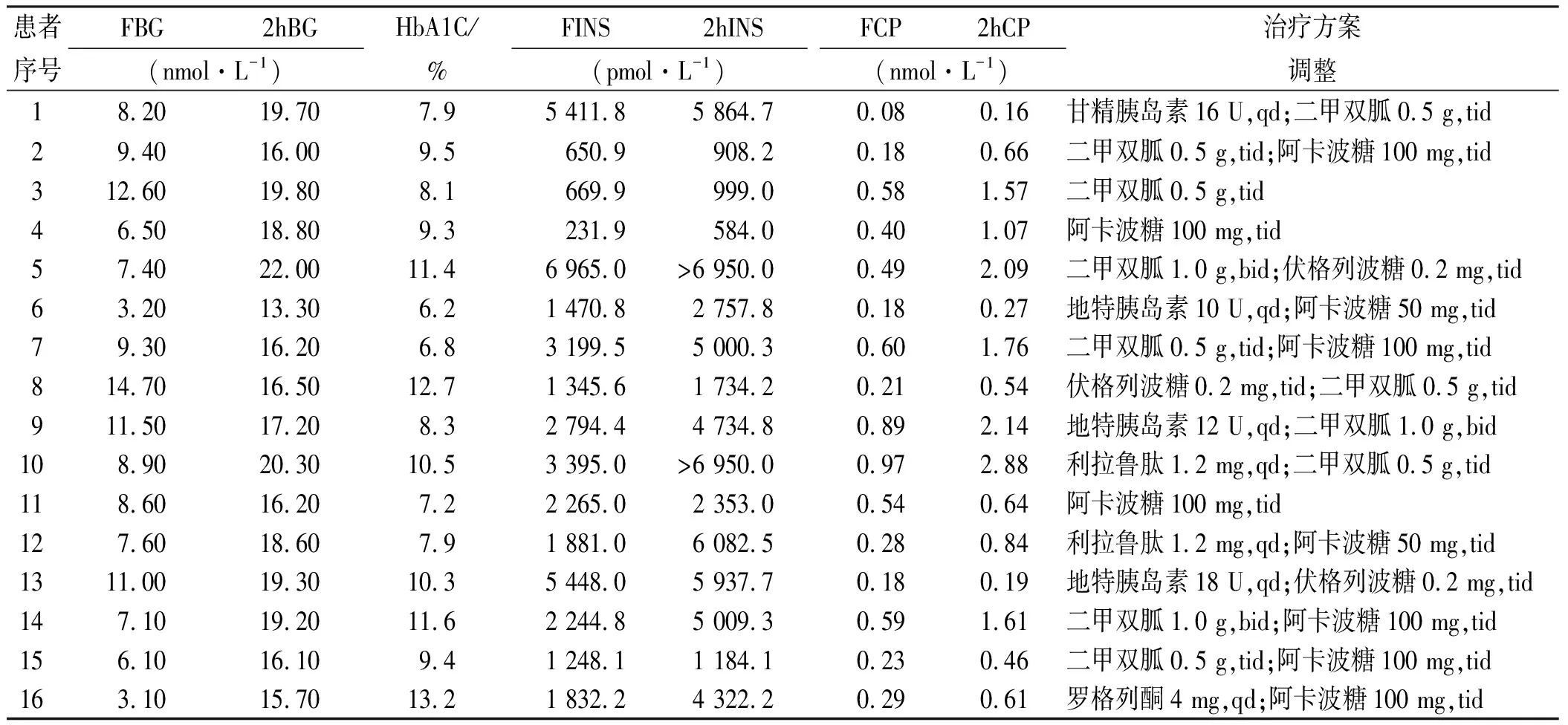
表3 实验室检查及药物调整情况
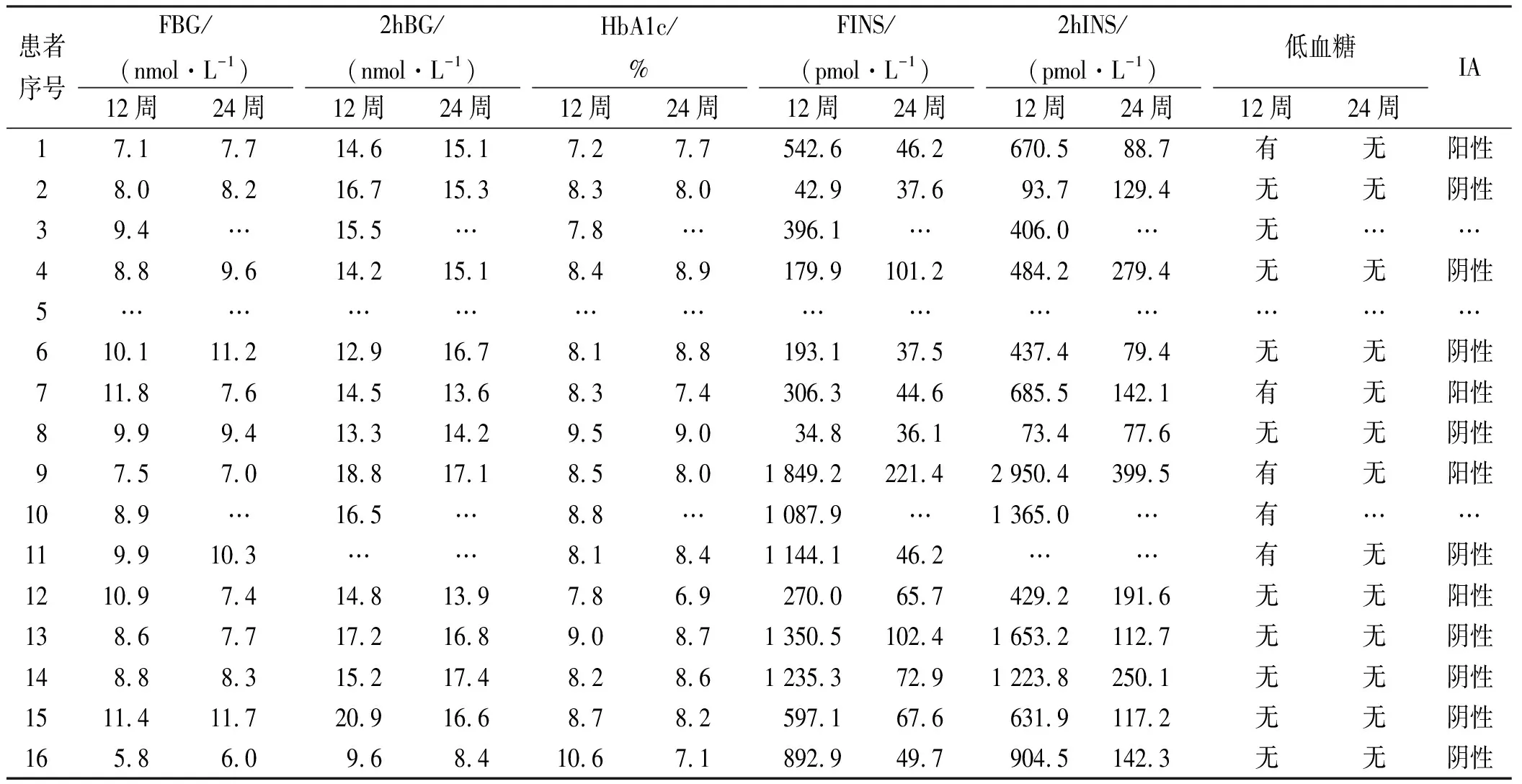
表4 16例患者治疗后第12周、第24周随访资料
3 讨论
EIAS是指有外源性胰岛素使用史,无巯基药物应用史,无活动性自身免疫性疾病,排除胰岛素瘤、B型胰岛素抵抗和其他原因的低血糖,出现反复发作的自发性低血糖症,高浓度免疫活性的胰岛素与C肽浓度分离,针对外源性胰岛素产生IA的综合征[4]。临床上,使用胰岛素的糖尿病患者出现低血糖,往往会被认为是胰岛素剂量过大或进食减少,EIAS常被忽视。然而,EIAS并不少见。国外研究提示,在使用人胰岛素的糖尿病患者中IA的产生率高达80%[5]。我国目前没有关于EIAS的大样本数据,仅有少数个案报道。本研究收集16例EIAS患者,并进行为期24周的随访,报道例数相对较多。
因EIAS与胰岛素自身免疫综合征(insulin autoimmune syndrome,IAS)均可表现为低血糖和IA阳性,临床上容易将两者混淆。两者主要鉴别点,①诱因不同:EIAS为糖尿病患者使用外源性胰岛素后诱导产生IA;IAS患者可以是糖尿病或非糖尿病患者,大多由服用含巯基的药物诱发,如甲巯咪唑、硫普罗宁、青霉胺、异烟肼、普鲁卡因胺等,而无胰岛素使用史,常伴有其他自身免疫性疾病,如Graves病、类风湿关节炎、多发性硬化症、系统性红斑狼疮、黑棘皮病等[6-7];②IA的特点不同:EIAS患者体内IA是外源性胰岛素诱导产生的,其特点为低胰岛素结合容量和相对高的胰岛素亲和力,对血糖的影响相对不大,可表现为低血糖,也可表现为高血糖;IAS的IA是针对内源性胰岛素产生,具有高结合容量低亲和力的特点,临床上常导致极严重的自发性低血糖,甚至昏迷[8]。现有检测手段不能区分外源性胰岛素抗体和内源性胰岛素抗体,只能依据病史来判断。本研究中,16例患者均有胰岛素使用史,无含巯基类药物使用史,无自身免疫性疾病,因此符合EIAS诊断。笔者发现,EIAS患者间的异质性较强,低血糖的发生与胰岛素水平的高低无明显关系。本研究中,仅1例患者表现为低血糖昏迷,13例为轻度低血糖,2例患者病程中无低血糖发生而表现为高血糖,分析可能原因是IA为多克隆抗体,不同个体间产生的IA有较大差异,胰岛素与抗体的结合部位不同,这使得胰岛素的生物学效应在不同个体间产生很大差异。笔者分析,胰岛素与抗体的不适当大量解离可造成低血糖,解离的程度不同,造成低血糖的严重程度不同;而胰岛素与抗体结合后的缓慢、延迟解离造成游离胰岛素量过少,可导致高血糖。本研究中EIAS患者低血糖多发生在夜间或空腹,引起此现象的原因可能是由于夜间血液酸度升高,增加IA的解离,另一方面夜间无食物摄入也可能是引起低血糖的原因[9-10]。
以往人们认为,动物胰岛素与人胰岛素的氨基酸序列不同,会增加其免疫源性。但是近年来文献报道[6,11],重组人胰岛素、胰岛素类似物均可产生IA,诱发EIAS。本研究中,16例患者使用的胰岛素主要为重组人胰岛素和胰岛素类似物,包括:精蛋白锌重组人胰岛素30/70、鱼精蛋白锌胰岛素、精蛋白锌重组赖脯胰岛素25R、门冬胰岛素30、门冬胰岛素50,本研究中未发现注射长效胰岛素类似物(如甘精胰岛素、地特胰岛素)产生IA的病例。研究报道[12],胰岛素类似物的免疫原性大于重组人胰岛素,可能是胰岛素类似物与人胰岛素的氨基酸序列及修饰集团不同导致的。也有研究报道[13],皮下注射胰岛素类似物产生的IA与人胰岛素诱导的IA并无显著差别。外源性胰岛素还可产生多种免疫反应,如脆性糖尿病、胰岛素过敏及IAS[9,14],而胰岛素注射部位的脂肪萎缩可能与局部免疫复合物的沉积有关[15]。
EIAS具有自限性,预后良好,治疗方法主要是更换胰岛素剂型或停用胰岛素,改为口服药物降糖,极个别患者需要使用糖皮质激素或血浆置换治疗。多数患者停用胰岛素后,随着自身抗体逐渐清除,低血糖发作会随着抗体滴度和血清胰岛素水平降低而缓解[16]。本研究中16例患者停用胰岛素或更改剂型,饮食以碳水化合物为主,少量多餐,给予二甲双胍、α-葡萄糖苷酶抑制剂、噻唑烷二酮类等药物控制血糖,24周内低血糖症状逐渐改善,均未使用糖皮质激素或血浆置换治疗,大多数患者血清胰岛素水平下降至正常范围。有研究报道,EIAS患者的胰岛素抗体在胰岛素停用6~17个月消失[17-18]。本研究中,完成随访13例患者,9例IA在24周转阴。考虑抗体消失时间与最初抗体滴度和不同个体对胰岛素及抗体的清除率不同有关。
本研究中部分患者在停用原胰岛素改为口服药物治疗后,血糖有升高趋势,这些患者在IA转阴后仍需要再次启用不同剂型的胰岛素控制血糖。例如病例13,糖尿病病程较长,空腹及餐后C肽低平,考虑目前长效胰岛素类似物诱导EIAS的报道较少,故停用原胰岛素后给予地特胰岛素联合α-葡萄糖苷酶抑制剂治疗,第12周随访发现胰岛素水平仍较高,血糖控制不佳,尤其餐后血糖升高明显,因担心加用餐时短效胰岛素可能加重EIAS的高胰岛素血症,故医嘱加强生活方式干预,第24周胰岛素水平下降、IA转阴后,给予加用餐时短效胰岛素,最终血糖控制情况改善。对于这类病程长、自身胰岛功能差的EIAS患者,如果血糖长期得不到控制,可能诱发酮血症,或许可以尝试更早地积极启用“三短一长”胰岛素替代方案进行治疗,并密切监测血清胰岛素变化。
综上所述,随着糖尿病患者病程的进展,胰岛功能减退,胰岛素成为控制血糖的最有力“武器”。在使用胰岛素的过程中,患者可能出现低血糖、血糖大幅度波动情况,临床医师应考虑监测胰岛素、C肽、胰岛素抗体等,筛选出EIAS,及时停用胰岛素或更换剂型。多数EIAS患者在停用原胰岛素后24周内胰岛素水平恢复至正常范围,而IA转阴的时间相对滞后。

