荆芥穗多糖的免疫调节活性*
朱瑜丹,李仲昆,梁月琴,夏洪颖,李翠红,王重娟
(昆明医科大学附属延安医院药学部,昆明 650051)
荆芥穗(Herbaschizonepetae)为唇形科植物荆芥SchizonepetatenuisfoliaBriq.的干燥花穗,味辛,性微温,归肝肺经,是一味常用的中药解表药[1]。荆芥穗用药历史悠久。民间用于治疗头风、虚劳、妇人血风等[2]。现代药理学研究证明,荆芥穗具有抗炎、抗病毒和镇痛作用,并具有一定的抗补体作用[2]。荆芥穗治疗妇科血症、带下等疾病,也取得较好的效果[3],因此具有较高的开发价值。目前研究较多荆芥穗有效成分为其挥发油,化学成分种类繁多,主要是单萜和倍半萜成分,还含少量的醛、羧酸和酯类等化合物[4-5],而对于荆芥穗多糖却鲜有报道。多糖是中草药中重要组成成分,具有免疫调节、抗肿瘤、抗病毒、降血糖等作用。其中植物多糖的来源广泛、毒副作用小[6]。笔者通过水提醇沉法提取荆芥穗多糖(Herbaschizonepetaepolysaccharide,HSP),利用高效液相色谱(HPLC)分析HSP的单糖组成,并分别从体内外水平评价HSP的免疫调节活性,为其在食品与医疗保健中的应用提供依据。
1 材料与方法
1.1材料
1.1.1动物 无特定病原体(SPF)级雄性ICR小鼠,6~8周龄,体质量(20±2)g,购自湖南斯莱克景达实验动物有限公司,实验动物生产许可证号:SCXK(湘)2013-0004。动物实验方案已通过昆明市延安医院实验动物伦理委员会审批。实验动物饲养在昆明市延安医院中心实验室动物房中,室内温度(22±2) ℃,相对湿度50%~60%,12 h循环照明,实验开始前小鼠适应性饲养7 d,自由摄食和饮水。
1.1.2药物及试剂 荆芥穗(河北百草康神药业有限公司,批号:1806011),由昆明市延安医院李仲昆主任药师鉴定为荆芥穗。单糖标准品D-甘露糖(D- Mannose,Man,批号:10127360)、L-鼠李糖(L-rhamnose,Rha,批号:GG01)、D-葡萄糖醛酸(D-glucuronic acid,GlcA,批号:10136713)、L-半乳糖醛酸(L-galacturonic acid,GalA,批号:KBLFG)、D-葡萄糖(D-glucose,Glc,批号:10145311)、D-半乳糖(D- galactose,Gal,批号:10134490)、L-阿拉伯糖(L-arabinose,Ara,批号:V900920)、1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone,PMP,批号:BCBK6062V)、牛血清白蛋白(bovine serum albumin,BSA,批号:WXBC5159V)购自美国Sigma公司;细胞实验级Lipopolysaccharides(LPS)来源于大肠埃希菌 055:B5(批号:028M4138V),购自美国Sigma公司;噻唑蓝(MTT,批号:829Z051)购自北京索莱宝生物科技有限公司;FITC标记葡聚糖40(批号:20614)购自瑞典TdB Consultancy AB公司;DMEM高糖培养基(货号:SH30243.01B);胰蛋白酶(货号:SH30042.01)购自美国HyClone公司;注射用环磷酰胺(cyclophosv-namide,CY,批号:14122325)购自江苏盛迪医药有限公司;其他化学试剂均为分析纯。小鼠巨噬细胞Raw264.7购自加拿大ABM公司。
1.1.3仪器及设备 Agilent 1200型高效液相色谱仪(美国安捷伦公司);UV-2201型紫外分光光度计(日本岛津);KDC-2046低速冷冻离心机(安徽中佳科学仪器有限公司);RE-52AA 旋转蒸发仪(上海亚荣生化仪器厂);Model 550全自动酶标仪(美国 BIO-RAD公司);FC-500流式细胞仪(美国Beckman公司);Nikon50i光学显微镜(日本Nikon公司);FA2004电子分析天平(上海精密科学仪器有限公司,感量:0.1 mg)。
1.2荆芥穗多糖的提取 称取荆芥穗粉末300 g,置回流提取装置中,加入8倍量95%乙醇,70 ℃回流提取3 h以除去醇溶性小分子。药渣加入10倍量纯水,90 ℃回流提取2 h,重复提取2次,合并2次上清液。4000×g离心15 min,上清液于旋转蒸发仪浓缩至400 mL。向浓缩液中加入95%乙醇,使溶液中乙醇的终浓度为70%,静置过夜。该步骤重复3次以纯化多糖,沉淀置真空干燥箱40 ℃干燥48 h,得荆芥穗多糖(Herbaschizonepetaepolysaccharide,HSP)7.47 g,得率为2.49%,本研究只提取一个批次HSP,以下各实验均采用该批次HSP。
1.3总糖、糖醛酸及蛋白质含量测定 总糖含量测定采用苯酚-硫酸法[7];糖醛酸含量测定采用硫酸-四硼酸钠法[7];蛋白质含量测定采用考马斯亮蓝G-250染色法[7]。
1.4单糖组成分析 称取一定量单糖标准品(Man 1.53 mg、Rha 1.54 mg、GlcA1.05 mg、IdoA 1.05 mg、GalA 1.30 mg、Glc 1.07 mg、Gal 1.28 mg、Ara 1.14 mg)以及供试品HSP 7.15 mg,置于5 mL COD管中,以不加供试品的空白管为对照,每管加2 mol·L-1三氟乙酸1 mL,110 ℃中水解4 h。将水解液蒸干,用甲醇洗5次。加水1 mL溶解,取上述水解液50 μL与0.6 mol·L-1的氢氧化钠溶液50 μL混合;加0.5 mol·L-1PMP甲醇溶液50 μL,70 ℃烘箱反应30 min;取出放置10 min冷却至室温;加 0.3 mol·L-1盐酸溶液100 μL中和;加水至1 mL,使用等体积三氯甲烷萃取3次,将水相用孔径0.22 μm滤膜滤过后,进样分析。
色谱条件:Eclipse XDB-C18柱(150 mm×4.6 mm,5 μm),流动相:0.1 mol·L-1乙酸铵(pH值5.5)缓冲液-乙腈(85:15);柱温:30 ℃;进样体积:20 μL;流速:1 mL·min-1;检测波长:250 nm。
1.5MTT实验检测巨噬细胞增殖 取对数生长期的Raw264.7细胞按每孔1×104个加入96孔细胞培养板中,37 ℃、5% 二氧化碳(CO2)条件下培养24 h。弃去培养基,分别加入含有各浓度HSP(12.5,25,50,100,200,400,800 μg·mL-1)的新鲜培养基,每孔150 μL,阳性对照组分别加入1 μg·mL-1LPS。继续培养24 h,每孔加入5 mg·mL-1的MTT溶液20 μL,37 ℃继续培养4 h,弃去培养基,每孔加入DMSO溶液150 μL,震荡混匀,在酶标仪上测定490 nm处吸光度(A值)。细胞生长率(%)=(实验组A值-空白组A值)/(对照组A值-空白组A值)×100%。
1.6流式细胞仪检测吞噬活性 取对数生长期的Raw264.7细胞按每孔1×105个加入12孔细胞培养板中培养24 h后,分别加入低、中、高浓度HSP(100,200,400 μg·mL-1)的新鲜培养基,每孔1 mL,阳性对照组加入1 μg·mL-1LPS。培养24 h后,弃去培养基,用PBS洗2次,加入1 mg·mL-1FITC-dextran 40,37 ℃避光培养1 h。弃去培养基,用预冷的PBS洗细胞3次,PBS 500 μL重悬,用流式细胞仪检测。
1.7动物分组、造模及给药 参考文献[8]方法,将小鼠适应性暂养1周后,按体质量分层随机数字表法分为3组,每组5只:空白对照组、模型对照组、HSP组。模型对照组和HSP组在实验第1,3,5,7天腹腔注射CY 50 mg·kg-1,空白对照组注射等体积0.9%氯化钠注射液。HSP组每天灌胃HSP 1.0 g·kg-1[0.1 mL·(10 g)-1],空白对照组和模型对照组灌胃0.9%氯化钠注射液,连续8 d。每天称定并记录小鼠体质量,同时记录小鼠活动情况及进食量。实验终点,小鼠禁食12 h,处死小鼠,沿腹部正中线切开,充分暴露小鼠胸腔和腹腔,取小鼠胸腺、脾脏和全段小肠。记录小鼠全段小肠上派氏结个数,并计算胸腺、脾脏指数,胸腺指数=胸腺质量(g)/小鼠体质量(g);脾脏指数=脾脏质量(g)/小鼠体质量(g)。
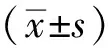
2 结果
2.1HSP中总糖、糖醛酸及蛋白质含量 本研究采用硫酸-苯酚法测定HSP中总糖含量,以吸光度为纵坐标,葡萄糖浓度为横坐标绘制标准曲线,回归方程为Y=77.61X-0.016,R2=0.994。采用硫酸-四硼酸钠法测定糖醛酸含量,以吸光度为纵坐标,半乳糖醛酸浓度为横坐标绘制标准曲线,回归方程为Y=10.4X-0.060,R2=0.978。采用考马斯亮蓝法测蛋白质含量,以吸光度为纵坐标,BSA浓度为横坐标绘制标准曲线,回归方程为Y=39.42X+0.640,R2=0.972。根据回归方程计算出HSP中总糖、糖醛酸和蛋白质的含量分别为22.93%,25.25%和8.59%。
2.2HSP单糖组成分析 选取常见的8种单糖Man、Rha、GlcA、IdoA、GalA、Glc、Gal、Ara为混合标准品,经PMP衍生化后进行HPLC分析。图1(A)可以看出8种混合单糖实现良好的分离。参照图1(A),HSP由Man、Rha、GlcA、GalA、Glc、Gal、Ara 组成。在HPLC图谱中,峰面积与质量浓度呈正比关系,因此通过峰面积可对单糖进行定量分析[9-10]。根据峰面积比值、各标准单糖和HSP质量计算HSP中各单糖比例,结果见表1所示,从表1可看出,组成HSP的主要单糖为Ara,所占比例达到92.26%,其次是GalA(6.67%)和Rha(4.36%)。

图1 单糖标准品(A)、HSP(B)经PMP衍生化后的HPLC图谱

表1 荆芥穗多糖单糖组成分析
2.3HSP对巨噬细胞增殖的影响 为了考察HSP的体外免疫调节活性,本研究以小鼠巨噬细胞Raw264.7为模型,采用MTT法测定HSP对Raw264.7细胞增殖率的影响。结果见图2。LPS和不同浓度的HSP作用于Raw264.7细胞24 h后均对其增殖率产生不同程度的影响,且HSP对巨噬细胞的促增殖作用呈现出一定的浓度依赖性。低浓度(≤100 μg·mL-1)的HSP对细胞增殖率的影响与空白对照组比较差异无统计学意义(P>0.05)。中浓度(200 μg·mL-1)的HSP能够促进巨噬细胞增殖(t=-7.89,P<0.05)。高浓度(400,800 μg·mL-1)的HSP能够显著促进巨噬细胞增殖(t=-5.12,-3.96,P<0.01)。由于400和800 μg·mL-1的HSP促增殖作用差异无统计学意义,故分别以100,200,400 μg·mL-1为低、中、高浓度进行进一步免疫调节活性研究。
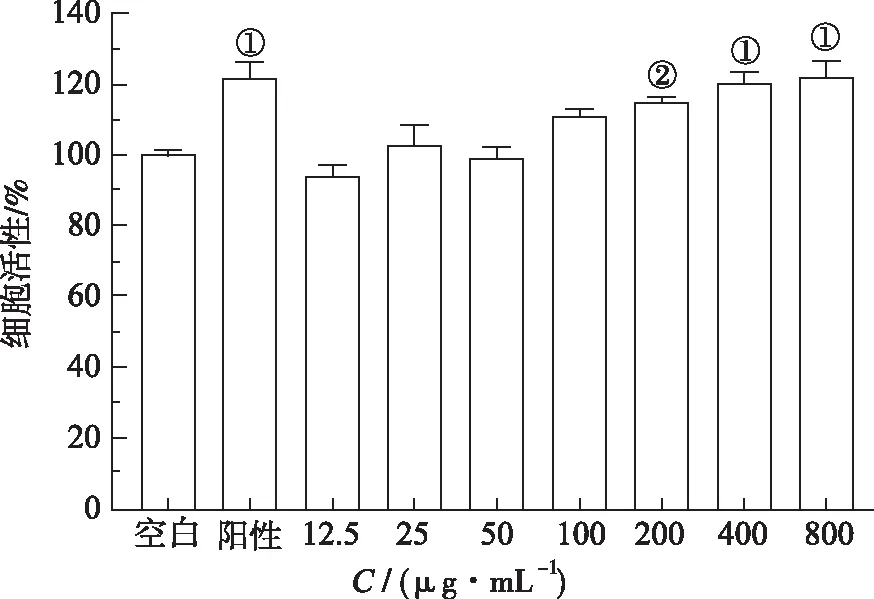
①与空白对照组比较,t=4.45,5.11,3.96,P<0.01;②与空白对照组比较,t=7.89,P<0.05。
2.4流式细胞术检测吞噬活性 本研究采用流式细胞术考察浓度为100,200,400 μg·mL-1的HSP对Raw264.7细胞吞噬活性的影响,结果见图3。低浓度HSP组与空白对照组比较,荧光强度相当,差异无统计学意义(P>0.05)。中浓度和高浓度的HSP能够显著增强巨噬细胞的吞噬活性(t=-191.22,-28.82,P<0.01),且随HSP浓度的增加,荧光强度增强,表明HSP对巨噬细胞的促吞噬作用呈现一定的浓度依赖性。
2.5HSP对巨噬细胞形态的影响 在倒置显微镜下观察Raw264.7细胞形态结果见图4。与空白对照组比较,经HSP和LPS处理后的细胞数量增多,与MTT法测定细胞增殖结果一致,进一步证实HSP具有促进细胞增殖的作用。此外,经HSP和LPS处理后细胞形态发生了显著变化。空白对照组中Raw264.7细胞呈圆形或椭圆形,贴壁良好,较少见突起,细胞内未见空泡。经LPS和不同浓度的HSP处理24 h后,细胞数量明显增多,细胞体积变大,呈圆形、椭圆形、菱形、梭性或不规则形,可见较多伪足,细胞内出现较多颗粒和空泡,呈现激活状态,且随着HSP浓度的增加,其对Raw264.7细胞形态的影响越显著。

A.空白对照组(4 ℃);B.空白对照组;C.阳性对照组;D.HSP低浓度组;E.HSP中浓度组;F.HSP高浓度组;①与空白对照组比较,t=22.72,22.08,8.10,P<0.01。
2.6HSP对免疫抑制小鼠免疫功能的调节作用 为了评价HSP的体内免疫调节作用,本研究通过腹腔注射50 mg·kg-1CY诱导建立免疫抑制小鼠模型,考察HSP对免疫抑制小鼠体质量增长、脾脏指数、胸腺指数及派氏结数量的影响。结果见表2,与空白对照组比较,模型对照组小鼠体质量增加值、脾脏指数和胸腺指数均显著降低(t=6.34,5.49,11.72,P<0.01),提示造模成功。与模型对照组比较,HSP能够提高小鼠的体质量增加值和肠道派氏结数量,但差异无统计学意义。HSP能够显著提高免疫抑制小鼠的脾脏指数和胸腺指数,与模型对照组比较,差异有统计学意义(t=-2.36,-2.98,P<0.05)。

图4 HSP对巨噬细胞形态的影响

表2 3组小鼠体质量增值、脏器指数及派氏结结果
3 讨论
多糖是自然界广泛存在的一类天然有机大分子物质,其与脂肪、核酸、蛋白质一起被称为构成生命体的四大基本物质,具有重要的生物学功能。近年来,中草药多糖成为众多学者研究的热点,它不仅参与细胞骨架的构成,也是多种内源性生物活性分子的重要组成部分,其中,免疫调节作用是其主要的药理作用之一[11]。中药多糖来源广泛,来源于不同动植物的多糖,可能由于其单糖组成或连接方式不同而具有不同的药理活性[12-13],即使是来源于同一物种的多糖,由于自然环境或采收季节变动也可能使多糖的组成发生变化,进而影响其药理活性[14]。因此,本研究初步对HSP的化学组成进行研究,分别测定其总糖、糖醛酸和蛋白质含量。并通过PMP衍生化后进行HPLC分析,研究HSP的单糖组成。结果表明HSP由Man、Rha、GlcA、GalA、Glc、Gal、Ara 组成,其中最主要的单糖种类为Ara,占比达到92.26%。此外,还含有部分酸性多糖GalA、GlcA和蛋白质,因此HSP可能是一种酸性杂化蛋白多糖,但仅从目前的实验数据不能确定蛋白质是否与多糖连接,还需进一步的实验加以验证。此外,HSP中单糖的连接方式还有待于进一步研究。
免疫系统由免疫器官、免疫细胞和免疫分子组成。本研究首先在体外研究HSP对免疫细胞的调节功能。免疫细胞包括淋巴细胞、树突状细胞、单核/巨噬细胞、粒细胞、肥大细胞等。其中巨噬细胞是研究细胞吞噬、细胞免疫和分子免疫学的重要对象,也在机体免疫应答和防御中发挥着至关重要的作用[15]。因此,本研究选择医学研究中常用的小鼠单核巨噬细胞白血病细胞作为细胞模型,评价HSP对Raw264.7细胞增殖、吞噬活性以及形态的影响。结果显示,低浓度的HSP促增殖作用不显著,当浓度高于200 μg·mL-1时,HSP表现出显著的促增殖作用,且随着浓度的增加,促增殖作用增强,表明HSP的促增殖作用具有浓度依赖性。同样,随着HSP浓度的增加,巨噬细胞吞噬活性增强,且细胞形态发生显著变化,出现伪足和胞内空泡,呈现出激活状态。体外细胞实验证实HSP能够剂量依赖性的活化Raw264.7细胞。
为了进一步评价HSP在体内的免疫调节活性,本研究采用CY诱导建立免疫抑制小鼠模型,并选择体质量增长值、胸腺指数、脾脏指数、肠道派氏结数量作为评价指标。胸腺和脾脏是机体重要的免疫器官,其发育状态直接影响机体免疫能力,因此胸腺和脾脏指数可以作为反映机体免疫状态的初步指标[16]。派氏结是存在于哺乳动物小肠段的集合淋巴小结,其中富含胸腺源性T细胞和B细胞,是肠道黏膜免疫系统的免疫诱导部位[17]。派氏结的大小、数量及其中淋巴细胞的数量和活性状态等可以反映肠道黏膜局部的免疫状态[18]。本研究中,通过隔日腹腔注射50 mg·kg-1CY的方法,注射4次后,小鼠的脾脏指数和胸腺指数均显著降低,提示小鼠免疫力被抑制,造模成功。而HSP能够显著提高免疫抑制小鼠的胸腺脾脏指数,表明HSP在体内仍然具有一定的免疫调节作用。此外,与空白对照组比较,模型对照组中免疫抑制小鼠肠道派氏结数量减少,HSP能够一定程度上恢复免疫抑制小鼠肠道派氏结水平,但由于组内差异较大,三者之间差异均无统计学意义,有待扩大样本量进一步研究。
综上所述,本研究从荆芥穗中分离得到的酸性杂化多糖,分别从体内外实验证实了其在适当剂量下能够活化巨噬细胞,增强免疫抑制小鼠免疫功能。本研究为荆芥穗多糖在免疫调节中的应用提供一定的理论依据,但该多糖的结构及具体免疫调节机制仍不清楚,有待深入研究。

