海洋无脊椎动物细胞培养与细胞干性的捕获
岑 卫, 胡梦珠, Rinkevich Baruch, 胡国斌
海洋无脊椎动物细胞培养与细胞干性的捕获
岑 卫1, 2, 胡梦珠1, 2, Rinkevich Baruch3, 胡国斌1, 2
(1. 中国海洋大学, 海洋生命学院, 山东 青岛 266003; 2. 中国海洋大学, 海洋生物多样性与进化研究所, 山东 青岛 266003; 3. 以色列国家海洋研究所, 海洋和湖沼学研究所, 海法 31080 以色列)
细胞系的构建在生物学领域具有重要意义, 与其他动物(如昆虫)不同, 经过数十年的发展, 海洋无脊椎动物细胞研究仍停留在原代培养水平, 没有建立起克隆化的永生细胞系。本文主要介绍了近年来海洋无脊椎动物细胞培养的研究进展, 还介绍了一个基本原理, 即海洋无脊椎动物永生细胞系的建立, 可以通过捕获细胞的干性而实现。捕获细胞干性的第一条途径是利用转录因子等直接由体细胞制备海洋动物的诱导多能干细胞(iPS细胞)。第二条途径是获取海洋动物的成体干细胞(ASC)。这些细胞在维持机体活性、再生、无性克隆、体内增殖等方面起重要作用。当培养条件正确时, 海洋无脊椎动物iPS细胞和ASC将会保持其原始状态, 利用干细胞自我复制的固有能力、不分化地进行增殖而形成永生细胞系。
海洋无脊椎动物; 细胞培养; iPS细胞; 干细胞; 永生细胞系
海洋无脊椎动物门类繁多, 150多年来为研究再生、应激反应、环境适应等生物过程的调节机制提供了大量生物材料, 被用作模式生物解释各种生物学问题做出了重要贡献。原代培养一般通过酶分解含有特定细胞的组织, 或剪碎组织后使细胞从组织碎片迁移出来而获得培养物。尽管绝大多数原代培养产生的细胞群增殖能力有限, 但在极少数情况下, 原代细胞会连续复制而形成细胞系[1]。节肢动物可能最好地说明了细胞系对生物学研究的重要性。目前已建立了940多种昆虫细胞系[2], 大多数拥有完善的模型系统, 在众多领域获得了广泛应用, 已远超出昆虫学范畴。细胞系在阐明复杂生理过程, 推进分子生物学以及功能基因组学等方面起着关键作用[3]。目前已经建立了淡水和陆生无脊椎动物(水螅、线虫)的细胞系, 并报道海葵()和对虾()细胞的长期(>1个月)原代培养[4], 但仍没有得到海洋无脊椎动物的永生细胞系。
本文对近年来海洋无脊椎动物细胞培养的研究进展进行了综述, 整理了哺乳动物领域几种代表性的干细胞, 包括成体干细胞、肿瘤干细胞和诱导多能干细胞(iPS), 它们都有一个共同的特征: 具备无限增殖能力和分化能力, 即具备细胞干性; 介绍了通过获得细胞干性建立海洋无脊椎动物细胞系的两途径: 第一种是针对静止状态的体细胞, 利用在哺乳动物细胞中成功诱导的iPS 细胞的方法; 第二种是以生物体内的成体干细胞作为建系靶细胞。
1 细胞静止
海洋无脊椎动物细胞通常在离体培养24~72小时后进入静止状态。细胞静止是指细胞的不分裂状态, 例如细胞分化后退出细胞周期的状态(如神经元和心肌细胞), 它类似于孢子的休眠状态[5]。这种静止状态存在不同类型和深度, 例如在肌肉干细胞中存在着不同深度的细胞静止状态, 细胞可以响应某些环境信号而进入一种特殊的“静止”, 并且这些细胞对触发退出静止状态的信号更为敏感。这种中间状态例如干细胞中的“G-alert”和T淋巴细胞中的“G0(A)”[6-7]。静止细胞在新陈代谢上仍然是活跃的, 并且在适当的环境或信号下能够回到细胞周期。Coller等[8]使用转录谱分析了人二倍体成纤维细胞在三种独立信号(无丝裂原、接触抑制和失去粘附)作用下退出细胞周期的特征, 发现静止是由初始信号决定的一组状态, 每一种状态都处于动态平衡中, 具有可逆性, 并存在一个与静止有关的遗传程序, 不同于其他细胞周期停滞, 如衰老、凋亡和终末分化。这为通过获取成体干细胞和诱导多能干细胞的方法建立海洋无脊椎动物永生细胞系提供了可能。
2 成体干细胞
干细胞是科学界最有争议的术语之一。一般定义干细胞是一个细胞谱系的起源, 具有自我更新和多能性, 能产生特定组织甚至生物体的所有细胞类型[9]。根据个体发育过程中干细胞出现的次序和发育潜能的不同, 可分为胚胎干细胞(embryonic stem cells, ES细胞)和成体干细胞(adult stem cells)。成体干细胞是指已分化的特定组织中的未分化细胞, 可来源于胎儿或成体组织, 如造血干细胞、神经干细胞、精原干细胞等。有些哺乳动物成体干细胞和海洋无脊椎动物一样, 具有多能性甚至是全能性[10-11]。但海洋无脊椎动物成体干细胞数量普遍较少, 能够在体内跟踪成体干细胞的自我更新和行为的无脊椎生物模型也不多, 因此对这些成体干细胞的研究一直没有取得进展。对哺乳动物的研究表明可以从已分化的体细胞中培养出干细胞, 这一自我更新机制为其在细胞培养方法中的应用提供了基础。
与成体干细胞概念相关的是肿瘤干细胞(cancer stem cell, CSC)。肿瘤干细胞等同于正常的成体干细胞, 可以看作是成体干细胞特性的一种极端表现。具有自我更新的能力, 可以分裂产生其他的肿瘤干细胞, 同时也可以分化成为其他细胞。例如犬传染性性病肿瘤(canine transm-issible venereal tumor, CTVT)是一种发生在狗身上的传染性疾病, 通过性交传播。这个细胞系从犬类第一次被驯化到现在已经超过了6000年[12], 但其干性依旧存在并且没有衰弱的迹象。
3 诱导多能干细胞
诱导多能干细胞(iPS细胞)具有自我更新能力, 具有通过分裂产生与母细胞完全相同的子代细胞的“无限”增殖能力; 该细胞还具有多向分化潜能, 能够分化出多种细胞类型和组织。类似于胚胎干细胞(ES细胞), 哺乳动物多能干细胞在体外和体内环境中均表现出高度可塑性。自2006年 Takahashi 和 Yamanaka 首次培养出小鼠 iPS 细胞[13]以来, 这项技术已被证明能诱导多种哺乳动物产生 iPS 细胞, 推进了再生医学、基础发育生物学等许多领域的研究。目前哺乳动物 iPS 细胞是通过引入重编码基因或将重组蛋白导入细胞。在小鼠和人体细胞中, 可以通过几个关键的转录因子(如OCT4、KLF4、SOX2 和c-MYC)使体细胞去分化成为iPS细胞。iPS 细胞能够产生可育的嵌合体小鼠, 甚至仅由iPS 细胞派生出完整胚胎[14]。
对于非哺乳动物, 科研人员也通过人类的OCT4/ POU5F1、NANOG、SOX2 转录因子将鹌鹑()胚胎成纤维细胞去分化为 iPS细胞[15]。而Rosselló 等[16]发现用于在小鼠和人类中生成 iPS 细胞的一组四个哺乳动物转录因子可以在其他非哺乳类脊椎动物(鸟类、鱼类)和无脊椎动物(果蝇)中诱导部分重编码的多能干细胞。这些发现证明了跨系干细胞诱导的可能性, 也表明在广泛的系统内干细胞基因库可能高度保守(图1)。关于干细胞基因库的保守性研究从十多年前开始, 陆续发现一些基因(、和)重编码的多能干细胞可以在一些高度再生的动物(水螅、扁虫等)中产生生殖细胞[17]。这些基因在不同物种的多能干细胞中均发挥着重要作用。保守基因的存在意味着在这类细胞中存在一个潜在通用的控制分裂分化增殖的系统[18]。
虽然关于哺乳类(如猪、马、兔等)和非哺乳类脊椎动物(鸟类等)的 iPS 细胞研究日趋成熟[19], 但尚无关于海洋无脊椎生物的相关研究。由普通的体细胞产生iPS 细胞是一个人为可重复操作的过程, 这种方法克服了细胞分离出来后会进入静止状态这一阻碍, 为海洋无脊椎动物细胞培养提供了新的思路。
4 干细胞在海洋无脊椎动物细胞培养中的应用
海洋无脊椎动物中成体干细胞数量普遍较少, 但存在较多的多能干细胞(pluripotent stem cells), 这些细胞在维持机体活性、再生和无性克隆中起重要作用。虽然在部分无脊椎动物如扁形动物中多能干细胞相对较少, 只有4%~6.5%, 但是较脊椎动物还是具有非常高的比例[20]。
4.1 海绵动物
海绵动物属低等、原始的多细胞动物类群, 被认为是理解动物进化和发展的关键生物。其体内含有多种抗性物质, 近几十年来, 在海绵中发现了大量具有抗肿瘤、抗真菌、抗HIV的活性物质。海绵动物具有很强的再生能力, 切掉的小块海绵可以重新长成完整个体, 捣碎的海绵细胞还可以聚合重新形成新个体[21]。
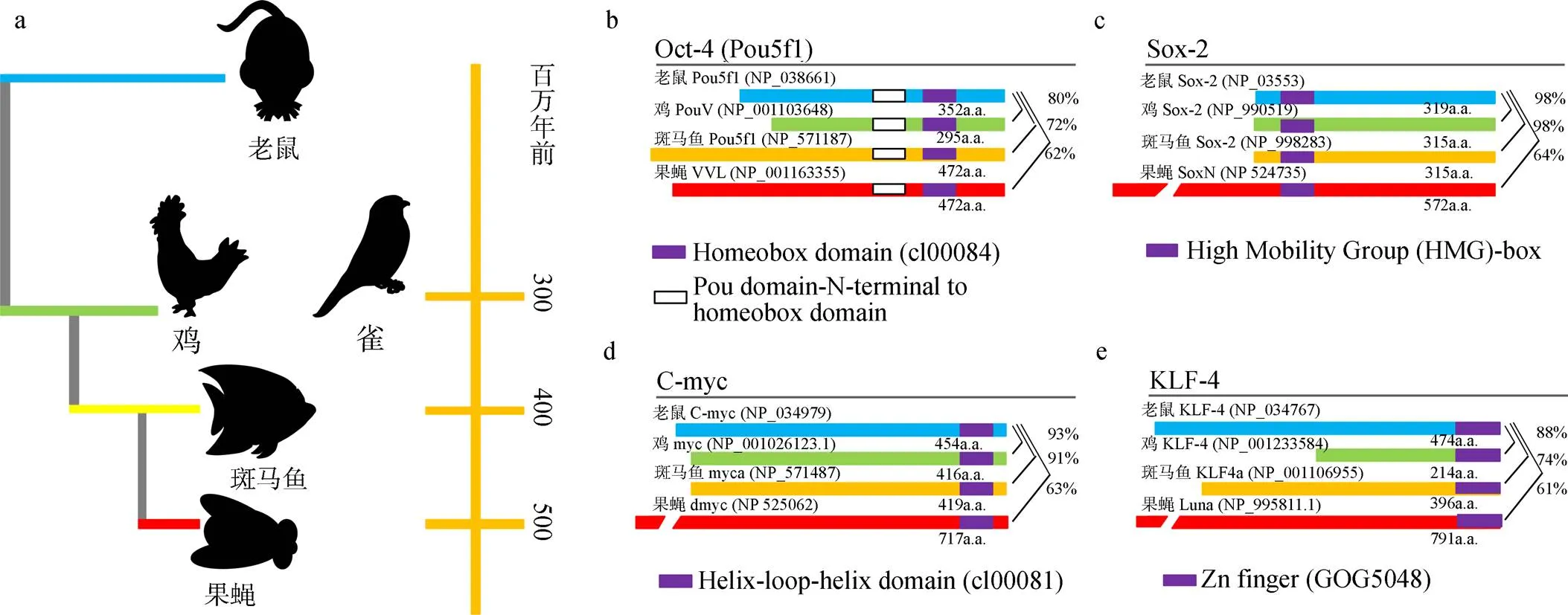
图1 实验物种间干细胞基因的同源性系统发育
注: a: 实验物种与小鼠的系统发育关系: 鸟类(鸡和鸣禽)、鱼类(斑马鱼)和昆虫(果蝇); b-e: 四种干细胞诱导转录因子假定同源物的一般结构和序列比较[16]
早在1993年Klautau等就建立了海绵细胞的悬浮培养方法, 但是现今海绵细胞培养仍停留在原代培养水平。主要是因为海绵动物多为合胞体, 体外培养的海绵细胞结构与体内有很大的不同并且海绵动物体内有多种内共生微生物, 很难实现无菌培养[22]。海绵动物的多能干细胞数目非常多, 每个芽体(通常约为直径0.5 mm)内都有数以千计的原始生殖细胞。孙黎明[23]研究了繁茂膜海绵()的干细胞鉴定分离纯化和体外增殖等问题并验证了海绵干细胞的增殖分裂潜力, 但缺少后续实验论证。而Conkling等[24]研究配制了一种氨基酸优化的培养基可以刺激9种海绵的细胞快速分裂, 首次实现了海绵细胞分裂速度和数量的实质性提高。实验中分裂最快的细胞数量在不到1小时内翻倍, 将其中四种海绵的培养物进行3到5次传代, 传代后细胞数量平均达到5.99倍, 寿命为21~35天。
4.2 刺胞动物
刺胞动物是真正的二胚层多细胞动物, 有了组织的分化, 但结构简单, 体壁仅由内、外胚层两层细胞以及中间无细胞结构的中胶层构成, 细胞类型较少。刺胞动物的研究中发现珊瑚的再生能力会随其受伤-再生次数的增加逐渐减弱, 原因可能是再生过程中干细胞数量不断消耗。柳珊瑚的变形细胞除具有吞噬细胞类似功能外, 还具有多能干细胞的特性, 可以分裂分化出各种细胞类型[25]。对水母()的研究[26]发现, 分离的单核横纹肌细胞不仅可以多能转分化, 还能完成完整的体外再生过程。进一步研究表明当出芽时, 一种的同源物的表达上调, 由于横纹肌细胞向平滑肌细胞的转分化也激活了表达, 因此似乎在该物种的细胞干性相关过程中发挥关键作用, 但尚未见进一步尝试干细胞的体外培养实验。
4.3 扁形动物
扁形动物拥有强大的再生能力, 即使原始个体的1/279大小的碎片也能再生成完整个体。其中再生能力的关键是被称为Neoblasts[27]的成体干细胞。这种成体干细胞可以分化产生体细胞和生殖细胞, 用于出芽、缺失部位的再生和体细胞的更新等生理过程。例如受到损伤后扁形动物可以利用成体干细胞分化再生修补损伤的组织, 而这一过程主要受到翻译后修饰、磷酸化、泛素化以及染色质修饰等的调控[28]。对其他扁形动物的研究表明, 寄生吸虫的幼虫可由游离的间充质细胞产生[29]; 绦虫中完整的蚴虫可由单个细胞再生形成; 淡水涡虫能够通过干细胞介导全身再生。这些特性使得扁形动物成为研究干细胞的优秀模式生物。
形态学上, Neoblasts成体干细胞与其他生物体的干细胞有许多共同特征, 如高核/质比、较大的细胞核、高嗜碱性的细胞质、胞质边缘有游离核糖体和少量线粒体、没有或很少有内质网。Gehrke等[27]的研究表明虽然再生过程中外部刺激不同导致种间的同源性判断有些困难, 但总体上这一成体干细胞在5.5亿年进化过程中具有一定的保守性。目前仍缺乏成体干细胞体外长期培养的相关研究。
4.4 环节动物
环节动物多毛类具有优秀的再生损伤身体部位的能力。因此可利用多毛类作为模型, 揭示再生过程的基本特征和未知特性。细胞干性研究主要集中在干细胞的形成以及组织再生。Rebscher等[30]研究发现沙蚕原始生殖细胞(primordial germ cell, PGCs)和中胚层后生长带(mesodermal posterior growth zone, MPGZ)细胞虽然在形态上难以区分, 并且均表达、和, 但经5-乙炔基-2′-脱氧尿苷(EdU)标记后, MPGZ前方可检测到一簇特殊的PGCs, 推测多毛类动物早期PGC是预先形成的。Fischer和Arendt的研究进一步发现杜氏阔沙蚕()四个原始生殖细胞在胚胎发生早期由“初级中胚层”第一次分裂产生, 这也是整个躯干中胚层的起源[31]。在多毛类再生的分子基础方面, Giani等[32]研究了海蠕虫()头部再生过程中基因的表达, 证实了的保守性以及在多毛类未分化细胞中的作用。Kozin等[33]研究了、和基因在沙蚕尾部再生过程中的差异表达, 这些基因在维持无脊椎动物原始生殖细胞和多能干细胞的未分化状态方面具有重要作用。
4.5 甲壳动物
目前海洋节肢动物成体干细胞的研究较少, 对根头目的干细胞研究最为深入, 部分幼虫组织和器官中的成体细胞可恢复为干细胞[29]。而甲壳纲作为节肢动物门中的第3大纲, 物种数仅次于昆虫纲和蛛形纲, 幼虫体内有部分干细胞, 选择性表达碱性磷酸酶[34], 在无性出芽生殖中起重要作用。以对虾为例, 从Chen等1986年首次尝试使用L-15培养基培养对虾的初级淋巴细胞和卵巢细胞至今已有三十多年的历史[35]。Claydon和Owens将人乳头瘤病毒(HPV)E6和E7基因转染到红螯螯虾()细胞中[36]。虽然癌基因转染成功且转染后的细胞存活超过150天, 但由于端粒损耗, 细胞增殖停滞。Claydon等[37]利用聚乙二醇(PEG)介导两种细胞系, 鲤鱼上皮细胞系(EPC)和草地贪夜蛾细胞系(Sf9)融合后与斑节对虾()的血细胞融合, 首次得到了对虾杂交细胞, 但在融合细胞中未能观察到对虾基因以及虾类病毒敏感性。Puthumana采用猿猴病毒40-T抗原和腺病毒12S-E1A基因两种癌基因分别转染斑节对虾淋巴细胞, 增殖细胞存活90天以上, 但未实现永生化[38]。韩倩等[39]整理研究了对虾永生性转化的相关技术, 并就虾的类淋巴细胞(Oka)的原代和传代培养进行了部分优化, 同时发现在虾细胞中, 慢病毒载体介导的基因转移比脂质体和逆转录病毒介导的方法具有更高的转染效率。目前传代培养和建立稳定或连续的虾细胞系相关问题仍有待解决[40]。培养基方面Sivakumar[41]以南美白对虾血淋巴的氨基酸组成为基础, 采用5种不同的培养基, 建立了南美白对虾不同组织和血细胞的体外细胞培养体系。
4.6 软体动物
软体动物身体柔软, 真体腔不分节, 由头、足、内脏团、外套膜和贝壳等五部分组成[42]。软体动物的体外细胞培养有助于人们了解组织特异性细胞内或细胞间发生的复杂生理过程, 目前为止只建立了一个细胞系(图2), 即光滑双脐螺胚胎细胞系(Bge)[43]。而且几乎没有海洋软体动物干细胞的相关研究, 事实上软体动物身体结构和生活方式的多样性导致它们在细胞培养以及细胞系的建立中面临着许多困难。首先由于共生体和体内微生物的存在, 软体动物乃至整个海洋无脊椎动物细胞培养过程中都很难做到无菌培养, 实验中不得不使用大量抗生素或采取其他更为严苛的杀菌措施, 但这些操作也会同时对软体动物细胞造成损伤。其次软体动物培养所需的等渗条件和pH值更为苛刻, 在实验中可能需要额外的渗透剂、无机离子或其他螯合剂[44]。还有外植体培养的条件, 水解酶对细胞培养过程造成的损害, 使用胎牛血清对细胞的隐形损伤等问题[1]。
虽然目前还没能培育出无限传代成功的细胞系, 但海洋贝类细胞培养的研究也取得了部分进展[45]。陈颉等[46]研究了文蛤()外套膜细胞在不同温度和盐浓度条件下细胞的生长情况, 培养的细胞可存活30~35天。You等[47]利用向L-15培养基添加酵母提取物的方法成功培养文蛤消化腺细胞, 并在此基础上成功开展了RNA干扰实验。永生性研究方面, 虽然软体动物体某些部位的快速增殖细胞可以转化为成体干细胞, 但是没有进一步的支持性实验论证[48]。

图2 光滑双脐螺(Biomphalaria glabrata)胚胎细胞(Bge)贴壁生长形态[1]
4.7 棘皮动物
棘皮动物体内有与消化道分离的真体腔, 体壁有来源于中胚层的内骨骼, 属后口动物, 是无脊椎动物中最高等的类群。棘皮动物具有强大的再生能力, 例如海星只要体盘连着一条腕, 就能长成新个体。有些种类的海参在受攻击发生吐肠现象后仅需7天就能完成肠道再生, 而研究认为干细胞是棘皮动物高再生潜能的基础[1, 49]。Reinardy等[50]检测到两个与海胆棘突和管足相关的干细胞标志物(和)的表达, 后续研究也验证了干细胞参与棘皮动物体壁的再生过程这一观点[1, 49]。在细胞培养方面, Wang等[51]整理出一套简便易行的海参肠细胞培养方案, 并且成功完成了海参肠细胞原代培养以及细胞凋亡诱导与检测。此方案也广泛适用于包括棘皮动物、软体动物和甲壳动物在内的其他海洋无脊椎动物。Benedetto等[52]首次完成了海百合()体内与再生过程相关细胞的体外培养, 优化了细胞培养条件, 细胞可以至少存活7周。
4.8 尾索动物
尾索动物也称被囊动物, 是脊索动物门的一个亚门。大多数实验以海鞘作为模式动物来进行研究, 为了揭示海鞘的免疫机制, 对于海鞘血细胞的培养研究较多。但是成熟血细胞的寿命较短且体外培养很难保持其活性, 上皮细胞的原代培养也只能在体外存活较短时间。
尾索动物目前已经获得了至少两个独立的干细胞系统, 即上皮细胞和血细胞的干细胞系统。在菊海鞘中, 从生长的芽中获得的细胞有多向分化潜能, 可以分化出大部分组织和器官。Voskoboynik 等[53]研究海鞘()时发现它在整个生命过程中显示出强大的干细胞介导的再生能力。尾索动物的幼虫通过有性繁殖发育而成, 可通过干细胞出芽形成新的个体。个体存活时间很短, 通过大量的细胞凋亡死亡, 可连续出芽复制出全新的个体。因此, 他们的干细胞是组织中唯一能自我更新的细胞。但这都是在体内表现出的细胞干性, 目前仍没有体外条件下成体干细胞的相关研究。
4.9 其他海洋无脊椎动物
苔藓动物是一类群体营固着生活的海洋无脊椎动物, 约5 000种。几乎所有的苔藓动物都通过干细胞来形成模块集落, 从越冬的囊孢(休眠芽)发芽或通过“自裂”(自发地分裂成两个或两个以上的碎片)繁殖[54]。新的组织是由芽发育而来, 可能含有全能干细胞。Shunatova等[55]研究了苔藓虫()再生过程中细胞的增殖情况, 测试了苔藓虫触手的再生能力, 在虫体的纤毛窝和口检测到干细胞, 而在成虫的触手中未检测到干细胞。有些栉水母在切成两半或四分之一时能够再生出完整的个体, 例如,[56]。许多栉水母通过断裂和发芽的方式进行无性生殖。这些过程是否涉及全能成体干细胞(totipotent adult stem cells)目前尚未研究。其他无脊椎动物如毛颚动物, 腕足动物和纽形动物等主要研究方向尚未涉及干细胞, 细胞学细节和遗传学基础至今尚无研究。
5 讨论及展望
通过对近年来海洋无脊椎动物细胞培养研究的整理发现, 细胞不能长期培养的原因有以下几点: 一是对海洋无脊椎动物细胞生长需求以及分裂所需要的促进因子了解甚少; 二是缺乏海洋无脊椎动物细胞生理方面的细致研究, 不同细胞需要的培养条件如渗透压、pH、无机离子和有机物配比、缓冲液等均有不同, 直接套用或参照脊椎动物或昆虫的培养基不能取得最佳的培养效果[44]; 三是细胞分类和鉴定的信息还不完备, 很难把握原代和传代培养过程中的最佳细胞密度; 四是防菌问题, 海洋无脊椎动物细胞培养由于共生微生物的存在, 很难做到无菌培养。在细胞培养中如何处理共生菌与细胞的关系是关键, 例如海绵的培养过程中如果加入抗生素进行抑菌处理, 同时会抑制海绵细胞的活性, 如果不使用抗生素, 培养又只能维持1~3天[57]; 五是接种方法, 利用外植体直接培养时获取的分散细胞数量过少, 同时能从组织块迁移的细胞种类有限, 极大的限制了接种细胞的数量和质量, 而通过酶(胰蛋白酶、胶原蛋白酶等)水解分散对细胞损伤较大[58]。尽管培养基的组成是决定细胞系建立成功与否的重要因素, 但到目前为止还没能设计出专门用于海洋无脊椎动物细胞体外生长的培养基, 这需要我们深入研究海洋无脊椎动物细胞生长所需的生理生化条件。
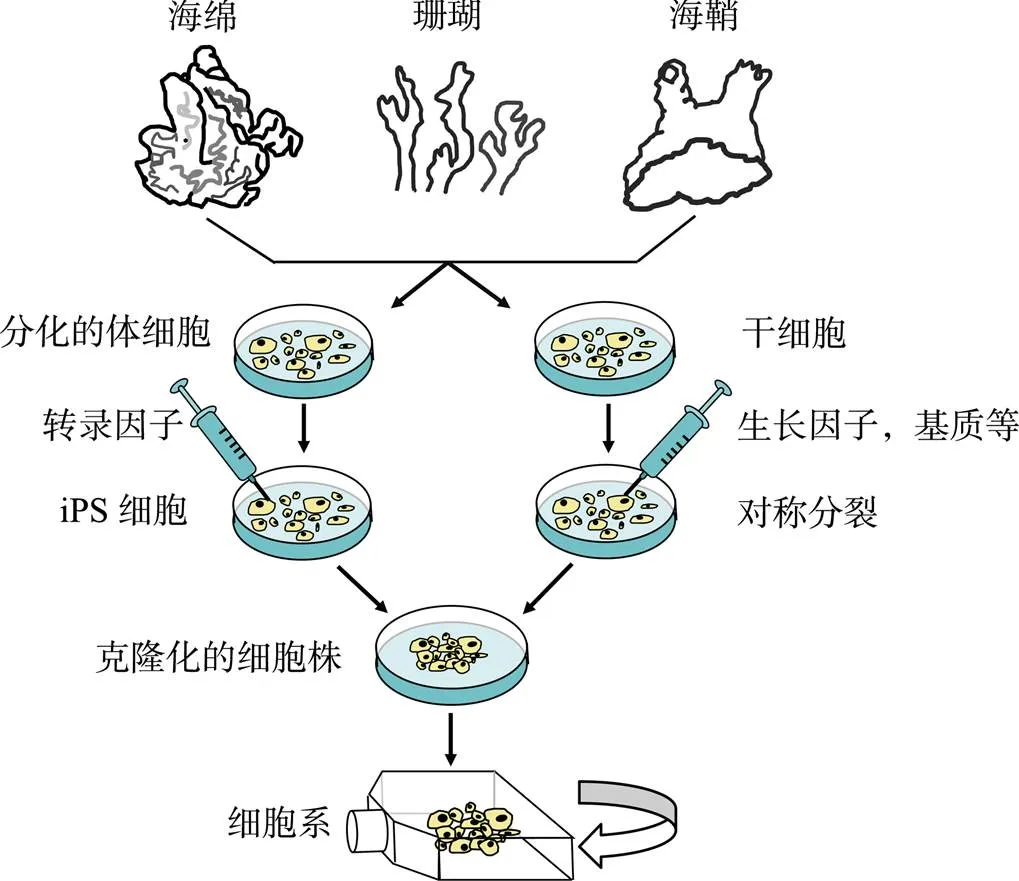
图3 利用海洋无脊椎动物成体干细胞和iPS细胞建立细胞系的示意图[58]
针对海洋无脊椎动物细胞在体外培养24~72小时后会进入静止状态这个现象, Rinkevich[58]提出利用海洋无脊椎动物成体干细胞和 iPS 细胞进行细胞培养, 将 iPS 细胞和成体干细胞作为两个独立的来源培养永生细胞(图3)。结合以往研究, 海洋无脊椎动物细胞建系研究可以从干扰细胞周期调节基因使细胞脱离静止状态、维持端粒稳定以及与永生细胞系融合构建杂交细胞等方面入手。干扰细胞周期调节基因使细胞脱离静止状态, 必须要了解细胞如何进入和维持静止状态。Gulaia等[59]探讨了不同分子机制和邻近细胞如何影响胶质瘤干细胞的静止状态, 包括各种转录因子、检查点调节因子、蛋白激酶/磷酸酶, 以及外源调节因子, 如细胞间相互作用、细胞外基质成分等。研究表明 BTG1 和 BTG2(BTG1/2)是调节T细胞活化的关键分子, 促进 mRNA 的降解, 使 T 细胞处于静止状态, 缺少 BTG1/2 的 T 细胞因信使 RNA 丰度增加而激活和增殖[60]。Roche等[61]发现在裂殖酵母()中, RNAi(RNA interference)是维持细胞静止状态的重要调节机制。端粒酶活性是限制细胞增殖的因素之一, pRb 和p53 通路失活以及端粒维持机制的激活被认为是体细胞永生化的必要条件[62]。在绝大多数情况下, 端粒酶被激活, 端粒长度就能维持稳定, 从而细胞的寿命得以维持[63]。通过细胞融合构建杂交细胞的研究也取得了部分成功, 例如将鲤鱼上皮细胞系(EPC)和草地贪夜蛾细胞系(Sf9)融合后与斑节对虾()的血细胞融合, 首次得到了对虾杂交细胞[37], 有望实现对虾细胞连续培养。虽然采用传统方法培养细胞成效甚微, 但是通过转基因和细胞杂交等技术, 捕捉细胞干性, 构建活跃增殖的海洋无脊椎动物细胞系无疑是今后研究海洋无脊椎动物细胞培养研究的重要部分。
[1] Yoshino T P, Bickham U, Bayne C J. Molluscan cells in culture: primary cell cultures and cell lines[J]. Canadian Journal of Zoology, 2013, 91(6): 391-404.
[2] Geisler C, Jarvis D L. Adventitious viruses in insect cell lines used for recombinant protein expression[J]. Protein Expression and Purification, 2018, 144: 25-32.
[3] Mabashi-Asazuma H, Jarvis D L. CRISPR-Cas9 vectors for genome editing and host engineering in the baculovirus–insect cell system[J]. Proceedings of the National Academy of Sciences, 2017, 114(34): 9068- 9073.
[4] Ventura P, Toullec G, Fricano C, et al. Cnidarian primary cell culture as a tool to investigate the effect of thermal stress at cellular level[J]. Marine Biotechnology, 2018, 20(2): 144-154.
[5] Roche B, Arcangioli B, Martienssen R. Transcriptional reprogramming in cellular quiescence[J]. RNA Biology, 2017, 14(7): 843-853.
[6] Rodgers J T, King K Y, Brett J O, et al. mTORC1 controls the adaptive transition of quiescent stem cells from G0 to G-Alert[J]. Nature, 2014, 510(7505): 393-396.
[7] Lea N C, Orr S J, Stoeber K, et al. Commitment point during G0→G1 that controls entry into the cell cycle[J]. Molecular and Cellular Biology, 2003, 23(7): 2351- 2361.
[8] Coller H A, Sang L, Roberts J M. A new description of cellular quiescence[J]. PLoS Biology, 2006, 4(3): e83.
[9] Götz M. Revising concepts about adult stem cells[J]. Science, 2018, 359(6376): 639-640.
[10] Ferreira A F, Calin G A, Picanço-Castro V, et al. Hematopoietic stem cells from induced pluripotent stem cells–considering the role of microRNA as a cell differentiation regulator[J]. Journal of Cell Science, 2018, 131(4): jcs203018.
[11] Rinkevich Y, Paz G, Rinkevich B, et al. Systemic bud induction and retinoic acid signaling underlie whole body regeneration in the urochordate[J]. PLoS Biology, 2007, 5(4): e71.
[12] Das U, Das A K. Review of canine transmissible venereal sarcoma[J]. Veterinary Research Communications, 2000, 24(8): 545-556.
[13] Takahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors[J]. Cell, 2006, 126(4): 663-676.
[14] Kim J B, Zaehres H, Wu G, et al. Pluripotent stem cells induced from adult neural stem cells by reprogramming with two factors[J]. Nature, 2008, 454(7204): 646-650.
[15] Lu Y, West F D, Jordan B J, et al. Avian-induced pluripotent stem cells derived using human reprogramming factors[J]. Stem Cells and Development, 2012, 21(3): 394-403.
[16] Rosselló R A, Chen C C, Dai R, et al. Mammalian genes induce partially reprogrammed pluripotent stem cells in non-mammalian vertebrate and invertebrate species[J]. Elife, 2013, 2: e00036.
[17] Funayama N. The cellular and molecular bases of the sponge stem cell systems underlying reproduction, homeostasis and regeneration[J]. International Journal of Developmental Biology, 2018, 62: 513-525.
[18] Juliano C E, Swartz S Z, Wessel G M. A conserved germline multipotency program[J]. Development, 2010, 137(24): 4113-4126.
[19] de Figueiredo Pessôa L V, Bressan F F, Freude K K. Induced pluripotent stem cells throughout the animal kingdom: availability and applications[J]. World Journal of Stem Cells, 2019, 11(8): 491.
[20] Bode A, Salvenmoser W, Nimeth K, et al. Immunogold- labeled S-phase neoblasts, total neoblast number, their distribution, and evidence for arrested neoblasts in(Platyhelminthes, Rhabditophora)[J]. Cell and Tissue Research, 2006, 325(3): 577-587.
[21] 许崇任, 程红. 动物生物学[M]. 第2版. 北京: 高等教育出版社, 2008: 56-62. Xu Chongren, Cheng Hong. Animal Biology, 2nd ed[M]. Beijing: Higher Education Press, 2008: 56-62.
[22] Lavrov A I, Kosevich I A. Sponge cell reaggregation: cellular structure and morphogenetic potencies of multicellular aggregates[J]. Journal of Experimental Zoology Part A: Ecological Genetics and Physiology, 2016, 325(2): 158-177.
[23] 孙黎明. 繁茂膜海绵原细胞的鉴别、分离纯化和体外培养研究[D].辽宁大连: 中国科学院研究生院(大连化学物理研究所), 2006. Sun Liming. Studies on the identification, purification and culture in vitro of archaeocytes from marine sponge[D]. Dalian, Liaoning Province: Dalian Institute of Chemical Physics, Chinese Academy of Sciences, 2006.
[24] Conkling M, Hesp K, Munroe S, et al. Breakthrough in marine invertebrate cell culture: sponge cells divide rapidly in improved nutrient Medium[J]. Scientific Reports, 2019, 9(1): 1-10.
[25] Olano C T, Bigger C H. Phagocytic activities of the gorgonian coral[J]. Journal of Invertebrate Pathology, 2000, 76(3): 176-184.
[26] Seipel K, Yanze N, Schmid V. The germ line and somatic stem cell genein the jellyfish[J]. International Journal of Developmental Biology, 2003, 48(1): 1-7.
[27] Gehrke A R, Srivastava M. Neoblasts and the evolution of whole-body regeneration[J]. Current Opinion in Genetics & Development, 2016, 40: 131-137.
[28] Strand N S, Allen J M, Zayas R M. Post-translational regulation of planarian regeneration[C]//Seminars in cell & developmental biology. Academic Press, 2019, 87: 58-68.
[29] Brusca R C, Brusca G J. Invertebrates[M]. Sunderland, Massachusetts, Sinauer Associates, 2003.
[30] Rebscher N, Lidke A K, Ackermann C F. Hidden in the crowd: primordial germ cells and somatic stem cells in the mesodermal posterior growth zone of the polychaeteare two distinct cell populations[J]. EvoDevo, 2012, 3: 9.
[31] Fischer A H L, Arendt D. Mesoteloblast-like mesodermmal stem cells in the polychaete annelid(Nereididae)[J]. Journal of Experimental Zoology Part B: Molecular and Developmental Evolution, 2013, 320(2): 94-104.
[32] Giani V C, Yamaguchi E, Boyle M J, et al. Somatic and germline expression ofduring development and regeneration in the marine polychaete annelid[J]. EvoDevo, 2011, 2: 10.
[33] Kozin V V, Kostyuchenko R P.,, andgene expression during caudal regeneration of the polychaete annelid[J]. Development Genes and Evolution, 2015, 225(3): 129-138.
[34] Shukalyuk A, Isaeva V, Kizilova E, et al. Stem cells in the reproductive strategy of colonial rhizocephalan crustaceans (Crustacea: Cirripedia: Rhizocephala)[J]. Invertebrate Reproduction & Development, 2005, 48(1-3): 41-53.
[35] Chen S N, Chi S C, Kou G H, et al. Cell culture from tissues of grass prawn,[J]. Fish pathology, 1986, 21(3): 161-166.
[36] Claydon K, Owens L. Attempts at immortalization of crustacean primary cell cultures using human cancer genes[J]. In Vitro Cellular & Developmental Biology- Animal, 2008, 44(10): 451.
[37] Claydon K, Roper K G, Owens L. Attempts at producing a hybridised Penaeus mondon cell line by cellular fusion[J]. Fish & Shellfish Immunology, 2010, 29(3): 539-543.
[38] Puthumana J, Prabhakaran P, Philip R, et al. Attempts on producing lymphoid cell line fromby induction with SV40-T and 12S EIA oncogenes[J]. Fish & Shellfish Immunology, 2015, 47(2): 655-663.
[39] 韩倩. 对虾淋巴组织的原代和传代细胞培养及其永生性转化研究[D]. 山东青岛: 中国海洋大学, 2013. Han Qian. Study on the primary culture, subculture and immortalization transformation of the cells from the lymphoid organs of greasyback shrimp[D]. Qingdao, Shandong Province: Ocean University of China, 2013.
[40] Ma J, Zeng L, Lu Y. Penaeid shrimp cell culture and its applications[J]. Reviews in Aquaculture, 2017, 9(1): 88-98.
[41] Sivakumar S, Swaminathan T R, Anandan R, et al. Medium optimization and characterization of cell culture system fromfor adaptation of white spot syndrome virus (WSSV)[J]. Journal of Virological Methods, 2019, 270: 38-45.
[42] 刘万磊. 水生无脊椎动物细胞培养[J]. 细胞生物学杂志, 2006, 28(2): 173-178. Liu Wanlei. Cell culture of aquatic invertebrate[J]. Chinese Journal of Cell Biology, 2006, 28(2): 173-178.
[43] Hansen E L. A cell line from embryos of(Pulmonata): Establishment and characteristics[M]// Maramorosch K. Invertebrate Tissue Culture: Research Applications. New York: Academic Press, 1976: 75-97.
[44] 张晓燕, 王昌留, 李琳. 海洋无脊椎动物细胞培养的制约因素及改进方法[J]. 鲁东大学学报(自然科学版), 2015, 31(4): 313-317. Zhang Xiaoyan, Wang Changliu, Li Lin. Restrictive factor and improved strategy of cell culture from marine invertebrates[J]. Journal of Ludong University (Natural Science Edition), 2015, 31(4): 313-317.
[45] 李建军, 黄宝玉. 海洋贝类细胞培养技术及其应用[J].海洋通报, 2015, 34(3): 247-251. Li Jianjun, Huang Baoyu. Technology and application of marine shellfish cell culture[J]. Marine Science Bulletin, 2015, 34(3): 247-251.
[46] 陈颉, 许璞, 沈爱国, 等. 文蛤外套膜组织与细胞培养[J]. 海洋科学, 2007, 31(6): 60-64. Chen Jie, Xu Pu, Shen Aiguo, et al. Tissue and cell culture of mantle in[J]. Marine Sciences, 2007, 31(6): 60-64.
[47] You Y, Huan P, Liu B. RNAi assay in primary cells: a new method for gene function analysis in marine bivalve[J]. Molecular Biology Reports, 2012, 39(8): 8209-8216.
[48] Fang Z, Feng Q, Chi Y, et al. Investigation of cell proliferation and differentiation in the mantle of(Bivalve, Mollusca)[J]. Marine Biology, 2008, 153(4): 745-754.
[49] Candia-Carnevali M D, Thorndyke M C, Matranga V. Regenerating echinoderms: a promise to understand stem cells potential[M]//Rinkevich B and Matranga V. Stem cells in marine organisms. Springer, Dordrecht, 2009: 165-186.
[50] Reinardy H C, Emerson C E, Manley J M, et al. Tissue regeneration and biomineralization in sea urchins: role of Notch signaling and presence of stem cell markers[J]. PloS One, 2015, 10(8): e0133860.
[51] Wang T, Chen X, Xu K, et al. Apoptosis induction and detection in a primary culture of sea cucumber intestinal cells[J]. Journal of Visualized Experiments: Jove, 2020, 155: e60557.
[52] Di Benedetto C, Parma L, Barbaglio A, et al. Echinoderm regeneration: an in vitro approach using the crinoid[J]. Cell and Tissue Research, 2014, 358(1): 189-201.
[53] Voskoboynik A, Weissman I L. Botryllus schlosseri, an emerging model for the study of aging, stem cells, and mechanisms of regeneration[J]. Invertebrate Reproduction & Development, 2015, 59(sup1): 33-38.
[54] O’Dea A. Asexual propagation in the marine bryozoan[J]. Journal of Experimental Marine Biology and Ecology, 2006, 335(2): 312-322.
[55] Shunatova N, Borisenko I. Proliferating activity in a bryozoan lophophore[J]. PeerJ, 2020, 8: e9179.
[56] Sköld H N, Obst M, Sköld M, et al. Stem cells in asexual reproduction of marine invertebrates[M]/// Rinkevich B and Matranga V. Stem cells in marine organisms. Springer, Dordrecht, 2009: 105-137.
[57] Sunanaga T, Saito Y, Kawamura K. Postembryonic epigenesis of-positive germ cells from aggregated hemoblasts in the colonial ascidian,[J]. Development, Growth & Differentiation, 2006, 48(2): 87-100.
[58] Rinkevich B. Cell cultures from marine invertebrates: new insights for capturing endless stemness[J]. Marine Biotechnology, 2011, 13(3): 345-354.
[59] Gulaia V, Kumeiko V, Shved N, et al. Molecular mechanisms governing the stem cell’s fate in brain cancer: factors of stemness and quiescence[J]. Frontiers in Cellular Neuroscience, 2018, 12: 388.
[60] Hwang S S, Lim J, Yu Z, et al. mRNA destabilization by BTG1 and BTG2 maintains T cell quiescence[J]. Science, 2020, 367(6483): 1255-1260.
[61] Roche B, Arcangioli B, Martienssen R A. RNA interference is essential for cellular quiescence[J]. Science, 2016, 354(6313): aah5651.
[62] Smeets S J, van der Plas M, Schaaij-Visser T B M, et al. Immortalization of oral keratinocytes by functional inactivation of the p53 and pRb pathways[J]. International Journal of Cancer, 2011, 128(7): 1596-1605.
[63] Forsyth N R, Morales C P, Damle S, et al. Spontaneous immortalization of clinically normal colon-derived fibroblasts from a familial adenomatous polyposis patient[J]. Neoplasia, 2004, 6(3): 258-265.
Establishment of cell lines from marine invertebrates by inducing cellular stemness
CEN Wei1, 2, HU Meng-zhu1, 2, RINKEVICH Baruch3, HU Guo-bin1, 2
(1. College of Marine Life Science, Ocean University of China, Qingdao 266003, China; 2. Institute of Evolution & Marine Biodiversity, Ocean University of China, Qingdao 266003, China; 3. Oceanographic and Limnological Research, National Institute of Oceanography of Israel, Tel-Shikmona, P.O. Box 8030, Haifa 31080, Israel)
Establishment of cell lines is of great significance in the field of biology. Contrary to the field of insect research, in which development of various cell lines has become routine, the marine invertebrate cell culture research has remained at the primary culture stage. Not a single marine invertebrate immortal cell line has been established yet even after decades of research. This paper discusses the research progress in the field of marine invertebrate cell culture in the recent years. It also discusses the basic principle behind the development of immortal cell lines from marine invertebrates through induction of cellular stemness. At first, induced pluripotent stem (iPS) cells of marine animals must be prepared. The technology used for developing iPS cells of mammals and other vertebrates is quite developed and involves dedifferentiation of somatic cells into iPS cells using transcription factors. Another method that can be used for developing iPS cells involves the use of adult stem cells (ASCs) from marine animals. There are a large number of ASCs in marine invertebrates; the ASCs play an important role in many processes, such as organism development and reproduction. Under certain culture conditions, iPS cells and ASCs of marine invertebrates can form immortal cell lines using characteristics of self-generated stem cells.
marine invertebrates; cell cultures; iPS cells; stem cells; immortal cell line
Jun. 13, 2020
Q178.53, Q813.11
A
1000-3096(2021)01-0146-09
10.11759/hykx20200613001
2020-06-13;
2020-09-27
山东省自然科学基金(ZR2019MC051), 中央高校基本科研业务费(201822025)
[Shandong Provincial Natural Science Foundation, No. ZR2019MC051; Fundamental Research Funds for Central Universities, No. 201822025]
岑卫(1993-), 男, 山西朔州人, 硕士研究生, 主要从事海洋生物学研究, E-mail: keykamio@163.com; 胡国斌, 男,通信作者, 教授, E-mail: huguobin@ouc.edu.cn
(本文编辑: 赵卫红)

