黄棒菜超氧化物歧化酶 (SOD) 分离纯化的技术
徐璐,赵秩颢,郑彩霞
北京林业大学生物科学与技术学院(北京 102442)
黄棒菜(Rheum palmatumL. var.)是蓼科、酸模属的多年生草本植物,为掌叶大黄(Rheum palmatumL.)的改良品种,由北京天力宏泰科技发展有限公司培育并投入市场。黄棒菜耐寒耐旱、耐盐碱、耐瘠薄,适宜种植区域广泛;速生高产,生长最快时每昼夜可达7~10 cm,一次播种可稳定高产20年;营养成分丰富,每100 g植物粉含有蛋白质25 g、纤维素29 g、叶绿素821 mg、维生素E 888 mg,作为牧区饲草推广使用;超氧化物歧化酶(SOD)含量高,每克酶活力达14.17 U,具有作为SOD提取原料的巨大潜力[1]。
SOD是一种广泛存在于生物体内的核编码酸性金属酶[2-3],可分为3种类型:Cu/Zn-SOD、Fe-SOD和Mn-SOD[3-4]。作为抗氧化系统的第一道防线[5-6],SOD可催化超氧阴离子的歧化反应,清除体内活性氧(ROS),抑制肿瘤、癌症等疾病诱发[7-8]。在食品、化妆品、临床医学、农业等领域中SOD应用广泛[9-10]。中国多以动物血液生产SOD,其成本高、安全性差,且存在致热因子、病毒等污染物残留的风险[2,11],因此寻找生产SOD的植物来源具有重要意义。由于黄棒菜安全性高、成本低且SOD含量丰富,试验以其为材料,研究提取SOD的最佳条件并建立SOD分离纯化的技术体系,为黄棒菜进一步开发利用提供试验参考。
1 材料与方法
1.1 材料与试剂
黄棒菜(Rheum palmatumL. var.)-80 ℃贮存干叶及新鲜叶茎、叶片(北京天力宏泰科技发展有限公司)。
磷酸氢二钠、磷酸二氢钠、丙酮、磷酸、乙醇、盐酸、甘油、溴酚蓝、冰醋酸(北京化工厂);乙二胺四乙酸二钠、丙烯酰胺、Tris、甘氨酸、TEMED(北京拜尔迪生物公司);牛血清白蛋白(Ⅴ)(北京红星生化技术公司);TCA(山东西亚化学股份有限公司);考马斯亮蓝G-250(上海化学试剂公司);L-甲硫氨基酸(上海沪试实验室器材公司);β-巯基乙醇(杭州弗德生物科技有限公司);NBT(BAIGEN);核黄素(SBH-bio);APS、N,N’-甲叉双丙烯酰胺(Amresco);考马斯亮蓝R-250(Biomol);SDS(MYM);葡聚糖凝胶G-75(Solarbio)。试剂均为分析纯。
1.2 设备与仪器
CT15RT型台式高速冷冻离心机、HimacCF15R型高速微型离心机(Hitachi);ME-T型分析天平(Mettler Toledo);85-2A型数显测速恒温磁力搅拌器(江苏省金坛市荣华仪器制造公司);UV-2000紫外分光光度计(Unico);Cryo CubeF570型超低温冰箱(Eppendorf);555BR型蛋白凝胶电泳套件(Bio-rad);PB-10型酸度计(Sartorius);Milli-Q Reference型超纯水系统(Millipore)。
1.3 黄棒菜SOD提取流程

1.4 粗酶液的提取
采用L9(34)正交试验,考察料液比(1∶3,1∶4和1∶5 g/mL)、浸提温度(-20,0和4 ℃)、浸提pH(7.0,7.5和8.0)对黄棒菜SOD酶活力的影响。称取一定量-80 ℃贮存的黄棒菜干叶,加入4 ℃预冷的磷酸盐缓冲液(50 mmol/L,pH 7.8),冰上研磨匀浆,不同温度下浸提6 h后,离心10 min(4 ℃,6 000 r/min),取上清液制成粗酶液。
1.5 SOD的分离纯化
1.5.1 热变性对黄棒菜SOD酶活力的影响
将粗酶液置水浴锅内,分别固定热变性时间20 min、热变形温度50 ℃,考察不同热变形温度(40,50,60和70 ℃)、热变性时间(15,20,25和30 min)对黄棒菜SOD酶活力的影响。热变性后,4 ℃冰浴30 min,离心10 min(4 ℃,6 000 r/min),收集上清液。
1.5.2 丙酮沉淀对黄棒菜SOD酶活力的影响
向酶液中加入1.0,1.5和2.0倍酶液体积的丙酮,混匀,置于真空冷冻干燥机内抽去丙酮(真空度0.08 MPa、-52 ℃),用PBS缓冲液(50 mmol/L,pH 7.8)将冻干沉淀溶解,离心10 min(4 ℃,6 000 r/min),收集上清液。
1.5.3 葡聚糖凝胶柱层析与冻干粉制备
参照卫秀英等[12]方法预处理葡聚糖凝胶G-75并装柱,用PBS缓冲液(0.05 mmol/L,pH 7.8)洗脱,流速约0.4 mL/min,收集波峰处的洗脱液。量取适量洗脱液,制成冻干粉,-20 ℃保存备用。
1.6 SOD酶活力与蛋白质的测定
1.6.1 SOD酶活力的测定
采用氮蓝四唑(NBT)光还原法[13]测定SOD酶活力。量取待测酶液0.01 mL加入测活体系,25 ℃,4 000 lx光下反应20 min,在560 nm下测定吸光度(空白组调零,对照组以水代替酶液),酶液的SOD酶活力按式(1)计算。
式中:U为酶液总活力,U/mg;A560nm为对照组吸光度;A’560nm为测定组吸光度;V为体系总体积,mL。

1.6.2 蛋白质含量的测定
采用考马斯亮蓝G-250法[14]并参照裴显庆[15]做法,以1 mg/mL牛血清白蛋白(V)溶液绘制标准曲线(如图1)。量取待测酶液100 μL与考马斯亮蓝溶液5 mL混匀,静置2 min后测定595 nm下的吸光度,酶液蛋白含量按式(2)计算。
蛋白质含量(mg/mL)=A595nm×V/(Vt×k)(2)式中:A595nm为酶液吸光度;V为体系总体积,mL;Vt为酶液加入体积,mL;k为标准曲线斜率。

图1 蛋白质量浓度标准曲线
1.6.3 SDS-PAGE电泳检验
参照彭继千[16]做法,量取沸水浴后的酶液25 μL和0.1%溴酚蓝染液5 μL混匀,制成上样液。选择3%浓缩胶和10%分离胶,设置电流30 mA,电压分别为150和180 V。电泳后凝胶固定50 min、染色40 min并充分脱色。
1.7 叶茎和叶片SOD的活性及蛋白含量比较
在正交试验和单因素试验结果基础上,取新鲜黄棒菜叶茎和叶片,分别用液氮研磨匀浆,以最佳条件处理,收集各步所得酶液。
2 结果与分析
2.1 粗酶液最佳提取条件的确定
表1~表4结果表明,影响黄棒菜SOD酶活力的主次因素为料液比>浸提温度>浸提pH>随机误差,其中料液比的影响极显著;影响黄棒菜蛋白含量的主次因素为料液比>随机误差>浸提温度>浸提pH,其中料液比、浸提温度、浸提pH影响均不显著,D组极差显示随机误差较大。由于浸提温度(B组)对黄棒菜SOD活力无显著影响,且考虑到控制试验条件的难度,因此选择最佳浸提条件为A1B2C1,即料液比1∶3(g/mL),浸提温度0 ℃,浸提pH 7.0。
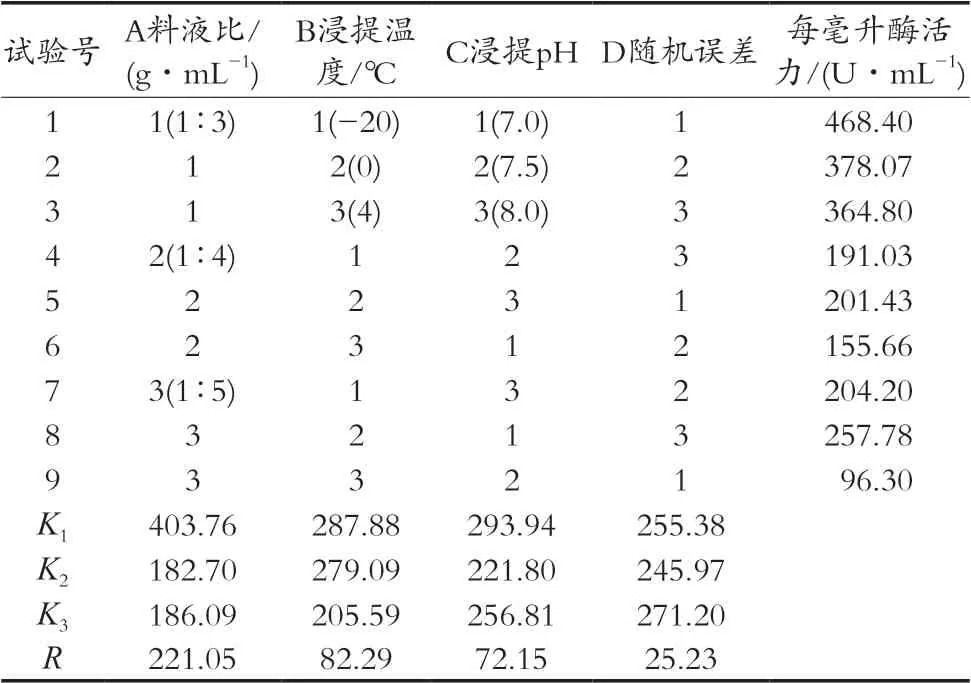
表1 每毫升SOD酶活力的正交试验结果

表2 每毫升SOD酶活力的方差分析及显著性检验

表3 每克鲜重蛋白含量的正交试验结果

表4 每克鲜重蛋白含量的方差分析及显著性检验
2.2 SOD最佳纯化条件的确定
2.2.1 热变性温度的影响
表5结果表明,0~50 ℃,随着热变性温度升高,酶液SOD比活力提高,酶活收率、蛋白去除率降低;50~70 ℃,随温度升高,SOD逐渐失活,比活力下降。其中,50 ℃下比活力最高(57.59 U/mg),40 ℃下酶活收率最高(95.84%)。从50 ℃开始,蛋白去除率变化平缓,杂蛋白基本沉降完全。为便于后续SOD的分离,因此选择50 ℃为最佳热变性温度。

表5 温度的影响
2.2.2 热变性时间的影响
表6结果表明,0~25 min,随着热变性时间延长,酶液SOD比活力提高,酶活收率、蛋白去除率降低;20和25 min时,比活力最高,分别为57.92和57.59 U/mg;25~30 min,随时间延长,SOD失活增加,比活力下降。由于20 min的酶活收率显著高于25 min 8.78%,且长时间的高温处理不利于SOD保存,因此选择20 min为最佳热处理时间。
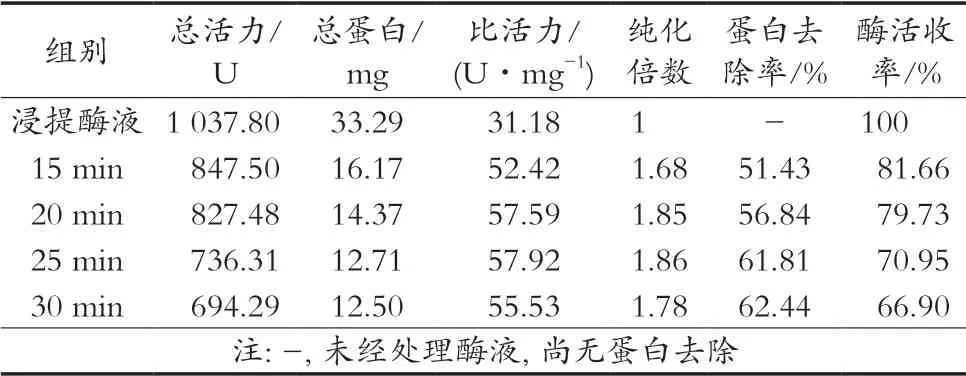
表6 热变性时间的影响
2.2.3 丙酮处理的影响
表7结果表明,随丙酮加入量增加,酶液SOD比活力、酶活收率、蛋白去除率均提高。从丙酮加入量1.5倍开始,酶活收率变化平缓,杂蛋白基本沉降完全。由于丙酮具毒性,且加入量过高时会改变溶液的介电常数,易导致目的蛋白聚集沉降[7],因此选择最佳丙酮加入量1.5倍。
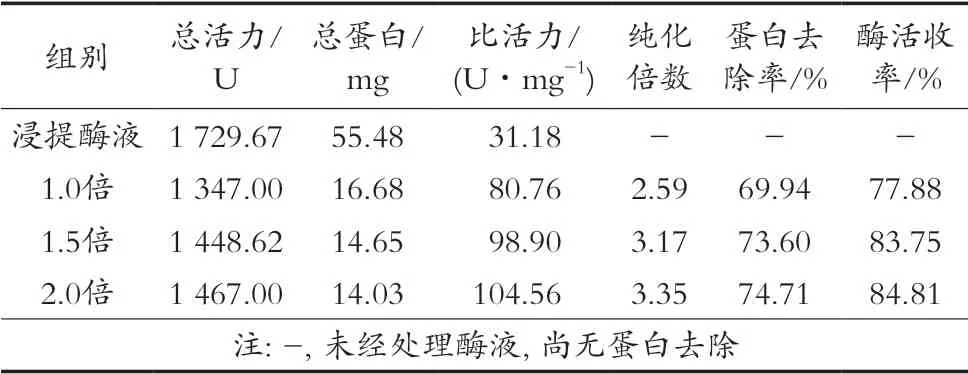
表7 丙酮用量的影响
2.2.4 葡聚糖凝胶层析结果
图2所示,叶茎和叶片的洗脱峰均为单峰,杂蛋白基本去除。波峰处叶茎吸光度较大,蛋白含量较高。A中曲线于峰后出现平缓期(吸光度约0.31),此现象在其他植物SOD的提取试验[10]中亦出现,推测是由于普通的分离提纯操作难以分离相对分子质量高度相似的不同SOD亚基[17],植物材料含多种SOD亚基时,可能出现拖尾现象。

图2 葡聚糖凝胶G-75柱层析吸光曲线
2.3 SOD活性分析与蛋白鉴定
图3 所示,标准牛血清白蛋白相对分子质量约67 kDa,与事实相符。泳道4出现多个条带,表明植物材料的蛋白种类丰富,且浸提条件的提取效果良好。泳道7、8显示黄棒菜SOD相对分子质量约80 kDa,据文献鉴定为Mn-SOD。

图3 SDS聚丙烯酰胺凝胶
2.4 叶茎和叶片SOD活性的测定与分析
表8和表9结果表明,经最佳条件处理,新鲜的黄棒菜叶茎、叶片SOD比活力分别可达7 662.23和4 897.39 U/mg,纯化倍数分别为17.55和23.08。各步中叶茎SOD比活力均高于叶片,丙酮处理后,叶茎SOD酶活回收率较高,认为叶茎更适于提取SOD。表8显示,层析后,叶茎SOD总活力损失较多,原因是在测定叶茎蛋白时只使用主要波峰段的洗脱液,为保证纯化效果,所以舍弃异常区段的洗脱液。

表8 叶茎的SOD
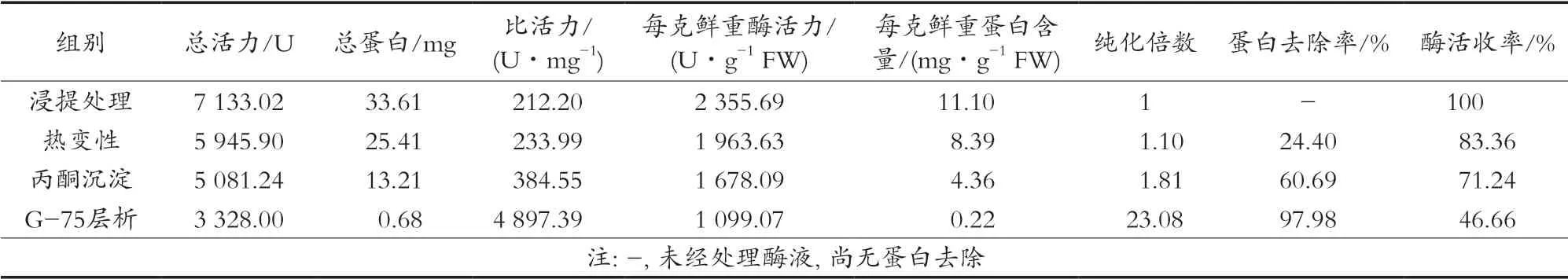
表9 叶片的SOD
3 讨论与结论
3.1 黄棒菜作为SOD生产原料的优势
黄棒菜价格低廉,产量高、抗逆性强,适于大规模种植,其SOD和蛋白质含量相比其他植物较高[1]。最佳条件下黄棒菜SOD的浸提效果良好;利用SOD热稳定性[2],热变性与丙酮沉淀可有效去除杂蛋白,且对SOD破坏小;丙酮冻干后,叶茎、叶片组织SOD的酶活收率分别为82.62%和71.24%;经层析纯化,叶茎和叶片SOD比活力(叶茎7 662.23 U/mg)、叶片(4 897.39 U/mg)均高于其他植物,如玉米胚(3 079.41 U/mg)[2]、野生猕猴桃(1 520 U/mg)[9]、绿豆芽(2 797.2 U/mg)[18]等;废弃的植物残渣亦可作饲料等再利用。黄棒菜具有作为SOD生产原料的突出优势。
3.2 植物SOD的制备方法及应用前景
生产SOD主要有4种途径[8]:动物血液提取法、植物提取、微生物发酵法和基因工程法。其中,动物提取的SOD存在交叉感染和过敏反应等风险,不适于用在人类医疗、保健等;微生物法受发酵温度和pH影响大,产量难以控制;基因工程法成本高,且对技术与设备要求严格。相比之下,植物提取SOD具有绿色安全、成本低、取材便利、产量稳定等优势,且多种提纯方法可供使用:制备粗酶液可采用磷酸缓冲液提取法、Tris-HCl法和热变性法等;纯化可采用分步盐析、有机溶剂沉淀、层析等,此外新技术如超声波辅助萃取、树脂吸附、双水相萃取等也被用于植物SOD提取。针对试验的不足,如步骤较多、使用丙酮的负面影响等,日后学者可借助新技术来解决此类问题。SOD是众多药物、食品、化妆品生产中的重要原料,而中国仍主要以动物血液生产SOD,产量低且应用领域有限,致使市场上SOD已供不应求。因此优化植物SOD的提取工艺,实现植物资源的更大经济价值,具有现实意义。
3.3 结论
黄棒菜SOD的最佳提取条件:料液比1∶3,浸提温度0 ℃,pH 7.0,50 ℃热变性20 min,1.5倍酶液体积的丙酮。经层析纯化,叶茎、叶片SOD比活力可达7 662.23和4 897.39 U/mg;经分析,认为叶茎更适于提取SOD;层析图谱显示,最佳条件下杂蛋白去除效果良好;经电泳检测,黄棒菜SOD相对分子质量约80 kDa,初步鉴定为Mn-SOD。试验优化黄棒菜SOD的提取工艺,为其进一步的资源开发提供理论依据。

