绿色合成氧化锰纳米颗粒的制备及去除水体中Cu(II)的研究
何峰鑫
(福建师范大学 环境科学与工程学院,福建 福州 350007)
1 引言
目前,自然环境中的重金属离子由于具有毒性、生物积累和不可降解性成为世界性的公共卫生问题[1,2]。随着技术的发展,在矿产资源开发、陶瓷、电镀等领域中,重金属污染物被广泛地研究[3]。Cu(II)是一种过渡金属,当大量的Cu(II)离子残留在水体中时,它会为人体器官带来极大的负担。因此,当水中重金属离子的浓度超过允许水平,就需要从水中清除这些重金属离子[3]。目前,去除重金属离子的传统方法有生物处理法[5]、化学处理法[6]、反渗透法[7]、膜分离法[8]等,然而这些技术由于成本高并且容易造成环境污染等缺点限制了它们的应用范围[5]。吸附技术在环境保护中发挥着重要作用[9],许多吸附剂已被广泛应用于处理重金属离子,如酸或沸石的离子交换、活性炭、碳纳米管[10]。但是这些吸附剂依旧存在去除率低和成本高的问题,因此研制一种高去除率、环境友好、低成本的吸附剂具有重要的意义。
在过去的二十年里,纳米技术取得了显著的进展,纳米技术处理方法有望超越并替代传统废水处理方法[11,12]。纳米材料拥有球状、管状、棒状和棱柱状等不同形态,纳米粒子由于具有较高的反应性和比表面积,光学和其他性质的可控性等特点,被广泛应用于如电子、生物医学、环境分析和修复、催化和材料科学[13]等不同的领域。
纳米吸附剂已经逐渐成为水处理中最受欢迎的方法之一,许多研究者将纳米材料应用于吸附重金属并取得较好表现[4]。绿色合成纳米技术由于具有可以减少合成中产生的有害废物,减少环境污染,使用更安全的溶剂和可再生原料等优点而受到广大研究人员的关注[14]。植物叶子提取物中存在的化学物质具有在更短的时间内还原金属离子的潜力[15],因此植物叶子提取物被认为是合成金属和金属氧化物纳米颗粒的一种较好的来源。此外,植物叶子提取物中的植物化学物质,如酰胺、萜类、羧酸、酚类和茶多酚等可以在纳米颗粒的合成过程中起到作为还原剂和稳定剂的双重作用,促进纳米颗粒的合成[16]。锰氧化物由于其丰富的结构和组成变化,已经被应用于超级电容器、催化、水处理和微电子等领域,绿色合成锰氧化物纳米颗粒能有效避免化学合成所产生的毒性,因此,锰氧化物纳米颗粒存在很大的发展潜力[17]。
在本研究中,使用绿茶提取液作为还原剂成功地合成了MnNPs,并通过XRD、FT-IR、SEM、BET等方法对制备的纳米材料进行了表征,并对其去除水中重金属Cu(II)进行了研究。
2 实验部分
2.1 实验材料
绿茶购买于中国福建安溪的一家茶厂;乙酸钠(NaAc)、无水乙醇(CH3CH2OH)、高锰酸钾(KMnO4)、硫酸铜(CuSO4)购买自上海麦克林生物化学有限公司。
本实验中使用的所有化学试剂均为分析纯试剂。
所有溶液均用去离子水配制,并且使用1 mol/L的HCl和1 mol/L的NaOH调节溶液的pH值。
2.2 实验方法
2.2.1 Mn NPs 的制备
将40 g绿茶与1000 mL去离子水放入1000 mL烧杯中,在80 ℃的水浴中加热1 h,随后自然冷却至室温。用布氏漏斗过滤得到绿茶提取物,并将绿茶提取物保存在冰箱里备用。
将2 g KMnO4和10 g NaAc分别用去离子水经超声充分溶解,制备成20 g/L的KMnO4溶液和100 g/L的NaAc溶液。配置2份20 g/L KMnO4溶液与200 mL的绿茶提取物(40 g/L)的混合液,其中一份添加100 g/L的NaAc溶液,另一份则不添加NaAc溶液。将2份20 g/L KMnO4溶液分别缓慢加到200 mL的绿茶提取物(40 g/L)中,其中一份添加100 g/L的NaAc溶液,另一份则不添加NaAc溶液,然后在70 ℃水浴中搅拌上述2份混合溶液8 h直至溶液颜色变为深棕色。随后使用离心机离心过滤,获得的固体经过无水乙醇与去离子水清洗,再经超声溶解并放入冰箱里冷冻24 h,最后使用冷冻干燥机冷冻干燥,获得Mn NPs样品2份。
2.2.2 吸附Cu(II)实验
将Mn NPs移入装有10 mg/L的Cu(II)溶液的200 mL的锥形瓶,将这些样品以250 r/min的速度放在旋转振动器上。在时间间隔为2、5、10、15、20、30、45、60、90、120 min时取样并经0.22μm过滤膜过滤后,使用ICP-AES(PerkinElmer,USA)测定Cu(II)残留量。Mn NPs吸附Cu(II)的吸附效率公式如下:
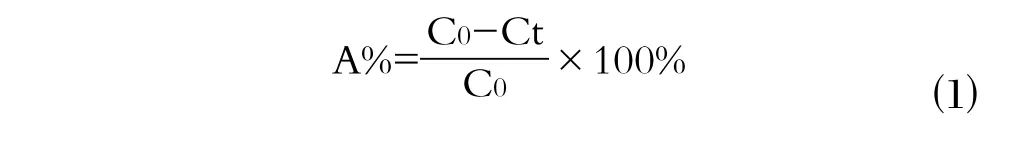
2.2.3 表征手段
使用型号为D8 ADVANCE X射线衍射仪(XRD)(德国布鲁克),在40 kV和40 mA下,以3°/min的扫描速率从10°到90°(2θ)扫描样品,表征Mn NPs的晶相结构。
使用扫描电子显微镜(SEM)观察材料的形貌和结构,并通过Regulus 8100扫描电子显微镜(日本日立)分析元素的种类和含量。
傅立叶变换红外(FT-IR)光谱,使用Nicolet10红外分析仪(Thermo Fisher,美国)测量,每个样品平均收集9次扫描,分辨率为2 cm-1。用BET方法计算比表面积,并用BELSORP-mini II(BEL,日本)通过Barret-Joyner-Halenda(BJH)模型计算并从吸附等温线获得的孔径分布。
2.2.4 混合污染物模拟实验
在1000 mL容量瓶中用水稀释含有10 mg/L的Cu(II)和2 mg/L的As(V)的母液,并取200 mL于250 mL锥形瓶中用于废水实验。在0、5、10、20、30、60、90、120、150、180 min时取样并使用ICP仪器测量废水中的Cu(II)浓度。
3 结果与讨论
3.1 表征

图1 氧化锰纳米颗粒(Mn NPs)的SEM图
3.1.1 SEM分析
扫描电镜(SEM)观察锰纳米粒子的表面形貌,图1(a)为未加NaAc的Mn NPs图片,图1(b)为添加NaAc的Mn NPs的表面形貌。从图1(a)可知未加NaAc的Mn NPs的颗粒大小为200 nm~10μm,尺寸分布较广,且存在一些形态不一的块状颗粒。将图放大显示有较多颗粒相互团聚,且分布不均匀,孔隙较小。图1(b)为添加NaAc后合成的Mn NPs,呈颗粒状,分布均匀,不黏着,粒径约为40 nm~130 nm。图1(c)为图1(b)的Mn NPs的粒径分布,该图显示添加NaAc的Mn NPs的平均粒径约为83.8032 nm,与图2所表现的一致。由于NaAc呈弱碱性,当加入之后,pH由5.05升至6.46,使颗粒生长较为稳定,分布更加均匀[18]。由SEM图可知,已成功合成纳米级别的Mn NPs。
用氮气吸附-脱附等温线研究添加NaAc的Mn NPs前后的比表面积、孔体积和孔径,结果见表1。结果表明,未添加NaAc的Mn NPs比表面积为27.898 m2/g,总孔容为0.1138 cm3/g,孔径为16.31 nm;添加NaAc后的Mn NPs的比表面积和孔体积分别上升至82.294 m2/g、0.1854 cm3/g,孔径下降到9.012 nm。
图2可见,当相对压力达到 0.9时,Mn NPs的吸附量大大增加,这表明了Mn NPs 纳米颗粒中的孔洞主要是以介孔和大孔的形式存在的。同样,从图2(b)的孔径分布图可以看出,未添加NaAc的Mn NPs由颗粒堆积产生的孔径大小主要分布在3~200 nm之间,添加后的Mn NPs中产生的孔径大小约为1~95 nm,进一步证实了Mn NPs中的孔洞结构主要由介孔和大孔组成[19]。添加NaAc使绿茶的生物官能团能被有效包裹在Mn NPs表面,而大的比表面积和介孔与大孔结构为污染物提供了大量的吸附位点[20],有利于对污染物的吸附。当NaAc和更多的生物官能团被包裹在Mn NPs表面时,造成Mn NPs之间的孔洞被堆积,从而造成孔径减小。

表1 Mn NPs样品的比表面积、总孔体积和孔径
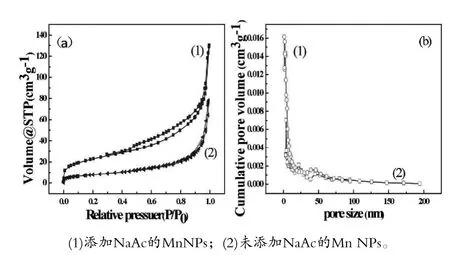
图2 MnNPs样品的氮吸附-解吸等温线(a)及其BJH尺寸分布(b)
3.1.2 XRD分析
图3为添加NaAc的Mn NPs前后XRD谱图的对比。在图3(a)曲线(1)中可以看出,没有明显的Mn衍射峰,表明Mn NPs为无定形[21];而添加NaAc后的Mn NPs衍射峰较强,与标准卡片PDF#00-044-1472在XRD图谱中24.2°、31.3°、37.5°、41.4°、51.5°的强峰对应,可判断出Mn NPs主要成分是MnCO3,根据谢勒公式可以算出大概粒径为80 nm,与SEM图结果一致。
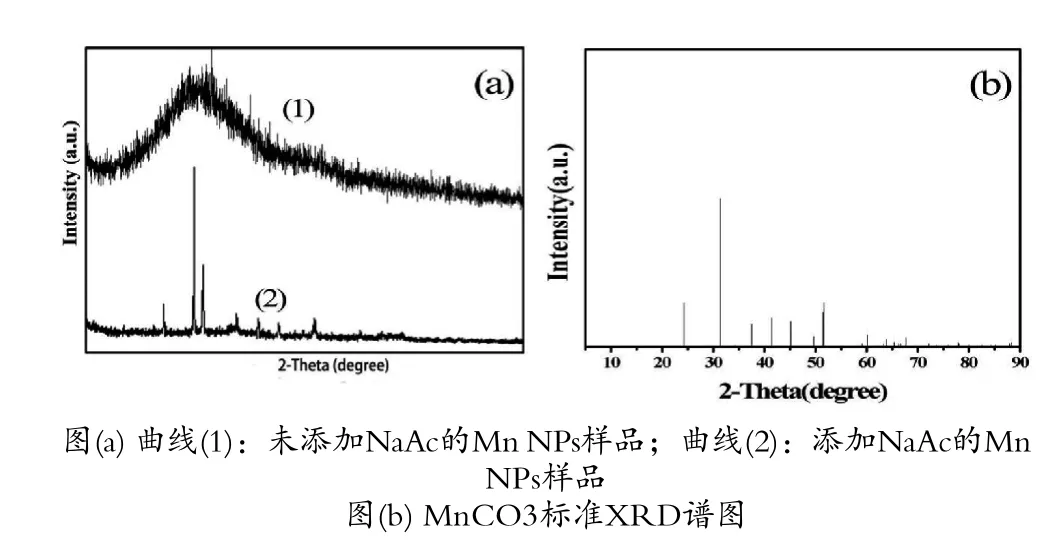
图3 Mn NPs样品和MnCO3 的PDF标准XRD谱图
3.1.3 FT-IR分析
利用傅里叶红外光谱检测Mn NPs和绿茶提取物(GT)的官能团的变化。图4曲线(b)绿茶提取物的红外光谱图可以看出典型的有机峰,在Mn NPs形成的样品的光谱曲线(a)中也能微弱地看到它们的存在,证实了它们在表面上的存在。在3438 cm-1处的宽吸收峰表明-OH键的拉伸振动,1050 cm-1为游离O-H的伸缩振动峰[22],564 cm-1处的吸收带对应于Mn-O的拉伸振动,这表明制备的Mn NP中存在MnO2[23],在1066.06 cm-1处的吸收峰表示Mn-OH。此外在2927 cm-1处的吸收峰归因于饱和C-H的拉伸振动,这应该是由于绿茶表面的生物官上的C-H成功附着上Mn NPs分子上。本研究的FT-IR光谱证实了绿茶提取物(GT)表面的生物官能团成功包覆在Mn NPs上。
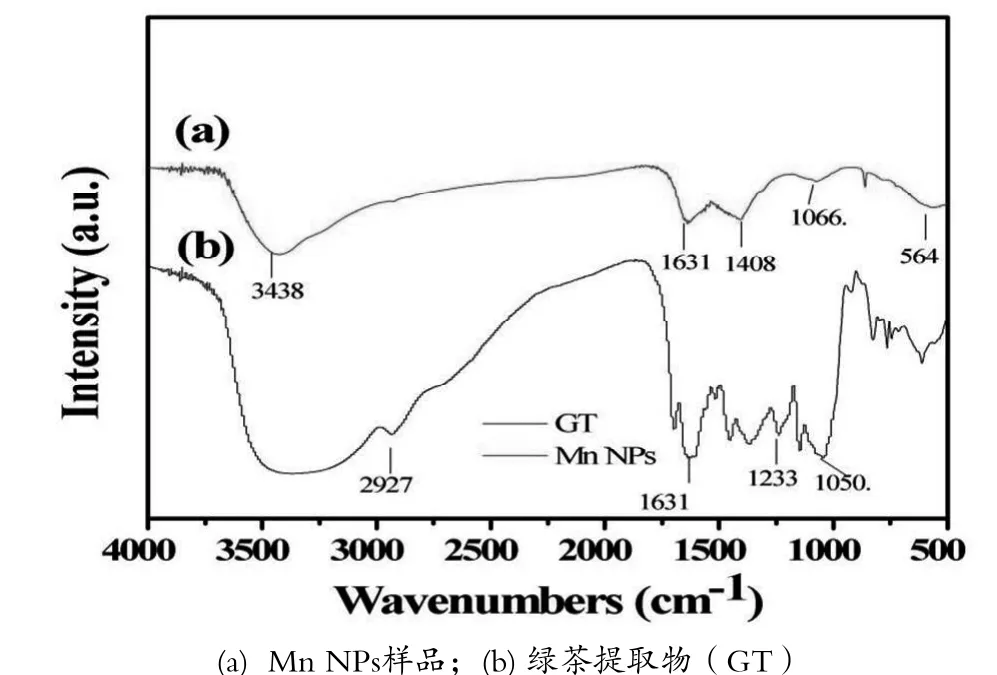
图4 Mn NPs样品及绿茶提取物(GT)的FT-IR光谱图
3.1.4 Mn NPs的投加量对Cu(II)及混合污染物中Cu(II)去除率的影响
图5显示了不同吸附剂用量对Cu(II)去除率的影响。结果表明,MnNPs对Cu(II)总体上具有较好的去除效果,Mn NPs的投加量对Cu(II)的去除率有一定的影响。随着Mn NPs投加量从0.125 g/L逐渐增加至0.75 g/L,5 min时,去除率从39%增加至81.7%;90min时,各投加量的去除率达到平衡;120 min时投加量为0.125 g/L的去除率为83.39%,而0.75g/L的去除效率为97.01%。
由图5(b)可知,随着投加量增加,Mn NPs对Cu(II)吸附位的数量增加,吸附的活性位点越多,两者之间相互接触机会增大[24],从而提高了Cu(II)的去除率。Mn NPs投加量从0.125 g/L提高到0.75 g/L,当5min时,去除效率从26.70%上升到57.77%和74.65%,60min以后,去除效率趋于平衡,Cu(II)去除效率从83.39%上升至92.61%和97.01%,表明Mn NPs投加量越高Cu(II)的去除效率。
图5(b)为MnNPs去除Cu(II)混合溶液与单独去除各自单一污染物效率的对比。由图可知,混合溶液去除Cu(II)比单独去除Cu(II)率更高,在60 min时效率趋向稳定于90%。造成该现象的原因可能是由于当溶液中pH值为中性时,溶液中的As(V)吸附量较低,而溶液中的OH-离子被Mn NPs表面生物官能团相吸,增加Mn NPs对正电荷的吸附位点,并且随着pH值的增加,Mn NPs表面负电荷增强,对Cu(II)的吸附强度增加,从而使吸附效率增加,使得在混合溶液中Cu(II)去除率提升。
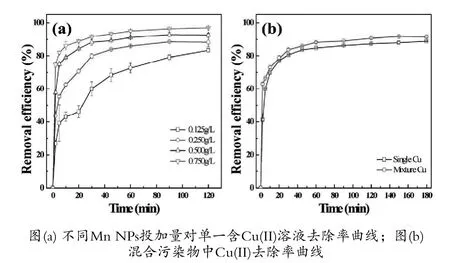
图5 不同Mn NPs投加量对Cu(II)及混合污染物中Cu(II)去除率的影响
3 结论
本文使用一步合成法,以绿茶提取液为还原剂,NaAc作为缓冲剂,将KMnO4还原为Mn NPs,研究了合成过程中NaAc对Mn NPs材料的影响,并通过XRD、FTIR、BET、SEM等表征手段对Mn NPs的成分、形貌进行分析,最后将Mn NPs应用于水体中Cu(II)的吸附实验。
结果发现:⑴ 未添加NaAc还原成的Mn NPs晶型为无定形,形态较为多样,颗粒分布也不均匀,尺寸大小不一,而添加NaAc通过调节溶液中pH值,固定晶型,提取液有机组分官能团能包裹Mn NPs形成较为均匀的纳米颗粒,并且增加了材料比表面积,从而产生更多的吸附位点。⑵ 模拟Cu(II)废水去除实验中去除率最高可达97.01%,混合污染物去除率可达90%,说明该材料有较高的研究与利用价值。

