通过融合白蛋白结合域延长抗CD47纳米抗体的半衰期∗
高晓娟,娜斯拜·阿卜杜瓦哈普,马晓玲,王鲁娟,王 飞,李江伟†
(1. 新疆大学 生命科学与技术学院,新疆生物资源基因工程重点实验室,新疆乌鲁木齐830046;2. 新疆优迈生物技术有限公司,新疆 乌鲁木齐830011 )
0 引言
蛋白质作为生物体内最重要的一类生物大分子物质,因其具有特异性高、用药剂量低、生理活性强等特点,目前被广泛地作为药物用于人类疾病治疗.但由于分子量大、抗原性强、具有毒副作用多等缺点,限制了其在临床上的使用[1,2].因此大量小分子蛋白或基因工程肽类药物相继被开发应用.然而,由于这些小分子蛋白或多肽分子尺寸减小,通常会迅速从体内清除,导致其血浆半衰期缩短[3].因此,通过蛋白质工程技术来提高蛋白药物的体内半衰期,已成为当今蛋白药物研发的重点方向[4].治疗性应用通常需要缓慢的药物清除速率,以避免高剂量和频繁给药对病人带来的生理上的病痛及经济上的负担.目前已经开发出各种方法来延长这些小分子蛋白在体内的血浆半衰期.例如将聚乙二醇链与小分子蛋白进行化学偶联,通过增大表观分子量来提高其半衰期[5,6].另一种改善小蛋白药代动力学的方法是将蛋白质与人血清白蛋白(Human Serum Albumin,HSA)进行基因融合[7,8].融合后的重组蛋白分子量显著增大,减少了肾小球的滤过作用.此外,当白蛋白被溶酶体吞噬时,由于新生儿Fc受体(FcRn)介导的再循环机制使其避免被降解的命运,进一步延长了融合蛋白的血浆半衰期[9].目前HSA已成功地用于产生融合蛋白,例如与激素(胰岛素、人类生长激素)[10,11]和细胞因子(干扰素-α、干扰素-β、IL-2)[12−14]结合,以调节药代动力学特性,从而提高这些分子的治疗效果.小分子蛋白药物与白蛋白结合肽或结合域的基因融合是白蛋白基因融合的另一种选择[15].来源于链球菌G蛋白的白蛋白结构域(Albumin Binding Domains,ABD)能够与HSA紧密结合,改造后的ABD与HSA的亲和力可达飞摩尔级[16],短寿命的小分子蛋白通过与ABD进行基因融合,能够显著增强其半衰期.
CD47也称整合素相关蛋白(integrin-associated protein,IAP),是一种细胞膜表面广泛表达的五跨膜受体,属于免疫球蛋白超家族.CD47与巨噬细胞表面的SIRPα结合,激活酪氨酸磷酸化酶,抑制肌球蛋白在巨噬细胞突触膜下装配位点的聚集,发出“别吃我”的信号,可以促使肿瘤细胞逃避巨噬细胞的吞噬作用[17,18].目前已有大量研究表明CD47抗体对不同种的肿瘤细胞具有抑制作用,例如肝癌细胞系[19]、乳腺癌细胞系[20,21]、卵巢癌细胞系[22]、非霍奇金淋巴瘤细胞系[23]等.因此,可以预期CD47是一个新的、有前景的抗肿瘤靶点,在肿瘤免疫中的研究具有广泛的前景.
当前,靶向CD47的抗体治疗在多种肿瘤动物实验中取得了令人鼓舞的效果[24,25].我们在前期实验中,制备获得了抗CD47纳米抗体(另文报道),但由于该纳米抗体体内半衰期短,不利于其体内应用.在本研究中,我们采用分子克隆手段,将抗CD47纳米抗体与白蛋白结合域进行基因融合,获得CD47-ABD融合蛋白,以期望其在具有本身生物活性的同时提高血浆半衰期,为解决纳米抗体代谢时间短的问题提供一种有效的解决方案.
1 材料与方法
1.1 实验材料
限制性内切酶(NcoI,XhoI)购自TaKaRa公司;重组子测序由生工生物工程(上海)公司完成;Plasmid mini kit质粒抽提试剂盒购自天根生化科技(北京)有限公司;CD47重组蛋白购自北京义翘神州生物技术有限公司;抗His-tag兔多克隆抗体购自武汉伊莱瑞特生物科技股份有限公司;抗HA-tag鼠单克隆抗体,辣根过氧化物酶标记的山羊抗鼠IgG、山羊抗兔IgG ,感受态大肠杆菌DH5α/BL21(DE3)均购自北京全式金生物技术有限公司;ECL发光试剂盒来自碧云天公司;清洁级ICR雌性小鼠购于新疆医科大学;抗CD47纳米抗体表达载体pET22b-3D3-2为本实验室保存.
1.2 融合ABD的CD47纳米抗体3D3-2-ABD的克隆及表达纯化
根据参考文献[26]获得ABD氨基酸序列,设计并合成3D3-2-ABD原核表达载体.ABD被设计融合至3D3-2的C末端,并且在ABD的C末端设计添加HA-tag便于后续检测.重组表达载体pET22b-3D3-2-ABD交由南京金斯瑞生物科技有限公司合成.
从转化pET22b-3D3-2-ABD的菌株提取质粒,使用限制性内切酶NcoI 与XhoI 进行双酶切验证.将验证正确的质粒转化入感受态大肠杆菌BL21(DE3)中,随机挑取单克隆37 ℃振荡培养至OD600达到0.6~0.8时,加入IPTG 至终浓度为0.1 mmol/L,放置摇床上30 ℃、220 r/min 诱导培养4 h.分别取1 mL诱导前后的菌液离心收集沉淀重悬在1 X PBS中,加5 ×上样缓冲液煮沸10 min,高速离心10 min后进行SDS-PAGE 凝胶电泳,考马斯亮蓝染色检测融合蛋白的表达.挑选高表达量的克隆菌株扩大培养,150 r/min,30 ℃恒温过夜诱导培养.诱导表达后的菌液离心去除上清,1×PBS 洗涤后将所得菌体沉淀采用反复冻融及渗透休克法处理后收集上清液.上清液用0.45 μm 滤器过滤除杂后,使用Ni离子凝胶亲和柱纯化.收集各组分流出液,并用SDS-PAGE检测纯化后的蛋白质.3D3-2蛋白纯化操作同上.
1.3 Western blot验证纯化的3D3-2/3D3-2-ABD蛋白
将纯化后的蛋白样品经SDS-PAGE 电泳后,90 V恒压转移至PVDF膜上.将PVDF膜用含5%脱脂奶粉的PBST(pH 7.4)于4 ℃封闭过夜.PBST 洗膜3次后,分别加入抗His-tag兔多克隆抗体( 1∶10 000稀释),抗HAtag鼠单克隆抗体( 1∶3 000稀释),37 ℃孵育2 h.PBST 洗膜3次,分别加入HRP标记的羊抗兔及羊抗鼠二抗( 1∶3 000稀释),37 ℃孵育1 h.PBST 洗膜5次,用增强型ECL底物显色试剂盒显色.
1.4 ELISA检测3D3-2-ABD与CD47及HSA的结合
采用间接ELISA 方法对3D3-2/3D3-2-ABD 与CD47 抗原的结合亲和力进行检测,检测方法如下:将抗原rhCD47以1 μg/mL的浓度在96孔板中4 ℃包被过夜.用含5%脱脂奶粉的PBS于37 ℃封闭2 h.PBST 洗板3次后分别加入不同浓度的3D3-2及3D3-2-ABD纯化蛋白作为一抗,37 ℃孵育2 h.PBST 洗板3次后加入抗HA-tag鼠单克隆抗体( 1∶3 000稀释)作为二抗37 ℃孵育1 h.PBST 洗板3次后加入HRP标记的羊抗鼠三抗(1∶5 000稀释),37 ℃孵育1 h,PBST洗板6次后加入100 μL TMB 显色液避光显色5~15 min.加入50 μL 2 mol硫酸终止反应,酶标仪检测OD450的吸光值.
为验证3D3-2-ABD与HSA 的结合能力,采用间接ELISA法进行检测.检测方法如下:将HSA 以1 μg/mL的浓度4 ℃包被过夜.用含5%脱脂奶粉的PBS于37 ℃封闭2 h.PBST洗板3次后加入不同浓度的3D3-2-ABD蛋白,37 ℃孵育2 h.PBST洗板3次后加入抗HA-tag鼠单克隆抗体( 1∶3 000稀释)于37 ℃孵育1 h.PBST洗板3次后加入羊抗鼠-HRP(1∶5 000稀释),37 ℃孵育1 h.PBST洗板6次后加入100 μL TMB 显色液避光显色5~15 min后加入50 μL 2 mol 硫酸终止反应.酶标仪检测OD450的吸光值.
1.5 融合蛋白标准曲线的建立
采用双抗夹心ELISA的方法制作融合蛋白的标准曲线.使用抗HA-tag鼠单克隆抗体(1∶3 000稀释)作为捕获抗体,于4 ℃包被过夜.用5%脱脂奶粉于37 ℃封闭2 h.PBST洗板3次后分别加入100 μL不同浓度(125、62.5、32、16、8、0 ng/μL)的3D3-2与3D3-2-ABD蛋白稀释液,37 ℃孵育2 h.PBST洗板3次,加入检测抗体抗His-tag兔多克隆抗体(1∶20 000稀释),37 ℃孵育1 h.PBST洗板3次后加入羊抗兔-HRP(1∶5 000 稀释),37 ℃孵育1 h.PBST洗板6次后加入100 μL TMB显色液避光显色5~15 min后加入50 μL 2 mol硫酸终止反应.酶标仪检测OD450的吸光值.以3D3-2/3D3-2-ABD融合蛋白浓度为自变量,OD450值为因变量,使用Excel制作融合蛋白的标准曲线.
1.6 3D3-2/3D3-2-ABD 的体内代谢半衰期测定
取6只ICR雌性小鼠(30~35 g)随机平均分为两组,分别单次尾静脉注射100 μg的3D3-2与3D3-2-ABD融合蛋白.在注射后的3,10,30,60,120,360 min 与6 d(3D3-2蛋白)及3,10,30,60,120,360 min,24 h 与6 d(3D3-2-ABD融合蛋白)对小鼠进行眼眶取血并分离血清.所得血清样本稀释100倍后,采用双抗夹心ELISA的方法检测血清中融合蛋白的浓度.血浆消除半衰期使药物在体内达到平衡后,血浆药物浓度消除一半所需的时间.根据一级消除动力学消除时量曲线:t=(lnC0−lnC)/k,使用Excel计算出药动学相关参数.
2 结果与分析
2.1 融合蛋白3D3-2-ABD表达载体的构建及诱导表达
重组表达载体pET22b-3D3-2-ABD的构建策略及ABD氨基酸序列如图1(A)所示.通过柔性连接linker将3D3-2及ABD进行基因融合,采用分子克隆技术进行构建.将获得的DH5α-pET22b-3D3-2-ABD菌液进行质粒提取,使用限制性内切酶NcoI与XhoI对提取的质粒进行双酶切鉴定,结果见图1(B).琼脂糖凝胶电泳结果显示,双酶切后的质粒显示出明显的两条条带.分子量大小约为5 000 bp的条带为pET22b载体条带,而另一条分子量大小约为600 bp的条带为3D3-2-ABD片段条带.
随机挑取转化后的BL21-pET22b-3D3-2-ABD菌落并进行小量诱导表达检测,SDS-PAGE鉴定结果如图1(C)所示.诱导后的菌液样本在约27 kDa大小处出现一条明显的蛋白条带,其分子量大小与目的蛋白3D3-2-ABD的大小相符,该蛋白被成功诱导表达.

图1 融合蛋白3D3-2-ABD表达载体的构建及诱导表达Fig 1 Construction and induction of fusion protein 3D3-2-ABD expression vector
2.2 融合蛋白3D3-2/3D3-2-ABD 的亲和纯化及Western blot验证
挑取表达量高的菌株进行大量诱导并纯化,将纯化后的蛋白进行SDS-PAGE电泳检测,蛋白胶经考马斯亮蓝染色后显示,分别在20 kD(3D3-2)及27 kDa(3D3-2-ABD)处出现与预期大小相符的条带,结果见图2(A).通过BCA蛋白定量法最终测得2 mg 的3D3-2 蛋白及2.2 mg 的3D3-2-ABD 纯化蛋白.两种融合蛋白的产率有所不同,3D3-2蛋白产率为7.5 mg/L,3D3-2-ABD蛋白产率为5.5 mg/L.之后对纯化的蛋白进行Western blot检测.因为3D3-2及3D3-2-ABD蛋白皆带有HA-tag与His-tag标签,因此WB检测时分别使用Anti-HA(图2(B)上半部分)及Anti-His(图2(B)下半部分)的检测抗体对纯化的蛋白进行检测.纯化后的蛋白皆能被两种抗体检测到,进一步表明纯化所得蛋白为目的蛋白.

图2 融合蛋白3D3-2/3D3-2-ABD 的亲和纯化(A)及Western blot(B)验证Fig 2 Affinity purification(A)and Western blot(B)verification of fusion protein 3D3-2/3D3-2-ABD
2.3 融合蛋白3D3-2-ABD与抗原结合活性
使用间接ELISA的方法检测融合蛋白3D3-2及3D3-2-ABD与抗原CD47的结合活性.结果显示,3D3-2与3D3-2-ABD都能够与抗原CD47结合,见图3.3D3-2及3D3-2-ABD 与抗原的结合程度随着蛋白浓度的增加而增强,改造后的融合蛋白3D3-2-ABD与抗原的结合性较3D3-2相比有所下降.

图3 3D3-2/3D3-2-ABD与rhCD47的结合活性测定Fig 3 Binding activity of 3D3-2/3D3-2-ABD and rhCD47
2.4 3D3-2-ABD与HSA的结合活性检测结果
采用间接ELISA的方法检测3D3-2-ABD与HSA的结合活性,结果见图4.二者的结合强度随3D3-2-ABD浓度的增加而增强,且在HSA包被浓度为1 μg/mL,3D3-2-ABD浓度为5 μg/mL时二者结合达到饱和.

图4 3D3-2-ABD与HSA结合活性检测结果Fig 4 Binding activity of 3D3-2-ABD and HSA
2.5 融合蛋白3D3-2/3D3-2-ABD血浆半衰期检测的结果
对两组小鼠分别尾静脉注射相同剂量的3D3-2及3D3-2-ABD融合蛋白,通过ELISA测定不同时间点获取的血清样品中融合蛋白的浓度.如图5所示,3D3-2蛋白在血液中快速清除,其终末半衰期(t1/2)为35.82 min.而3D3-2-ABD融合蛋白的代谢时间显著延长,其终末半衰期为501.52 min,半衰期提升了约14倍.
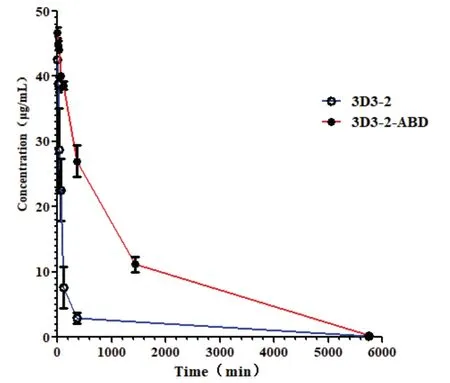
图5 不同时间点血清中融合蛋白的浓度Fig 5 Concentration of fusion protein in serum at different time points
3 讨 论
纳米抗体独特的结构使它具有不同于常规抗体的优点:独特的抗体决定簇能够识别全长抗体难以识别的表位,分子质量小、免疫原性弱、抗原结合能力及组织穿透力强等.虽然小分子的尺寸使得纳米抗体的组织穿透能力优于一般的常规抗体,但也不可避免的带来了因为尺寸小而在生物体内清除速率快的弊端.在临床上为了达到治疗效果,必须高频率或高剂量给药,这不仅给病人带来身体上的痛苦和经济上的负担,频繁的给药更会导致免疫原性问题.因此,通过蛋白质工程技术优化蛋白结构、化学修饰、基因融合等手段,提高蛋白药物的体内半衰期,已成为当今蛋白药物研发的重点方向.
蛋白融合技术主要通过DNA重组技术,从基因水平改变原蛋白的基因序列,从而改变其生物功能,同时通过增加相对分子质量降低肾清除率,以延长融合蛋白的半衰期.与PEG化学修饰的方法相比,蛋白融合技术操作更加简便、灵活且高效.由于不需要进行化学修饰,产物均一易于纯化,质量控制也相对容易[27],大大减少了人工及时间成本.
HSA是人体血浆的主要成分之一(含量达40 g/L),其体内半衰期长达19 d.将HSA作为融合伴侣,将其连接到半衰期较短的蛋白类药物上,是研发长效蛋白药物的重要途径之一[28].然而HSA分子量较大(66 kDa),将其与纳米抗体融合极大地增加了纳米抗体的尺寸,这必然会导致纳米抗体失去其小尺寸所具有的独特优势.一种来源于链球菌蛋白G的白蛋白结合域可以与多种物种的血清白蛋白紧密结合,如HSA.因此,选择该结构域作为融合伴侣,同样可以提高短寿命蛋白的半衰期.Guo Rui[29]等人通过将该结合域与免疫毒素融合,使得融合蛋白的半衰期从原本的13.5 min延长至330.8 min,提高了约24.4倍的时长.基于此基础,本实验设计并开发了一种融合了白蛋白结合域的CD47纳米抗体原核表达载体,并在大肠杆菌BL21(DE3)中以可溶性蛋白形式在细胞上清液中大量表达.通过Ni+亲和柱纯化,获得了较高纯度及产率(5.5 mg/L)的CD47-ABD融合蛋白.并成功的使其半衰期从原本的35.82 min延长至了501.52 min,相当于约14倍的延长,血浆半衰期得到了极大的改善.与未改造前的CD47纳米抗体相比,CD47-ABD与CD47抗原的结合活性稍有下降,这可能是由于ABD结构域的引入导致融合蛋白在空间结构上发生了改变,从而出现纳米抗体上与抗原结合的位点被遮蔽的现象,导致融合蛋白的抗原结合活性受到了一定程度的影响.虽然融合蛋白的抗原结合活性与改造前相比在低剂量时稍有下降,但在高剂量时二者结合活性趋于相似,可以达到相似的治疗效果.CD47-ABD融合蛋白同时拥有CD47及HSA两个抗原结合位点,相当于一个双特异抗体,其为研究双特异抗体在抗肿瘤作用及延长半衰期作用相关问题上提供了一种新的思路.

