298.2 K四元体系MgCl2-SrCl2-AlCl3-H2O相平衡实验及溶解度计算
郑秋风,罗军,陈帅,陈念粗,于旭东,2,曾英,2
(1 成都理工大学材料与化学化工学院,四川成都610059; 2 四川省攀西战略矿产资源综合利用协同创新中心,四川 成都610059)
引 言
锶是碱土金属(除铍外)中丰度最小的元素,在自然界以化合态存在,多赋存于天青石(SrSO4)和菱锶矿(SrCO3)中。我国锶储量位居世界前三,但锶矿品位较低,锶与钙、钡等伴生矿物的性质相似,增加了提炼难度[1]。我国碳酸锶多采用碳还原法进行生产,虽工艺简单、成本较低,但锶的利用率低于75%,每生产1 t 碳酸锶约产生2.5 t 左右的废渣,造成大量锶资源的浪费。若能将含锶废渣中的锶进行回收再利用,不仅能解决环境污染问题,还有利于提高锶资源的利用率[2]。碳酸锶废渣含锶成分多为酸溶性锶、钙、镁、铝等化合物,加入HCl 或NH4Cl浸取剂,形成了含铵、锶、镁、铝、钙等多离子共存的氯化物型浸取液,对应的多离子共存体系可概括为六元体系NH4Cl-MgCl2-CaCl2-SrCl2-AlCl3-H2O。利用共存体系中各盐的溶解度差异,通过蒸发、结晶等一系列相分离技术,可使锶以氯化锶的形式从废渣浸取液中分离出来。上述过程中涉及盐类的动态溶解、结晶,即固-液相平衡过程。相平衡与相图对于多离子共存复杂水盐体系中盐类的分离提取具有重要指导作用[3-6]。
现有文献中,已有关于复杂六元体系NH4Cl-MgCl2-CaCl2-SrCl2-AlCl3-H2O 相关子体系相平衡研究的报道,如三元体系NH4Cl-SrCl2-H2O 298.2 K[7],NH4Cl-CaCl2-H2O 273.2、298.2、323.2、348.2 K[8-10],NH4Cl-MgCl2-H2O 273.2、298.2 K[11-12],CaCl2-AlCl3-H2O 298.2、308.2 K[13-14],CaCl2-SrCl2-H2O 288.2、298.2、373.2 K[15-18];四 元 体 系NH4Cl-MgCl2-SrCl2-H2O 298.2 K[19],NH4Cl-MgCl2-AlCl3-H2O 283.2 ~363.2 K[20],NH4Cl-CaCl2-AlCl3-H2O 298.2 K[21]。已有研究发现,铵镁共存时有复盐NH4Cl·MgCl2·6H2O 生成,锶钙共存时有固溶体[(Sr, Ca)Cl2]·6H2O 和[(Ca,Sr)Cl2]·6H2O 生成,铵钙共存氯化物体系中复盐2NH4Cl·CaCl2·3H2O 是否生成与研究温度有关。四元体系MgCl2-SrCl2-AlCl3-H2O 是六元复杂体系中的一个重要子体系,包含3 个三元子体系:MgCl2-SrCl2-H2O[22]、 MgCl2-AlCl3-H2O[23]、 SrCl2-AlCl3-H2O[23],本课题组已完成了上述3 个三元子体系298.2 K 相平衡研究[22-23]。研究结果表明,除MgCl2-SrCl2-H2O 体系外,其他两个三元子体系均为简单三元体系,锶镁共存时,氯化锶结晶形式受镁离子影响存在两 种 结晶形式:SrCl2·6H2O 和SrCl2·2H2O。因此,在前期研究基础上,本文采用等温溶解平衡法开展了298.2 K 下四元体系MgCl2-SrCl2-AlCl3-H2O 的相平衡研究,测定了该体系298.2 K 下的溶解度数据以及平衡溶液的密度、折射率,同时采用Pitzer 模型进行了298.2 K 四元体系MgCl2-SrCl2-AlCl3-H2O溶解度计算。
1 实验材料和方法
1.1 实验试剂与仪器
主 要 试 剂:MgCl2·6H2O、SrCl2·6H2O 和AlCl3·6H2O(纯度≥99.0%,成都市科隆化学品有限公司);AgNO3(纯度≥99.0%,国药集团化学试剂有限公司);锶、镁、铝单元素标准溶液来源于国家有色金属及电子材料分析测试中心;实验室用水均为去离子水(κ ≤5.5-6S·m-1)。
主要仪器:Practum224-1CN 型电子分析天平(Sartorius 科学仪器(北京)有限公司);HH-601A 高精度超级恒温水浴(常州市金坛友联仪器研究所);HZS-HA 型水浴振荡器(哈尔滨市东联电子技术开发有限公司);WYA 型阿贝折射仪(上海仪电物理光学仪器公司);iCE-3300 型AAS 火焰原子吸收光谱仪(赛默飞世尔科技(中国)有限公司);Agilent 5100型ICP-OES(安捷伦科技(中国)有限公司);DX-2700 型X-ray衍射仪(丹东方圆仪器有限公司)。
1.2 实验方法
采用等温溶解平衡法开展298.2 K 四元体系MgCl2-SrCl2-AlCl3-H2O 相平衡研究。即在硬质玻璃瓶中配制三元体系共饱点溶液,按照一定梯度向溶液中逐渐加入第三种新盐。将配制好试液的硬质玻璃瓶置于恒温水浴振荡器中,不断振荡以达到平衡。持续振荡3周后,定期取上层清液进行分析,以其组成不变时作为达到平衡的标志。待溶液达到平衡后(平衡时间约30 d),静置48 h,将试样进行固液分离,分析平衡溶液组成,同时测定平衡溶液的密度和折射率,平衡固相采用X-ray 粉晶衍射法进行鉴定。
1.3 分析方法
Cl-采用AgNO3容量法测定[24];Mg2+、Sr2+采用火焰原子吸收法测定[25-26];Al3+采用电感耦合等离子体发射光谱法测定[27]。平行测定三次,取平均值为最后实验值。平衡溶液密度测定采用称量瓶法,折射率采用阿贝折射仪(测定前使用去离子水进行校正,并配以HH-601A 高精度超级恒温水浴控温)测定。
2 实验结果与讨论
实验测定的298.2 K 四元体系MgCl2-SrCl2-AlCl3-H2O 的溶解度数据列于表1,溶解度采用质量分 数w(B)和Jänecke index J(B) (g/100 g salt) (B =MgCl2, SrCl2, AlCl3, H2O)表示,Jänecke index 计算方法参见文献[21]。
2.1 四元体系MgCl2-SrCl2-AlCl3-H2O 空间立体图
根据表1 共饱点数据和该四元体系相关的三元、二元子体系共饱点数据[22-23],绘制了298.2 K 下四元体系MgCl2-SrCl2-AlCl3-H2O 的空间立体图,见图1。
图1中,正三棱柱的点线面所代表的意义如下:3 条侧棱柱分别代表3 个二元体系:MgCl2- H2O、SrCl2-H2O、AlCl3-H2O;3个侧面分别表示3个三元体 系:MgCl2-SrCl2-H2O、MgCl2-AlCl3-H2O、SrCl2-AlCl3-H2O;底面三角形为MgCl2-SrCl2-AlCl3体系的干基三角相图;三棱柱内部的点为四元体系的系统点。
2.2 四元体系MgCl2-SrCl2-AlCl3-H2O干基相图
为更加直观反映体系中盐与盐之间的作用关系,采用由顶向底面投影,以J(SrCl2)为横坐标,J(MgCl2)为纵坐标,绘制了298.2 K 下四元体系MgCl2-SrCl2-AlCl3-H2O的干基图,即稳定相图,见图2。
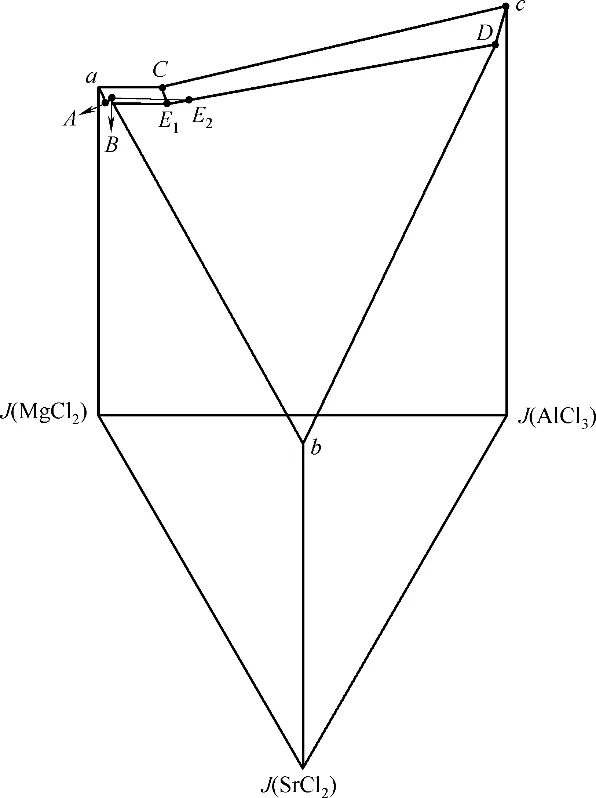
图1 四元体系MgCl2-SrCl2-AlCl3-H2O 298.2 K空间立体图Fig.1 The space diagram of the quaternary system MgCl2-SrCl2-AlCl3-H2O at 298.2 K
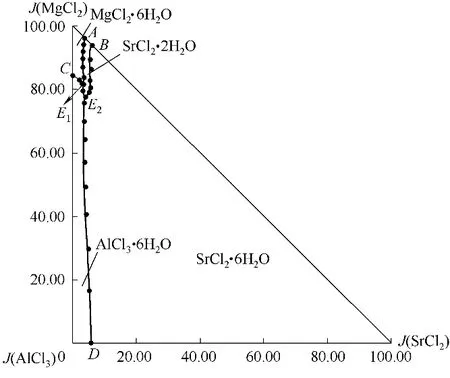
图2 四元体系MgCl2-SrCl2-AlCl3-H2O 298.2 K稳定相图Fig.2 Phase diagram of the quaternary system MgCl2-SrCl2-AlCl3-H2O at 298.2 K
由图2 可知,该体系相图由2 个共饱点,5 条单变量曲线和4 个单盐结晶区组成,无复盐和固溶体生成。2 个四元共饱点E1、E2,分别对应三个平衡固相和一个平衡液相。共饱点E1溶液组成为:
w(MgCl2) = 29.49%,w(SrCl2) = 1.32%,w(AlCl3) =5.47%,w(H2O) = 63.72%;经X - ray 粉晶衍射分析(图3)确定其平衡固相盐由三种水合盐MgCl2·6H2O(JCPDS No: 25-0515)、SrCl2·2H2O (JCPDS No: 25-0891)和AlCl3·6H2O (JCPDS No:73-0301)组成;共饱点E2溶液组成为:w(MgCl2) = 27.36%,w(SrCl2) =1.39%,w(AlCl3) = 7.28%,w(H2O) = 63.97%;经X -ray 粉晶衍射分析(图4)确定其平衡固相盐由三种水合 盐SrCl2·6H2O (JCPDS No: 06-0073)、SrCl2·2H2O(JCPDS No: 25-0891)和AlCl3·6H2O (JCPDS No: 73-0301)组成。
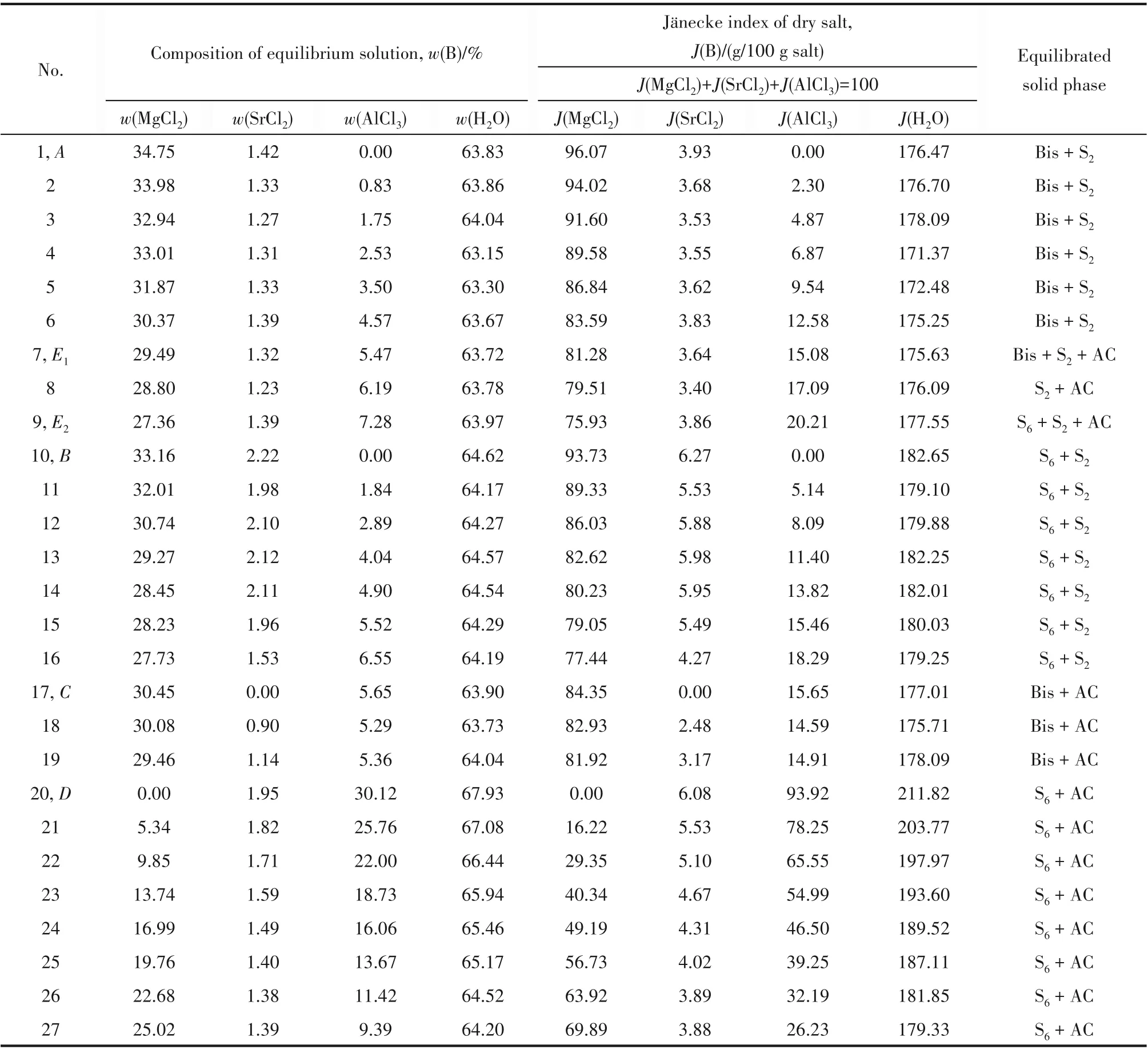
表1 四元体系MgCl2-SrCl2-AlCl3-H2O 298.2 K固液平衡组成Table 1 The composition of the quaternary system MgCl2-SrCl2-AlCl3-H2O at 298.2 K
根据相称共饱点和不相称共饱点判定法则[28],对本体系四元共饱点类型进行分类:共饱点E1对应的平衡固相盐为MgCl2·6H2O、SrCl2·2H2O 和AlCl3·6H2O,E1位于这三种盐所构成的三角形内,因此E1为相称共饱点;共饱点E2对应的平衡固相盐为SrCl2·6H2O、SrCl2·2H2O 和AlCl3·6H2O,共饱点对应的三种盐构成的三角形退化为一条直线,故E2为不相称共饱点。
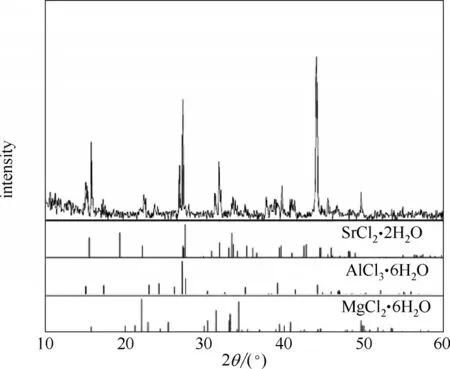
图3 共饱点E1处平衡固相XRD谱图Fig.3 XRD pattern of the invariant point E1
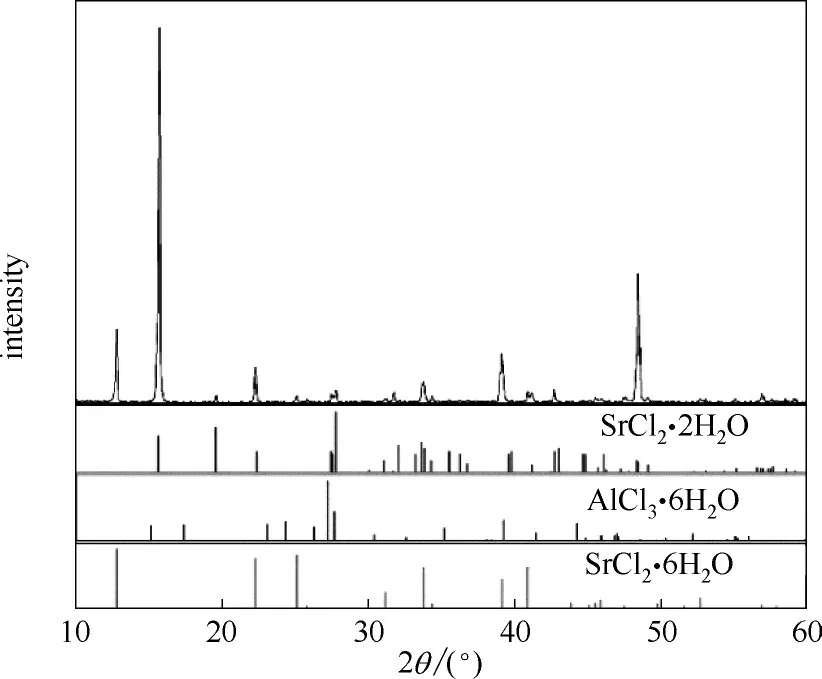
图4 共饱点E2处平衡固相XRD谱图Fig.4 XRD pattern of the invariant point E2
温度和共存离子对结晶水合物的结晶水数量会产生影响。前人研究表明[29],254.25 K <T <334.45 K 时,氯化锶结晶形式为SrCl2·6H2O;334.45 K <T <503.15 K时,氯化锶结晶形式为SrCl2·2H2O。本研究中,在298.2 K 时,氯化锶同时出现SrCl2·6H2O 和SrCl2·2H2O 的结晶形式。相同的实验现象在298.2 K 四元体系LiCl-NaCl-SrCl2-H2O 和LiCl-KCl-SrCl2-H2O 相平衡研究[30]中也有发现。分析可知,298.2 K 时,当氯化锶与氯化钠或氯化钾共存时,氯化锶仅以SrCl2·6H2O 形式存在;而当体系中引入水合作用较强的LiCl·H2O 或MgCl2·6H2O 后,氯化锶同时出现SrCl2·6H2O 和SrCl2·2H2O 的结晶形式。
5 条单变量曲线为AE1、CE1、BE2、DE2和E1E2,即二 固 一 液 共 饱 和 曲 线。AE1:MgCl2·6H2O + SrCl2·2H2O;CE1:MgCl2·6H2O + AlCl3·6H2O;BE2:SrCl2·6H2O + SrCl2·2H2O;DE2:SrCl2·6H2O + AlCl3·6H2O;E1E2:SrCl2·2H2O+AlCl3·6H2O;
4 个结晶相区分别为:MgCl2·6H2O、SrCl2·6H2O、SrCl2·2H2O 和AlCl3·6H2O。结晶区面积按照SrCl2·6H2O、AlCl3·6H2O、MgCl2·6H2O、SrCl2·2H2O 顺序依次递减,SrCl2·6H2O 结晶区最大,表明其在该体系中最易结晶析出。
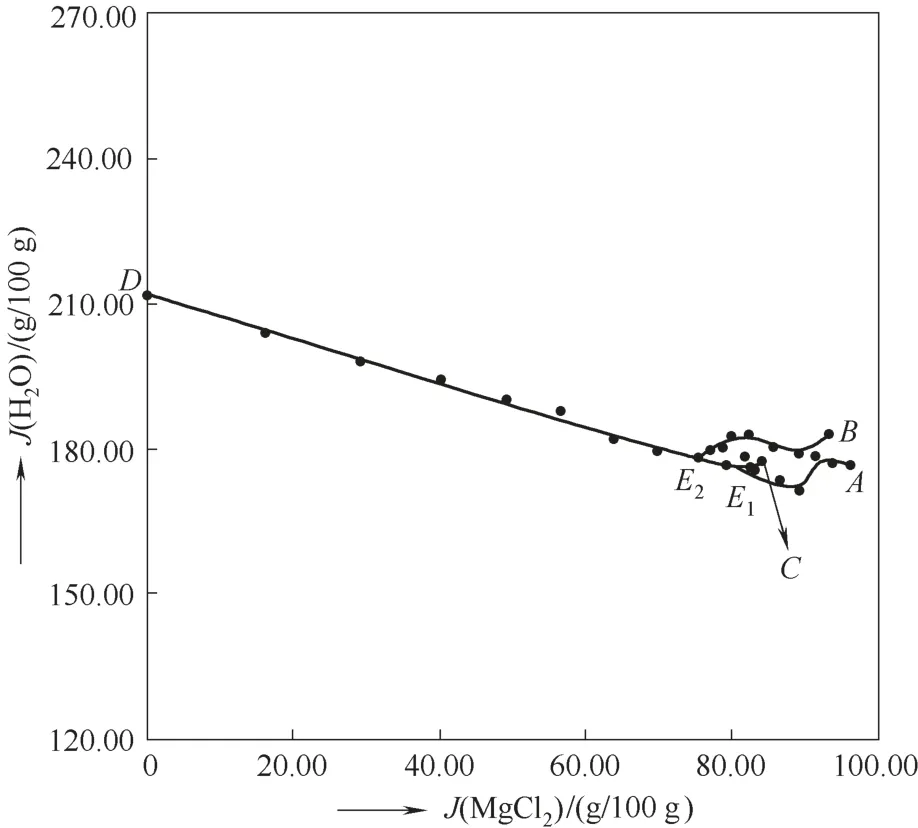
图5 四元体系MgCl2-SrCl2-AlCl3-H2O 298.2 K水含量组成图Fig.5 Water content diagram of the quaternary system MgCl2-SrCl2-AlCl3-H2O at 298.2 K
2.3 四元体系MgCl2-SrCl2-AlCl3-H2O 水含量-组成图
以J(MgCl2)为横坐标,以J(H2O)为纵坐标绘制了该体系的水含量组成图(图5),由图5可知,在单变量曲线DE2、E1E2上,随着J(MgCl2)的增大,J(H2O)呈下降趋势,这是由于MgCl2的引入使得AlCl3·6H2O大量析出,因而体系中水含量减小;在单变量曲线AE1、CE1上,随着J(MgCl2)的增大,J(H2O)先减小,后增大。
2.4 四元体系MgCl2-SrCl2-AlCl3-H2O 物化性质与组成分析
四元体系MgCl2-SrCl2-AlCl3-H2O 298.2 K 密度、折射率数据见表2。
根据表2实验数据,绘制了相应的密度-组成图(图6)和折射率-组成图(图7)。由图6 可知:在单变量曲线DE2和CE1上,平衡液相的密度随着J(MgCl2)增加而变大;在单变量曲线BE2、E1E2上,随着J(MgCl2)的增加平衡液相的密度减小;在单变量曲线AE1上,随着J(MgCl2)的增加,平衡液相的密度先增加后减小。由图7 可知:除单变量曲线DE2外,其余单变量曲线上平衡液相折射率变化趋势和密度的变化趋势保持一致。
3 溶解度计算
Pitzer模型因其结构紧凑简洁,同时考虑到溶液中两离子间的长程静电位能、短程硬心效应位能和三离子间的相互作用能,已应用于部分海水体系和盐湖卤水体系[31-32]的溶解度计算。本文采用Pitzer模型对四元体系MgCl2-SrCl2-AlCl3-H2O 298.2 K 时溶解度进行计算,具体方法参见文献[33-35]。
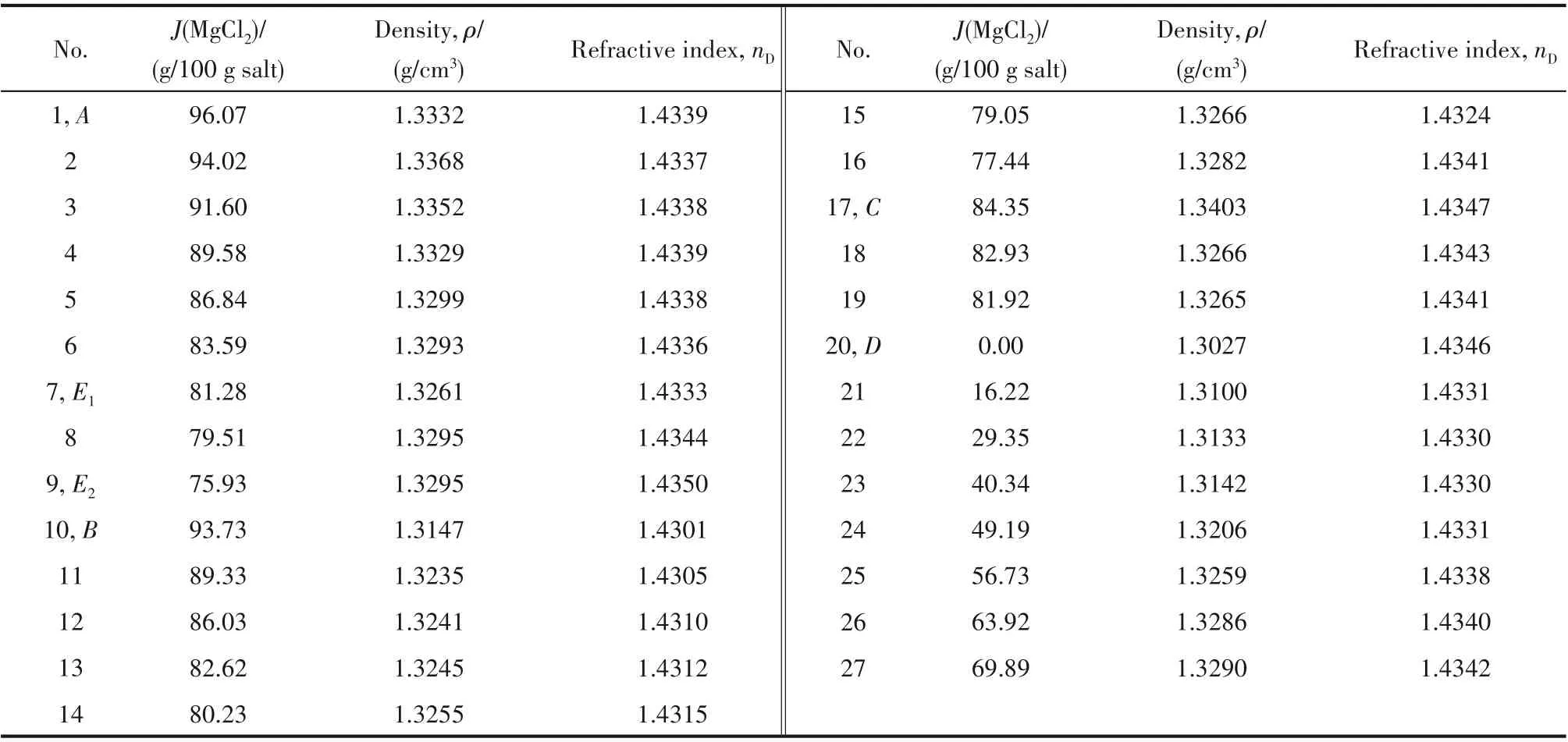
表2 四元体系MgCl2-SrCl2-AlCl3-H2O 298.2 K密度ρ、折射率nD数据Table 2 The density(ρ)and refractive index(nD)of the quaternary system MgCl2-SrCl2-AlCl3-H2O at 298.2 K

图6 四元体系MgCl2-SrCl2-AlCl3-H2O 298.2 K密度-组成图Fig.6 Density-composition diagram of the quaternary system MgCl2-SrCl2-AlCl3-H2O at 298.2 K
根据Pitzer 模型计算得到电解质溶液的渗透系数及活度系数,再由式(1)~式(5)计算出各盐溶度积常数。
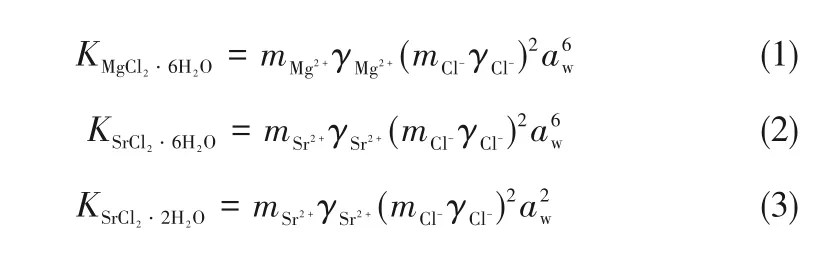

图7 四元体系MgCl2-SrCl2-AlCl3-H2O 298.2 K折射率-组成图Fig.7 Refractive index-composition diagram of the quaternary system MgCl2-SrCl2-AlCl3-H2O at 298.2 K
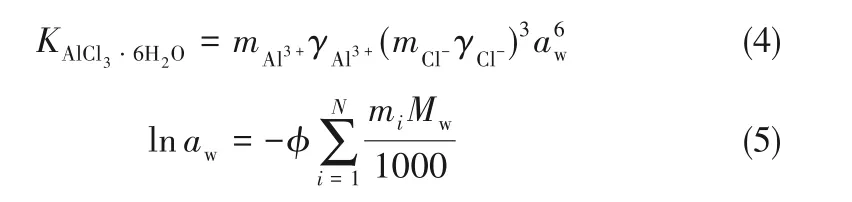
式中,K 为盐的溶度积常数;m 为不同离子的浓度;γ 为溶液中离子的活度系数;N 为离子组分数;Mw为水的分子量;aw为水的活度。
根据Greenberg 等[36]给出的温度关联式计算得到298.2 K 时德拜-休克尔(Debye-Hückel)常数Aφ为0.3915。计算所需的MgCl2、SrCl2和AlCl3的Pitzer 单盐 参 数β(0)、β(1)和Cφ列 于 表3。298.2 K 四 元 体 系MgCl2-SrCl2-AlCl3-H2O 溶解度计算所需的Pitzer 离子 相 互 作 用 参 数θ 和ψ,其 中θSr,Mg、ψSr,Mg,Cl、θSr,Al、ψSr,Al,Cl采用课题组已报道的参数值[23];现有文献中报道的θMg,Al、ψMg,Al,Cl参数用于MgCl2-AlCl3-H2O 三元体系溶解度计算时,计算值与实验值间存在一定偏差。因而,结合课题组前期测定得到的三元体系MgCl2-AlCl3-H2O 298.2 K[23]共饱点数据,采用Pitzer模型重新对θMg,Al、ψMg,Al,Cl进行了拟合,相应的θ 和ψ值列于表4。溶解度计算所需的298.2 K 时MgCl2·6H2O、AlCl3·6H2O、SrCl2·6H2O 和SrCl2·2H2O 的溶度积常数lnKsp列于表5。
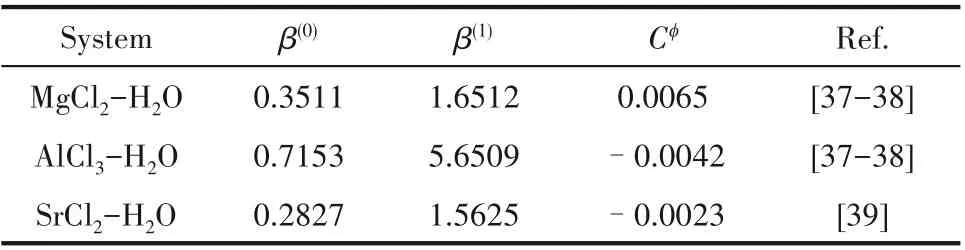
表3 二元体系MgCl2-H2O、SrCl2-H2O和AlCl3-H2O 298.2 K单盐参数Table 3 Pitzer single-salt parameters of the systems MgCl2-H2O,SrCl2-H2O and AlCl3-H2O at 298.2 K
根据表3~表5 中所列参数,采用Pitzer 模型,对298.2 K 时 四 元 体 系MgCl2-SrCl2-AlCl3-H2O 的 溶 解度进行计算并换算成Jänecke index,列于表6。根据表1和表6数据绘制了计算与实验对比相图(图8)。
由图8可知,溶解度计算值与实验值基本吻合,在该体系三元共饱点A、B、C、D 和四元共饱点E1处计算值与实验值间吻合较好,说明选取的Pitzer 参数具有一定的可靠性;在该体系四元共饱点E2处计算值与实验值存在一定偏差,造成这种偏差的原因可能是由于该四元体系中MgCl2浓度较高时,会使得SrCl2·6H2O 转变为SrCl2·2H2O,带来更加复杂的离子作用关系,同时本文计算所涉及的SrCl2·2H2O 溶度积常数来自于文献值,可能存在一定的偏差,因而使得溶解度计算在E2点附近出现偏差。

表4 四元体系MgCl2-SrCl2-AlCl3-H2O 298.2 K混合离子作用参数Table 4 Pitzer mixing ion-interaction parameters of the system MgCl2-SrCl2-AlCl3-H2O at 298.2 K

表5 四元体系MgCl2-SrCl2-AlCl3-H2O 298.2 K中各盐溶度积常数(lnKsp)Table 5 Solubility product parameters(lnKsp)of the quaternary system MgCl2-SrCl2-AlCl3-H2O at 298.2 K
4 结 论
本文采用等温平衡溶解法研究了四元体系MgCl2-SrCl2-AlCl3-H2O 298.2 K 稳定相平衡关系,根据实验数据绘制了该体系的稳定相图,取得如下主要结论。

表6 四元体系MgCl2-SrCl2-AlCl3-H2O 298.2 K溶解度计算值Table 6 Calculated solubility of quaternary system MgCl2-SrCl2-AlCl3-H2O at 298.2 K
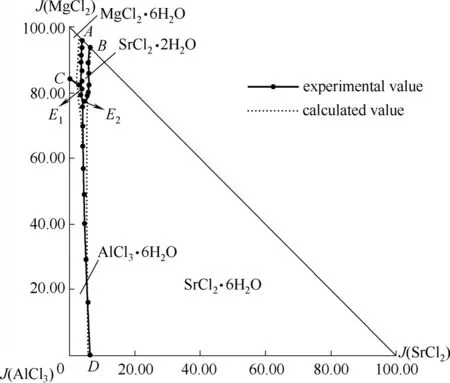
图8 四元体系MgCl2-SrCl2-AlCl3-H2O 298.2 K计算与实验相图Fig.8 Calculated and experimental phase diagrams of the quaternary system MgCl2-SrCl2-AlCl3-H2O at 298.2 K
(1)四元体系MgCl2-SrCl2-AlCl3-H2O 298.2 K 稳定相图由2 个共饱点、5 条单变量曲线和4 个结晶区(MgCl2·6H2O、SrCl2·6H2O、SrCl2·2H2O 和AlCl3·6H2O)组成,与该体系三元子体系相比无新的固相生成。5 个 结 晶 区 中,SrCl2·6H2O 的 结 晶 区 最 大,表 明SrCl2·6H2O最容易从该体系中结晶析出。
(2)利用已报道的相关Pitzer参数和本文拟合的部分参数,采用Pitzer 模型完成了四元体系MgCl2-SrCl2-AlCl3-H2O 298.2 K 相平衡理论计算,实验结果与计算结果基本吻合。

