卡瑞利珠单抗联合卡铂、白蛋白紫杉醇成功治疗1例晚期肺鳞癌患者
李文辉 杨雨萍 徐朋亮 梁亦贤 陈秋强 余欢明
[摘要] 目的 包括化疗在内的传统晚期肺鳞癌治疗手段效果不能让人满意。卡瑞利珠单抗作为新兴的免疫治疗药物,其联合化疗药物治疗肺鳞癌的疗效尚不清楚。 方法 1例肺鳞癌患者术后化疗后复发。采用卡瑞利珠单抗与卡铂+白蛋白结合型紫杉醇的联合用药方案,患者获得了再次手术机会。 结果 病理证实复发肺癌得到完全缓解。结论 卡瑞利珠单抗联合化疗药物治疗晚期肺鳞癌有效,值得进一步研究。
[关键词] 卡瑞利珠;免疫治疗;肺鳞状细胞癌;PD-1;卡铂;白蛋白结合型紫杉醇
[中图分类号] R734.2 [文献标识码] C [文章编号] 1673-9701(2021)34-0152-04
传统的肺癌治疗手段效果差强人意,肺癌复发率居高不下,对新的治疗手段需求迫切,旨在消除肿瘤免疫逃逸机制的免疫检查点抑制剂随之诞生。卡瑞利珠单抗作为一种新的免疫检测点抑制剂,结合相应的程序性死亡受体-配体1(Programmed cell death-Ligand 1,PD-L1),竞争性地抑制了PD-L1和程序性死亡受体-1(Programmed cell death-1,PD-1)的结合,后者的结合可以介导肿瘤细胞免疫逃逸的作用,从而恢复机体对肿瘤细胞免疫杀伤的能力。然而任何一种新药都需要在临床实践中证明其有效性,以提供足够的循证医学证据,支持其下一阶段的临床应用。作为一种免疫增强剂,不可避免地应注意其引起免疫紊乱的可能,继而对机体产生或轻或重的副作用,这同样需要在临床实验中发现。近年来,我院将卡瑞利珠单抗应用于临床,产生了较好效果,其中1例肺鳞状细胞癌术后化疗后复发患者在经过卡瑞利珠单抗免疫治疗和化疗后,经影像学、手术切除标本石蜡病理等检查验证得到完全缓解,现报道如下。
1 病例资料
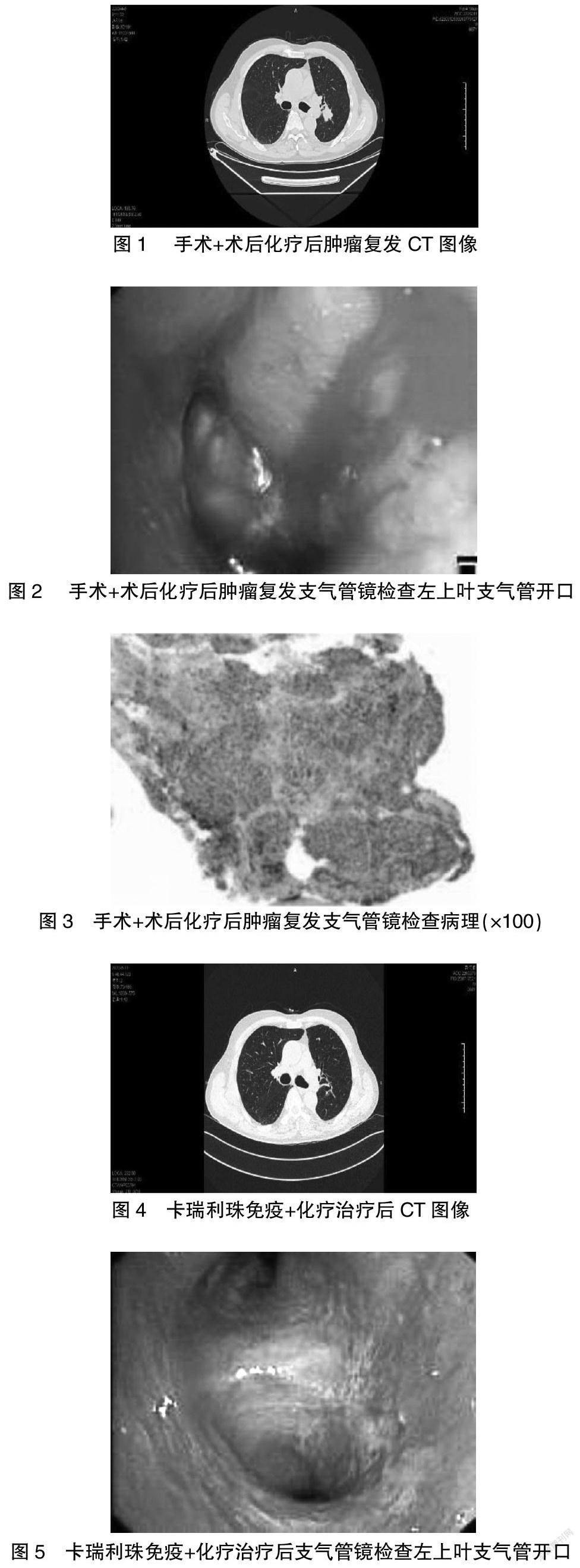
患者2年前因“咳嗽咳痰伴痰中带血1个月”来我院住院,完善胸部CT示左肺下叶癌首先考虑,遂决定手术治疗,于2018年5月20日行手术治疗,胸腔镜下完整切除左下肺叶并清扫纵隔及肺内淋巴结,手术顺利,术后病理示:“左下”肺中央型浸润性中分化鳞状细胞癌伴大片坏死,肿块大小5.0 cm×4.2 cm×3.5 cm,未侵及肺膜,(切片内)神经脉管均未见明显癌累及,周围肺组织可见脓肿伴机化改变;叶支气管切缘(-);第5、6组纤维脂肪组织伴钙化,第7、10、11组淋巴结没有发现明显的癌转移;免疫酶标180762:p53(+++)、TTF-1(-)、CK7(-)、CK20灶性(+)、Napsin A(-)、p63(+++)、CK5/6(+++)、ALK(-)、CDX2(-)、Ki-67(+80%)。2019年11月28日开始予术后新辅助化疗4次,方案为顺铂加多西他赛,2020年4月8日患者行胸部CT检查提示“①左下肺癌术后改变,术区可疑软组织增厚,左肺门区团块影,考虑多发复发,建议CT增强。②左下肺纤维灶伴胸膜增厚,两肺散在少许陈旧病灶(图1)。”予收住入院后行气管镜检查(图2)示支气管肿物,病理明确为左上肺鳞癌(图3),使用免疫加化疗的治疗方案术前处理,其中免疫用药为卡瑞利珠,化疗方案选择卡铂加白蛋白紫杉醇。化疗后出现重度粒细胞减少,同时伴有发热,予粒细胞刺激生长因子处理后好转。随后复查胸部CT发现肺占位变小(图4),支气管镜内也没有找到明显的癌肿(图5)。于2020年6月16日在全麻下行胸腔镜辅助下左上肺癌根治术(左上肺叶切除+系统性淋巴结清扫)。术后病理:左上肺叶切除标本:“左上”肺叶支气管局灶鳞状上皮中度异型增生,近肺门处见异物肉芽肿及泡沫细胞反应,周围肺组织局灶细支气管周化生,病变符合免疫治疗后改变;“左主”支气管切缘阴性;第7、10、11、12组淋巴结没有发现转移。
2 讨论
一些免疫细胞,如T、B淋巴细胞,自然杀伤细胞及树突细胞的细胞膜表面表达程序性死亡受体1(PD-1),其配体为PD-L1,常表达于癌细胞膜[1],两者结合介导免疫细胞的免疫抑制作用,使癌细胞逃避受免疫细胞杀伤。免疫球蛋白4型(Immunoglobulin 4,IgG4)单克隆抗体能靶向结合PD-1[2-3]。单抗通过结合PD-1,避免了PD-L1的活化,进而避免了其介导的T淋巴细胞的失活,从而使机体清除癌细胞的能力得以重建[4-5]。卡瑞利珠单抗属于IgG4型单克隆抗体家族,通过C,C和 FG loops这些结合区域结合PD-1。
目前一般用客观缓解率、疾病控制率等指标评价化疗、免疫、靶向等治疗手段疗效,因为目前任何治疗手段都不可能达到局部进展或远处转移恶性肿瘤的彻底治愈。进入到免疫时代以来,尽管PD-1单一疗法表现出一定的疗效,但在泛癌种使用、高疗效等方面仍不能让人满意。2019年5月29日,卡瑞利珠单抗得到国家药监局批准可用于癌症治疗,首先治疗的疾病为经典型霍奇金淋巴瘤,但不作为一线治疗手段,面对的临床使用对象需在二线治疗方案进行之后,疾病复发或难治[6]。卡瑞利珠单抗对肺癌治疗的研究始于晚期非鳞非小细胞肺癌患者,编号为NCT03083041、临床试验阶段为Ⅰb期的研究采用卡瑞利珠单抗配合阿帕替尼的治疗方案[7],试验结果显示总有效率41.2%,疾病控制率94.1%。其他早期临床试验有使用卡瑞利珠单抗配合微波治疗,显示出一定的治疗效果[8]。随着前期工作的顺利展开,卡瑞利珠单抗治疗肺癌进入Ⅲ期临床研究阶段[9],该实验针对癌组织石蜡病理明确诊断的晚期非鳞非小细胞肺癌患者。要求没有经过全身性的治疗,据世界卫生组织的体力状况评分标准,活动状况(Performance status,PS)評分为0~1分,癌肿单个或多个,没有活动性的脑转移,需经过基因检测,表皮生长因子受体(Epidermal growth factor receptor,EGFR)或间变性大细胞淋巴瘤激酶(Anaplastic lymphoma kinase,ALK)突变不能是阳性。实验组卡瑞利珠单抗配合化疗药物使用,化疗方案为卡铂加培美曲塞,经过4~6个周期后停止使用卡铂,对照组仅行化疗药物治疗,方案为卡铂加培美曲塞,4~6个周期后停止使用卡铂,培美曲塞使用如前,用药截止时间点设在疾病出现进展为止,或出现不可耐受、需停止用药的毒性反应。对照组化疗阶段结束后允许使用卡瑞利珠单抗。实验组客观缓解率可达60%,超过对照组20%,也超过KEYNOTE-189实验中帕博利珠单抗的成绩。中位数缓解持续时间为17.6个月,作为对比的对照组则不足10个月,中位数无进展生存时间可达11.3个月,超过对照组3个月。中位数总生存率还没有达到,与对照组比较均获益明显,证实了卡瑞利珠单抗在治疗晚期非鳞非小细胞肺癌中的效果。但是目前仅针对肺鳞状细胞癌的实验较少。中国人民解放军总医院的汪进良教授开展了一项针对肺鳞状细胞癌的前瞻性、开放性、单臂Ⅱ期临床试验,用药方案最终为卡瑞利珠单抗配合阿帕替尼一线使用。该研究的纳入标准主要为病理确诊、未全身治疗、ⅢB期或以上的鳞癌。该研究成功入选2020美国临床肿瘤学会(ASCO)。实验组卡瑞利珠单抗配合使用阿帕替尼,无进展生存期截止则试验终止。结果显示客观缓解率为76.55%,所有病例都达到疾病控制。13例病例为部分缓解,4例为疾病稳定。3级及以上的治疗相关不良反应有间质性肺炎,氨基转移酶升高;骨髓造血抑制,主要体现为血小板减少症;反应性皮肤毛细血管增生症,可能原因是卡瑞利珠单抗干扰了患者免疫功能,造成皮肤当中促血管生长因子活性增强;高血压,可能和卡瑞利珠单抗结合了血管内皮生长因子受体-2,拮抗了血管内皮生长因子的舒张血管作用有关[10-12]。中国肿瘤学会(CSCO)指南认为Ⅳ期非鳞非小细胞肺癌经基因检测相关基因突变阴性后,可使用卡瑞利珠单抗加培美曲塞和铂类(1A类证据)的治疗方案(Ⅱ级推荐)。
在卡瑞利珠单抗的Ⅰ/Ⅱ期临床试验过程中,出现的不良反应多为1、2级,很多不良反应统称免疫相关不良反应,这与卡瑞利珠单抗导致机体免疫反应过强有关[13]。包括反应性皮肤毛细血管增生症[14]、发热、疲劳、甲减[15]、食欲下降、腹泻、皮疹[2]、咳嗽、蛋白尿[6]等。3、4级不良反应一般有电解质紊乱、骨髓造血抑制[6,15]、肺炎[16]、肝功能异常(血胆红素[15]、结合胆红素升高[2])等。國内外为此制订了相关指南用于指导如何缓解免疫药物的副作用,尤其是免疫相关的不良反应[17-19]。
本病例中患者左上肺鳞状细胞癌在根治术及术后辅助化疗后局部复发明确,其余相关检查未见远处转移迹象,予卡瑞利珠免疫治疗配合卡铂加白蛋白紫杉醇化疗后复发肿块缩小明显,再次手术完整切除左肺及肿块,术后病理示周围肺组织局灶细支气管周化生,未见明显癌细胞,清扫的淋巴结也没有发现癌转移,考虑局部复发的肺鳞癌完全缓解。术后定期随访,截止到目前为止影像学检查及血检肿瘤指标均未见肿瘤复发及转移迹象。表明卡瑞利珠单抗在一定情况下能彻底消除肺鳞状细胞癌肿块。本研究患者出现粒细胞减少、发热,但予对症治疗后即缓解,短期内患者病情能保持稳定,长期看未对患者造成持续影响。
目前距卡瑞利珠单抗上市时间短,相关临床实验及病例尚不足,需进一步进行临床试验及收集病例评估卡瑞利珠单抗在临床中的实际使用效果。
[参考文献]
[1] Wu Y,Chen W,Xu ZP,et al.PD-L1 distribution and perspective for cancer immunotherapy-blockade,knockdown,or inhibition[J]. Front Immunol,2019,10:2022.
[2] Mo HN,Huang J,Xu JC,et al. Safety,anti-tumour activity,and pharmacokinetics of fixed-dose SHR-1210,an anti-PD-1 antibody in advanced solid tumours:A dose-escalation,phase 1 study[J]. Br J Cancer,2018,119(5):538-545.
[3] Wu X,Gu Z,Chen Y,et al. Application of PD-1 blockade in cancer immunotherapy[J]. Comput Struct Biotechnol J,2019,17:661-674.
[4] Guzik K,Tomala M,Muszak D,et al. Development of the inhibitors that target the PD-1/PD-L1 interaction-a brief look at progress on small molecules,peptides and macrocycles[J]. Molecules,2019,24(11):E2071.
[5] Nowicki TS,Hu-Lieskovan S,Ribas A. Mechanisms of resistance to PD-1 and PD-L1 blockade[J]. Cancer J,2018,24(1):47-53.
[6] Markham A,Keam SJ. Camrelizumab:First global approval[J]. Drugs,2018,79(12):1355-1361.
[7] Zhou C,Gao G,Wu F,et al. A phase Ib study of SHR-1210 plus apatinib for heavily previously treated advanced non-squamous non-small cell lung cancer(NSCLC)patients[J]. Journal of Clinical Oncology,2018,36(15 suppl):e21 017.
[8] Wei Z,Yang X,Ye X,et al. Camrelizumab combined with microwave ablation improves the objective response rate in advanced non-small cell lung cancer[J]. Journal of Cancer Research and Therapeutics,2019,15(7):1629-1634.
[9] Zhou CC,Chen GY,Huang YC,et al. Camrelizumab plus carboplatin and pemetrexed versus chemotherapy alone in chemotherapy-naive patients with advanced non-squamous non-small-cell lung cancer(CameL):A randomised,open-label,multicentre,phase 3 trial[J]. Lancet Respir Med,2021,9(3):305-314.
[10] Spratlin JL,Mulder KE,Mackey JR.Ramucirumab(IMC-1121B):A novel attack on angiogenesis[J]. Future Oncology,2010,6(7):1085-1094.
[11] Lee SJ,Lee SY,Lee WS,et al. Phase I trial and pharmacokinetic study of tanibirumab,a fully human monoclonal antibody to vascular endothelial growth factor receptor 2,in patients with refractory solid tumors[J]. Investigational New Drugs,2017,35(6):782-790.
[12] Shelley Ji Eun Hwang,Giuliana Carlos,Deepal Wakade,et al. Cutaneous adverse events(AEs)of anti-programmed cell death(PD)-1 therapy in patients with metastatic melanoma:A single-institution cohort[J].J Am Acad Dermatol,2016,74(3):455-461,e451.
[13] Friedman CF,Proverbs-Singh TA,Postow MA.Treatment of theimmune-related adverse effects of immune checkpoint inhibitors:A review[J].JAMA Oncol,2016,2(10):1346-1353.
[14] Nie J,Wang CM,Liu Y,et al. Addition of low-dose decitabine to anti-PD-1 antibody camrelizumab in relapsed/refractory classical Hodgkin lymphoma[J]. J Clin Oncol,2019,37(17):1479-1489.
[15] Fang WF,Yang YP,Ma YX,et al. Camrelizumab(SHR-1210)alone or in combination with gemcitabine plus cisplatin for nasopharyngeal carcinoma:Results from two single-arm, phase 1 trials[J]. Lancet Oncol,2018,19(10):1338-1350.
[16] Huang J,Xu BH,Mo HN,et al. Safety,activity,and biomarkers of SHR-1210,an anti-PD-1 antibody,for patients with advanced esophageal carcinoma[J]. Clin Cancer Res,2018,24(6):1296-1304.
[17] Puzanov I,Diab A,Abdallah K,et al.Managing toxicities associated with immune checkpoint inhibitors:Consensus recommendations from the Society for Immunotherapy of Cancer(SITC)Toxicity Management Working Group[J].J Immunother Cancer,2017,5(1):95.
[18] Haanen J,Carbonnel F,Robert C,et al.Management of toxicities from immunotherapy:ESMO clinical practice guidelines for diagnosis,treatment and follow-up[J].Ann Oncol,2018,29(Suppl 4):264-266.
[19] Brahmer JR,Lacchetti C,Schneider BJ,et al.Management of immune-related adverse events in patients treated with immune checkpoint inhibitor therapy:American Society of Clinical Oncology Clinical Practice Guideline[J].J Clin Oncol,2018,36(17):1714-1768.
(收稿日期:2021-03-15)

