血管内近程放疗在肝癌合并门静脉一级分支癌栓中的应用
方主亭,张 雯,马婧嵚,刘清欣,罗剑钧,颜志平
门静脉癌栓(portal vein tumor thrombus,PVTT)的发生率在HCC 患者中较高,10%~40%的患者首次就诊时已合并PVTT[1]。此类患者如不接受治疗,门静脉一级分支内癌栓进展至门静脉主干进而形成门脉主干闭塞仅需要大约6 周时间[2]。研究表明HCC 合并PVTT 患者预后较差,尤其门静脉主干受侵犯时,围手术期死亡率为0~28%,5 年生存率仅为 0~26.4%[3-4]。
目前索拉菲尼是指南推荐的HCC 合并PVTT患者的一线治疗[5]。在亚洲范围的三期临床随机对照研究显示,索拉菲尼可以延长进展期HCC 患者的中位生存时间至6.5 个月,但该项研究中合并PVTT 的患者仅占 35.4%[6]。
TACE 是一种治疗HCC 合并PVTT 的有效方式,即使癌栓已经侵犯门静脉主干[7]。研究表明,接受TACE 治疗的PVTT 患者中位生存时间仍然较短(7.1~9.5 个月),导致这一结果的原因是门静脉内癌栓未得到有效控制,门脉主干受侵犯更是影响患者生存的重要因素[8]。
近年来,有研究显示,以125I 粒子条植入为治疗方式的血管内近程放疗(endovascular brachy therapy,EVBT)联合支架植入及TACE 的综合治疗方式显著延长了HCC 合并门静脉主干癌栓患者中位生存时间[9-11]。但此类研究仅针对癌栓已侵犯门脉主干的患者,总体中位生存时间虽有所延长,但预后仍然较差。本研究的主旨为评估在癌栓尚未侵犯门静脉主干,尚处于门静脉一级分支时采用125I 粒子条早期干预的治疗方法。
1 材料和方法
回顾性分析 2013 年 1 月至 2018 年 1 月于上海中山医院治疗的HCC 合并门静脉一级分支癌栓的患者资料。在接受治疗前首先向此类患者推荐TACE 联合靶向治疗。如果患者拒绝,推荐125I 粒子条联合TACE 术或单纯TACE 治疗。对所有符合入组标准的患者本人及家属详细解释门静脉植入125I粒子条联合TACE 对于患者可能出现的获益及相关风险,所有接受治疗的患者及家属签署知情同意书。
1.1 材料
肝实质内HCC 病灶经病理学诊断或符合我国2017 版原发性肝癌诊疗规范[12]临床诊断标准纳入本回顾性研究。门静脉癌栓的诊断应符合由Shah等[13]提出的以下诊断标准中的一项:①门静脉栓子导致门静脉管径增粗(门静脉主干≥1.8 cm,右支≥1.6 cm,左支≥1.8 cm);②在增强 CT 的动脉期,门静脉栓子与平扫图像相比有明显强化(≥20 HU)。PVTT 的分型采取 Shi 等[14]提出的分型方法:Ⅰ型,侵犯门脉二级分支,Ⅱ型侵犯门脉一级分支,Ⅲ型侵犯门脉主干,Ⅳ型侵犯肠系膜上静脉或脾静脉。
入组标准: ①患者年龄 18~75 岁; ②Ⅱ型PVTT;③门静脉二级分支保持通畅;④门静脉一级分支单侧受累;⑤Child-Pugh A 或 B;⑥Eastern Cooperative Group performance status(ECOG)评分 0~2。排除标准:①肝外转移;②Child-Pugh C 级;③合并TACE禁忌证。

表1 患者基本情况 n(%)
1.2 方法
1.2.1 治疗前检查及评估 患者介入治疗前行常规化验检查及腹部增强CT 评价肝内病灶大小、形态、门脉受侵犯情况、癌栓长度(图1)。
1.2.2125I 粒子条制作及植入 本研究使用为6711型125I 粒子(上海欣科医药有限公司),125I 粒子条的制作过程:①取4 F 透明无菌医用导管(美国BostonScientific 公司),封闭一端;②利用粒子植入装置向导管内连续植入所需125I 粒子,所需粒子数(N)计算公式:N=门脉梗阻长度(mm)/4.5+4[9];③封闭导管另一端。
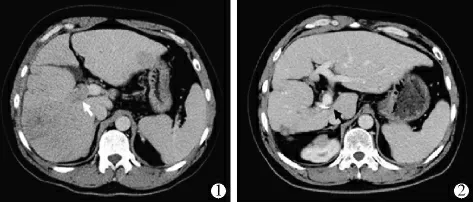
图1 肝癌合并门脉一级分支癌栓治疗前后腹部增强CT 图像
超声引导下,使用21 G Chiba 针(美国Cook 公司)穿刺受侵犯侧门静脉二级分支,将0.018 英寸导丝(美国Cook 公司)送入门静脉主干至肠系膜上静脉或脾静脉,沿0.018 英寸导丝送入6 F NEEF 套件(美国Cook 公司)。经NEEF 套件的外套管置入已制备好的125I 粒子条,再引入套件内套管,在DSA 透视下将125I 粒子条推送至门静脉癌栓处,125I 粒子条到位后,后撤外套管直至125I 粒子条完全释放出套件,125I 粒子条远心端由于肝脏弹性固定于肝实质内。最后使用3/140 mm NESTER 弹簧圈(美国Cook公司)封堵肝脏穿刺道(图2)。
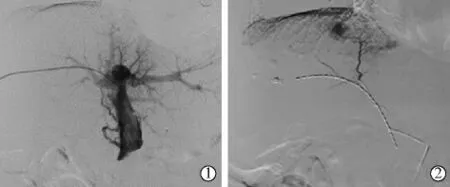
图2 患者植入125I 粒子条图像
1.2.3 TACE 研究组患者完成125I 粒子条植入后,即行TACE 术。取右侧股动脉为穿刺点,使用5 F RH 导管(美国Cook 公司)于肿瘤相关动脉造影,明确责任血管后,引入微导管至责任血管,将化疗药物与碘化油混合,DSA 透视下缓慢注入,后再加用明胶海绵颗粒加强栓塞。
对照组患者采用与研究组患者相同的方法单纯行TACE 术。
1.2.4 术期处理 所有患者24 h 心电监护、 保肝、抑酸、预防感染及对症治疗,术后3~5 d 行实验室检查(肝肾功能、血常规、出凝血功能等)。研究组患者术后第1 日行单光子激发断层扫描(single photon emission computer tomography,SPECT)检查,评估植入125I 粒子条辐射分布范围。研究组术后每12 h皮下注射低分子肝素4 100 U(上海信宜公司)抗凝,连续给予3 d,后给予口服华法林2.5 mg/d(上海信宜制药公司)抗凝 6 个月(INR 维持在 1.8~2.0)。
1.2.5 随访及重复TACE 治疗 所有患者首次治疗后30~45 d 门诊随访至患者死亡或2018 年12月31 日。随访内容包括详细病史、常规化验、腹部增强CT。所有患者如出现肝内病灶进展或新发病灶,且患者符合TACE 适应证,再次以上述同样方式行TACE 术。
1.2.6 安全性及疗效评价 肝内HCC 病灶治疗后评价采用美国肝脏病协会推荐改良实体瘤治疗应答标准(modified response evaluation criteria in solid tumor,mRECIST)[15]。肝内病灶控制率(disease control rate,DCR)=CR+PR+SD。门静脉癌栓控制率定义为:癌栓未侵犯门脉主干患者数/该组患者数。
3.确定各级指标权重并进行一致性检验。使用EXCEL或MATLAB等软件对判断矩阵进行归一化处理,计算出各级指标的权重。同时为避免由于教学质量评价要素的复杂性以及考评人员认识的多样性、主观性等造成的问题,需对判断矩阵一致性进行检验,避免出现偏差。
对两组患者生存时间(overall survival,OS)、不良事件发生率进行比较。OS 定义为自患者接受首次介入治疗到死亡或随访期内末次随访的时间间隔。不良事件采用常见不良反应标准(Common Toxicity Criteria for Adverse Events,CTCAE)version4.0[16]进行评估。另外分别对两组患者肝内转移、上消化道出血及肝功能失代偿(Child-Pugh C)的发生率及发生时间进行比较。
1.3 统计分析
2 结果
2.1 治疗情况
研究组患者均成功植入1 根125I 粒子条,平均每例患者植入(17.9±4.7)(10~25)枚125I 粒子,根据线装排列125I 粒子源剂量计算软件[17],计算得出平均目标剂量为(62.1±1.6) Gy(57.5~63.6 Gy)。根据术后随访SPECT/CT 及CT 结果,所有研究组患者未发现明显125I 粒子条移位。
2.2 相关不良事件
两组患者接受治疗后均无严重的治疗相关不良事件发生。研究组腹痛、呕吐、发热的发生率,分别为 13 例(54.2%)、12 例(50.0%)和 8 例(33.3%),对照组分别为 33 例(70.2%)、37 例(78.7%)、21 例(44.7%),两组差异无明显统计学意义(P=1.000),均经过对症治疗后好转。术后6 个月实验室检查显示无3 级或以上不良反应发生。研究组患者未出现放射治疗相关不良事件,例如放射性肝损伤、放射性肠炎等。
2.3 肿瘤缓解
研究组及对照组分别有 2 例(8.3%)及34 例(72.3)患者门静脉癌栓由一级分支侵入门静脉主干。研究组及对照组门静脉癌疾病控制率(DCR)分别为 91.7%及 27.7%(P<0.001)。
研究组发生肝内转移、上消化道出血及肝功能失代偿的患者例数分别为3 例(12.5%)、2 例(8.3%)和 5 例(20.8%),对照组分别为 32 例(68.1%)、24例(51.1%)和 42 例(89.4%),(P<0.001、P<0.001、P<0.001)。
2.4 生存分析
研究组及对照组平均随访时间分别为(16.1±10.3)个月和(9.5±4.1)个月。研究组死亡 7 例(29.2%),对照组死亡 39 例(83.0%)。研究组 4 例(16.7%)死于肿瘤进展,1 例(4.2%)死于上消化道出血,2 例(8.3%)死于肝功能衰竭,对照组上述死亡原因分别为 8 例(17.0%)、20 例(42.6%)和 19 例(40.4%)。
研究组 OS 为(24.0±4.0)个月,对照组为(10.7±0.7)个月,差异有显著统计学意义(P<0.001)。(图3)
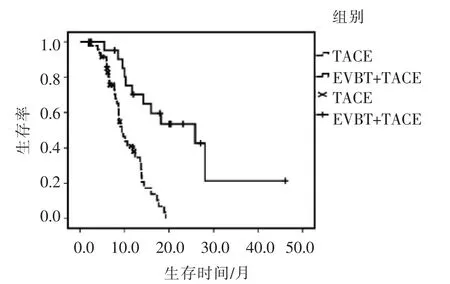
图3 两组患者生存时间
3 讨论
本研究结果显示门静脉植入125I 粒子条联合TACE 治疗HCC 合并门静脉一级分支受侵安全、有效。既往研究显示门静脉主干癌栓形成后,可增加肝内肿瘤播散、恶化继发于肝硬化基础上的门脉高压、阻碍入肝门脉血流导致肝功能储备受损,从而出现腹水、上消化道出血、肝功能衰竭等一系列并发症[3]。本研究对照组中,大部分患者死亡原因为上消化道出血和肝功能衰竭。而导致这一结果的主要原因正是门静脉癌栓进展导致门静脉主干梗阻(34例患者发生门静脉主干侵犯)。而研究组于患者受侵犯的门静脉一级分支内植入125I 粒子条有效地抑制了癌栓的进展,很大程度上避免了癌栓进展导致的门静脉主干梗阻(2 例患者发生门静脉主干侵犯),显著降低了上述事件的发生率,延长患者生存时间的同时明显改善了患者的生活质量。另外,保持门静脉主干及健侧门静脉分支的通畅为患者正常的肝功能储备奠定了基础,使得患者有足够的肝功能储备接受更多次数的TACE 治疗控制肝内病灶。良好的肝内病灶治疗进一步延长了患者的生存时间。
Huang 等[18]提出 CT 引导下直接穿刺门静脉癌栓植入125I 粒子治疗门静脉癌栓。但此研究的操作过程需要反复穿刺门静脉及调整穿刺针角度。一方面我国大部分HCC 患者有肝硬化背景,肝脏弹性较差,另一方面门静脉周围并行肝动脉及胆道,反复穿刺门静脉一级分支会增加穿刺道或肝动脉出血及胆道损伤的风险。而本研究的操作过程只需穿刺一次门静脉二级分支,同时操作结束后以弹簧圈封堵穿刺道,较直接穿刺植入125I 粒子更为安全。
使用钇-90 微球经动脉栓塞在治疗肝癌合并门静脉癌栓中取得了一定的效果,但国内尚未开展[19]。外放疗也同样被视为一种治疗肝癌合并门静脉癌栓的有效手段,但据报道[20-21]例如肝功能受损、十二指肠溃疡、白细胞减少等放射相关并发症发生率明显高于本研究利用的管内近程放疗,从而进一步说明血管内近程放疗是一种更为安全的治疗肝癌合并门静脉癌栓的治疗方式。
本研究尚存在一些不足:①本研究虽然使用了倾向性评分匹配降低了病例选择性偏移,但仍属回顾性研究;②样本量有限。本中心拟进一步开展单中心及多中心前瞻性研究,进一步提高循证级别,为HCC合并门静脉癌栓患者提供更多的获益。
综上所述125I 粒子条联合TACE 的综合治疗方法明显降低了门脉主干侵犯的发生率,从而明显延长了患者的生存时间,提高了患者的生存质量。

