曲酸高产菌的复合诱变选育
高紫君,毕付提,蒋水星,刘博雅,史亚楠,王德培,3*
(1.天津科技大学生物工程学院,天津 300457;2.山东日照金禾博源生化有限公司,山东 日照 276800;3.工业发酵微生物教育部重点实验室,天津 300457)
曲酸(kojic acid)的化学名称为2-羟甲基-5-羟基-4-吡喃酮,是一种微生物好氧发酵过程中产生的次级代谢产物[1]。曲酸具有抑制酪氨酸酶活性[2]、抑菌[3]、抗氧化[4]、螯合金属离子[5]的性质,是一种天然的弱酸性化合物,研究者普遍认为曲酸是一种安全无毒的添加剂[6]。曲酸现已广泛应用于食品、化妆品、医药、农业、以及化学材料[7]等方面,曲酸全球需求量达到1 000 t左右,且我国为主要生产国[8]。目前曲酸的来源主要以微生物发酵为主,因此提高菌株发酵产曲酸能力成为研究重点。
提高曲酸发酵能力的研究集中在诱变筛选工作,并取得了不少成果。凌帅等[9]在紫外照射40 s、N+注入剂量为10×1014ions/(cm2·s)的复合诱变条件下筛选到米曲霉CICC-2336,筛选突变菌株最高产量可以达到24.12 g/L;谢光蓉[10]采用两次紫外线、两次60Co多重复合诱变米曲霉w-56,在紫外照射15 min~16 min、60Co诱变剂量500 Gy~600 Gy后最终获得曲酸产量可以达到68 g/L的高产菌株;陈锡剑等[11]采用常压室温等离子体对米曲霉KA2308进行诱变,等离子体处理时间200 s后突变菌株最高产量可以达到47.28 g/L。
本研究以米曲霉3.042为出发菌株,以紫外和超声波、微波复合多种物理诱变手段,探讨复合诱变对米曲霉孢子的诱变效果,以上述方法复合诱变选育,筛选出产曲酸水平高的菌种,为米曲霉孢子诱变方法提高研究借鉴,并以此高产曲酸米曲霉为基础,进一步提高其曲酸产量,提高生产效率,降低生产成本,为曲酸的工业化生产奠定坚实基础。
1 材料与方法
1.1 材料
1.1.1 菌种
米曲霉(A.oryzae)3.042(CGMCC No.3.00951)菌株:中国普通微生物菌株保藏管理中心。
1.1.2 培养基
斜面培养基:PDA培养基[19]。
初筛培养基:葡萄糖10%、酵母提取物0.5%、KH2PO40.1%、MgSO4·7H2O 0.05%、琼脂 2%、TritonX-100 7%、FeCl31%。
发酵培养基:糊精9%、胰蛋白胨0.4%、KH2PO40.15%、MgSO4·7H2O 0.14%。
1.2 仪器与设备
Mandela型多功能等离子体诱变系统:北京艾德豪克仪器生物有限公司;LRH-250A生化培养箱:韶关市泰宏医疗器械有限公司;UV-3100PC型紫外可见分光光度计:上海美谱达仪器有限公司;H1650-W台式高速离心机:湖南湘仪实验室仪器开发有限公司;MQD-S3R振荡培养箱:上海旻泉仪器有限公司;KM-23C型超声波清洗机:广州市科洁盟实验仪器有限公司;ME204E型电子天平:北京赛多利斯仪器系统有限公司。
1.3 方法
1.3.1 米曲霉诱变孢子悬液的制备
将在斜面培养基上生长7 d的成熟孢子以无菌水洗下,经小玻璃珠打散,分别以无菌去离子水,于30℃、180 r/min 下孵育 0.5、1、2、3、4、5 h,孢子吸水膨胀后,采用血球计数板计数,稀释到浓度为107个/mL备用。
1.3.2 诱变方法
1.3.2.1 紫外诱变
取200 μL孵育后孢子悬液于诱变小皿中进行紫外照射,分别照射 1、2、3、4、5、7、9、11 min,未经过紫外照射的孢子悬液作为对照,分别稀释涂布于PDA培养基和初筛培养基平板。
1.3.2.2 超声诱变
取200 μL孵育后孢子悬液于离心管中,在40 kHz的低频率超声下对孢子悬液进行处理。分别超声1、2、3、4、5、6 min,未经过超声处理的孢子悬液作为对照。
1.3.2.3 超声波-微波诱变
取200 μL孵育后孢子悬液于离心管中先进行超声处理 4 min,取出后立即进行微波处理 4、5、6、7、8、10、12 min,未经过任何处理的孢子悬液作为对照。微波处理每10 s取出进行冰浴降温处理,避免热效应。
1.3.3 突变株初筛方法
将紫外诱变及超声波-微波诱变的孢子悬液适当稀释后涂在初筛培养基平板上,30℃培养3 d。(紫外诱变后的平板要注意避光培养)。
1.3.4 突变株摇瓶发酵方法
将初筛培养基上长出的红色较深的单菌落接种于斜面培养基上培养7 d。装液量为70/250 mL的三角瓶中接种培养7 d的待测试菌株,接种量为104个/mL,转速250 r/min,发酵温度30℃,发酵6.5 d。
1.3.5 曲酸含量的测定方法
曲酸产量的测定采用硫酸铁显色法[20]。
1.3.5.1 标准曲线的绘制
制作标准曲线:称取0.1 g的曲酸标准样品溶于蒸馏水中,并将其定容至100 mL,得到1.0 mg/mL曲酸标准溶液。称取7.40 g Fe2(SO4)3和7.37 mL 18.4 mol/L的浓硫酸溶于蒸馏水,并定容至1 000 mL,得到1%的Fe2(SO4)3-H2SO4显色剂。分别吸取0.25、0.5、0.75、1.0、1.25、1.5、1.75、2.0、2.25 mL 共 9 个浓度梯度的曲酸标准溶液和1 mL显色剂于比色管中,用蒸馏水定容至25 mL,反复摇匀使其充分反应,以水加显色剂为空白对照组,在紫外可见分光光度计500 nm波长下测其吸光度值(OD值),以吸光度对曲酸浓度绘制标准曲线,OD500为纵坐标,曲酸含量(g/L)为横坐标,绘制成曲酸标准曲线。
1.3.5.2 发酵液中曲酸含量的测定
离心除去发酵液中菌丝体,吸取50 μL无菌丝体发酵液于25 mL的比色管中,加入1 mL显色剂,定容。在波长500 nm处测其吸光值。
2 结果与分析
2.1 初筛方法的建立
曲酸能与Fe3+发生络合反应,因此有曲酸产生时,会与筛选培养基平板中FeCl3发生红色反应,且曲酸产量越高,红色越深,培养3 d的显色反应如图1所示。观察平板变色情况,挑选出最先出现红色与红色较深的菌株保存于斜面培养基上。
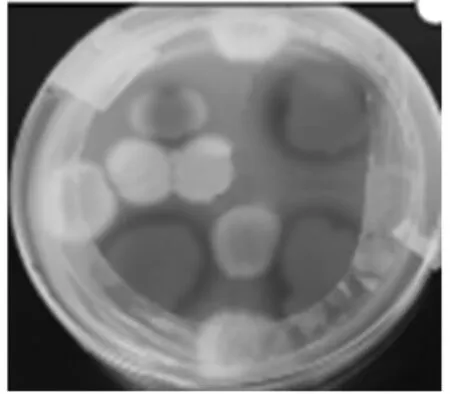
图1 培养3 d的显色反应Fig.1 Color reaction in cultured for 3 days
2.2 曲酸的标准曲线
曲酸标准曲线如图2所示。

图2 曲酸的标准曲线Fig.2 Standard curve of kojic acid
线性方程为:y=7.081 5x+0.011 0,相关系数R2=0.999 1;其中 x为曲酸含量(g/L),y为 500 nm 吸光度值。
2.3 孢子孵育对诱变的影响
斜面培养基上生长7 d的成熟孢子用无菌去离子水洗下,考虑到物理诱变过程体系中无机离子的干扰,并减少离心操作等易染菌等因素,故只选择在无菌去离子水中进行孢子孵育,没有进行无菌生理盐水和液体培养基的孵育试验。将新鲜米曲霉孢子于无菌去离子水,30 ℃、180 r/min 下分别孵育 0.5、1、2、3、4、5 h,制片后在显微镜下观察,将未经过吸水膨胀的孢子在相同倍数的显微镜下观察作对照。具体结果见图3。
由图3可以看出,在无菌去离子水中孵育4 h时孢子明显吸水膨胀,在孵育5 h时,孢子开始出现芽管。

图3 孵育不同时间孢子吸水膨胀状况Fig.3 Spore water absorption expansion condition in different incubation time
分别将孵育1、2、3、4 h的孢子进行紫外诱变,通过对致死率测定发现,1、2、3 h孢子吸水膨胀不明显,此时间孵育的米曲霉孢子经紫外线照射4 min致死率仅为35%~50%,而孢子孵育4 h后经紫外线照射后致死率达到80%。分析原因,孢子吸水膨胀开始萌发时,高度螺旋化的染色体开始解螺旋成为细丝状染色质,DNA开始复制,碱基暴露在外面。此时进行诱变,低能量剂量即可以打破碱基配对氢键,诱变效果更为显著。5 h时孢子已开始出现芽管,因此选择4 h作为孵育时间。
2.4 紫外线诱变对菌株致死率及正突变率的影响
吸取200 μL浓度为107个/mL孵育后孢子悬浮液置于诱变小皿中,在15 W紫外灯下距离30 cm,分别照射 1、2、3、4、5、7、9、11 min。将诱变后的孢子悬液进行适当稀释,涂布在PDA培养基和初筛培养基平板,将未诱变的孢子悬液采用相同的操作做对照。在30℃的培养箱中避光培养3 d,根据PDA平板菌落数计算出致死率,根据初筛板颜色变化计算出正突变率,具体结果见图4。
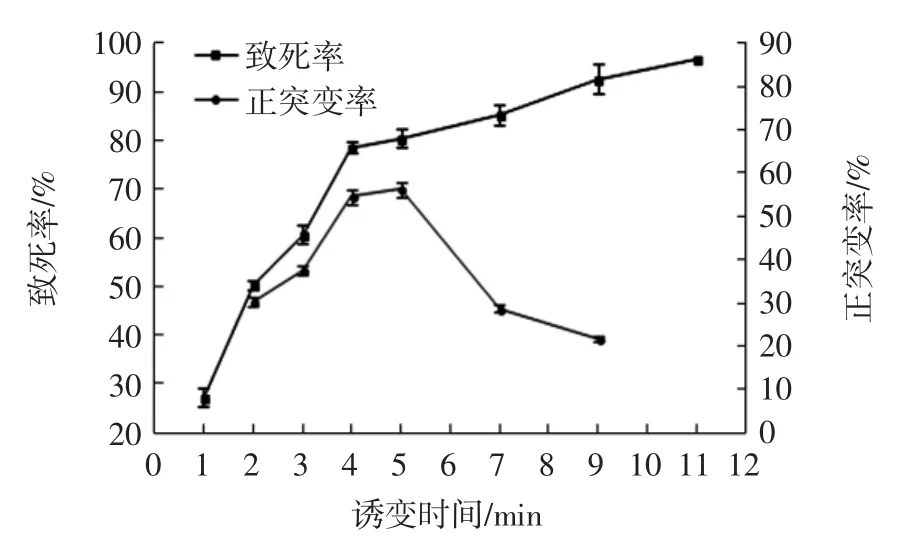
图4 紫外诱变对菌株致死率和正突变率的影响Fig.4 Effects of ultraviolet mutagenesis on the lethality and positive mutation rate of the strain
由图4可以看出,随着紫外照射时间的增加,菌株的致死率逐渐上升,照射时间为11 min时,菌株的致死率达到96.7%。当紫外线诱变处理5 min时正突变率最高,为56.3%,此时致死率为80.5%。紫外诱变突变株曲酸产量见图5。
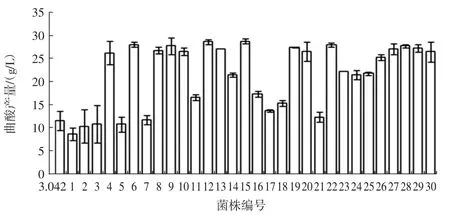
图5 紫外诱变突变株曲酸产量Fig.5 Yield of kojic acid from mutants induced by ultraviolet radiation
经摇瓶复筛,获得一株编号为UV-4的突变菌株,产酸量达26.54 g/L,比出发菌株3.042提高了129.8%。紫外照射5 min进行诱变处理,经复筛后,获得一株编号为UV15的突变菌株,产酸量最高达28.76 g/L,比出发菌株UV-7提高了8.36%。
两轮紫外线照射诱变中第一轮的效果比较理想,诱变后产酸提高率较高。第二轮的诱变效果较低,产量提高的不明显。原因可能是经过第一轮诱变后,突变株对紫外线的敏感性降低,故应考虑采用其它诱变因子,以进一步提高诱变效应。
2.5 超声对菌株致死率的影响
将诱变后的孢子悬浮液涂布在初筛培养基平板上,于30℃的培养箱中避光培养3 d,根据菌落数计数出致死率。
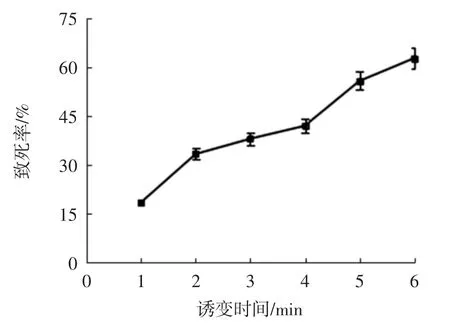
图6 超声对菌株致死率的影响Fig.6 The effect of ultrasound on the lethality of strain
由图6可以看出,随着超声处理时间的增加,菌株的致死率逐渐上升,超声时间为6 min时,菌株的致死率达到62.8%,超声时间为4 min时,菌株的致死率为42%。本试验选用40 kHz的低频率超声对孢子悬液进行处理,旨在加强细胞膜通透性,因此选择致死率为40%左右的4 min作为超声处理时间。
2.6 超声微波诱变致死率及诱变筛选
以UV15作出发菌株对其孢子悬液进行超声微波诱变,将诱变后的孢子悬浮液涂布在初筛培养基平板上,于30℃的培养箱中避光培养3 d,根据菌落数计数出致死率。
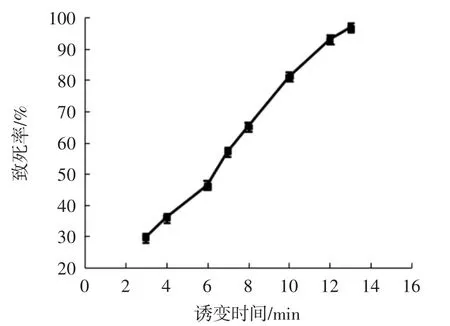
图7 超声微波复合诱变对菌株致死率的影响Fig.7 Effect of combined ultrasonic and microwave mutagenesis on the lethality of bacterial strain
由图7可以得出,随着微波辐射时间的增加,菌株的致死率逐渐上升,照射时间为13 min时,菌株的致死率达到96.8%。经过摇瓶筛选,曲酸产量见图8。
由图8可知,编号M22的突变菌株,其产酸量为34.28g/L。与UV15相比产酸量提高19.2%,与菌株3.042相比提高197%。
2.7 突变株的遗传稳定性
为检验突变株的遗传稳定性,将M22菌株在斜面培养基中传代培养10代,并将每两代菌体分别接种于发酵培养基中,30℃培养6.5 d,通过硫酸铁显色法测定曲酸产量。
由图9可知,经过传代试验后,M22的产量基本保持在30 g/L~33 g/L。因此证明本复合诱变是一种较有效的诱变方法,对提高菌种产曲酸有非常好的效果。

图8 超声微波复合诱变突变株曲酸产量Fig.8 Yield of kojic acid from ultrasonic-microwave mutagenesis

图9 突变株的遗传稳定性试验Fig.9 Genetic stability experiment of the mutant strains
3 结论
研究发现,孢子吸水膨胀对米曲霉3.042孢子诱变的影响较大,由显微镜观察和紫外诱变结果可知,孢子孵育4 h时吸水膨胀明显,与未孵育孢子相比,紫外照射4 min时致死率由35%提高到80%。因此米曲霉孢子在去离子水中孵育4 h最适宜诱变。
通过紫外诱变、超声波微波复合诱变筛选曲酸高产菌株。从结果得出,紫外诱变5 min时正突变率最高,为56.3%,复筛后获得菌株UV15,产量达28.76 g/L。在此基础上进行超声波微波复合诱变,复筛后获得菌株M22,产量达34.28 g/L,与出发菌株3.042相比曲酸产量提高了197%,与UV15相比曲酸产量提高了19.2%。传10代发现生长性能和产酸能力均稳定。通过系列复合诱变能显著提高出发菌株产曲酸能力,可以作为曲霉属微生物诱变育种的参考方法。

