超声辅助低共熔溶剂提取甘草多糖的研究
孙悦,何莲芝,苏卓文,李志田,刘娅,2*
(1.石河子大学食品学院,新疆 石河子 832000;2.新疆植物药资源利用教育部重点实验室,新疆石河子832000)
甘草为豆科、甘草属多年生草本植物,全世界有13种甘草,主要分布于亚洲、美洲中部、北非等地。新疆是我国甘草的主要产地之一[1]。甘草作为药食两用资源,其中含有甘草多糖、甘草黄酮和甘草酸等多种生物活性成分[2],而多糖是人体内的一种信息分子,广泛存在于自然界和生物体中,具有免疫调节、抗氧化、抗病毒、抗肿瘤等作用,还能降血脂,延缓衰老、抗疲劳[3-5],因此多糖的提取和性质研究日益受到重视。
传统的多糖提取,以水为介质,存在费时、生产能耗高、活性组分易损失、得率低等不足。而低共熔溶剂作为一种绿色、新型介质,由氢键受体和氢键供体按照一定比例混合构成[6],二者通过氢键相互结合,能够提供或接受外部电子或质子形成氢键,使得它们可以溶解多种物质,包括多糖、蛋白质、药物活性物质和盐等,因此,可用于植物中极性或非极性组分的有效提取[7-8]。
此外,低共熔溶剂不仅具有离子液体的良好性质,如热稳定性优异,与水和有机溶剂混溶[9],对各种有机化合物具有优异的溶解性和萃取性,而且原料易得,成本较低,制备简单,无污染[10]。
国外已将低共熔溶剂成功应用于多酚、多糖、异黄酮、花青素、白藜芦醇、香草醛[11-16]等多种生物活性成分的提取,而国内相关报道甚少。
为了解低共熔溶剂提取多糖的规律,本研究以甘草为对象,以低共熔溶剂为提取剂,选取价廉易得的氯化胆碱为氢键受体,采用超声辅助技术提取其中的多糖类化合物,优化甘草多糖提取工艺,从而为甘草多糖的综合开发利用提供理论依据,并为后期多糖功能性研究奠定基础。
1 材料与方法
1.1 材料与试剂
原料甘草(二级甘草):新疆和济中药饮片有限公司。
氯化胆碱:上海源叶生物科技有限公司;丙三醇:天津市化学试剂三厂;异丙醇:天津市富宇精细化工有限公司;尿素、中性醋酸铅:天津市永晟精细化工有限公司;草酸、葡萄糖:天津市盛奥化学试剂有限公司;3,5-二硝基水杨酸:上海远帆试剂厂;氢氧化钠:天津市福晨化学试剂厂;浓盐酸:北京化工厂;酚酞:天津市天新精细化工开发中心;以上试剂均为分析纯。
1.2 仪器与设备
BS 2000S天平(d=0.01 g):北京赛多利斯天平有限公司;78-1磁力加热搅拌器:常州普天仪器制造有限公司;JP-1000B-2高速多功能粉碎机:浙江永康市久品工贸有限公司;KQ-200VDE双频数控超声波清洗器:昆山市超声仪器有限公司;B250智能数显恒温油水浴锅:上海予卓仪器有限公司;UVmini-1240紫外分光光度计:上海元析仪器有限公司。
1.3 方法
1.3.1 低共熔溶剂的制备
将氯化胆碱与草酸(尿素、异丙醇、丙三醇)等按照一定的摩尔比混合置于锥形瓶中,在恒温水浴锅中,保持温度60℃,搅拌至完全溶解后取出,冷却至(20±2)℃后得到无色透明液体,装入试剂瓶中,(20±2)℃下放置一周后仍为均匀透明的液体[17]。
1.3.2 甘草多糖提取的工艺流程
甘草→粉碎脱脂→加入低共熔溶剂搅拌→混匀静置→超声辅助提取→加入澄清剂→过滤→粗多糖[18-19]
1.3.3 甘草多糖含量测定
采用3,5-二硝基水杨酸比色法测定多糖含量[20]。分别吸取 0.2、0.4、0.6、0.8、1.0、1.2 mL 标准葡萄溶液(100 μg/mL)置于干燥具塞的试管中,分别加蒸馏水至4.0 mL,加入2 mL 3,5-二硝基水杨酸试剂,沸水浴中10 min,取出,流水冷却后,510 nm处测定吸光值。以多糖浓度为横坐标x,测出的吸光度为纵坐标y,绘制多糖标准曲线,得回归方程为:y=0.014 4x-0.009 2(R2=0.991 4)。
1.3.4 甘草多糖提取率的计算
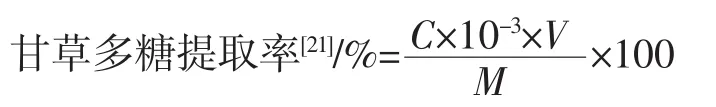
式中:C为回归方程计算得到甘草多糖的浓度,mg/mL;V为定容的体积,mL;M为原材料的质量,g。
1.3.5 确定低共熔溶剂体系
根据计算数值精确称取一定量的氯化胆碱与丙三醇、异丙醇和尿素,按照摩尔比 1∶1、1 ∶2、1 ∶3、2 ∶1、3∶1混合,加入适量的水,进行加热搅拌至完全溶解,直至形成均匀透明的无色液体[22],低共熔溶剂的种类及摩尔比见表1。

表1 低共熔溶剂的种类及摩尔比Table 1 Types and molar ratios of eutectic solvents
1.3.6 甘草多糖提取单因素试验
在提取温度分别为 20、30、40、50、60 ℃,料液比分别为 1 ∶20、1 ∶30、1 ∶40、1 ∶50、1 ∶60(g/mL),超声时间分别为 15、20、25、30、35 min,超声功率分别为 100、150、200、250、300 W的条件下,按照1.3.2的方法,进行提取温度、料液比、超声时间、超声功率4个因素的单因素试验[23-25],考察各因素对甘草多糖提取率的影响。
1.3.7 甘草多糖超声提取的响应面法优化试验设计
在单因素试验基础上,采用响应面优化试验方法,对超声辅助低共熔溶剂提取甘草多糖的影响因素进行研究和条件优化,做出响应面图,建模并分析各因素对响应值的影响。
1.4 数据分析
采用origin软件和Design-Expert软件进行数据分析。
2 结果与分析
2.1 低共熔溶剂体系对甘草多糖提取率的影响
低共熔溶剂是由氢键供体和氢键受体按照一定摩尔比混合而构成,其中氢键受体、氢键供体种类繁多,二者摩尔比不同、体系含水量不同都会影响多糖提取率。本研究以氯化胆碱为氢键受体,考察常见的几种氢键供体对甘草多糖提取率的影响见如图1~图3。
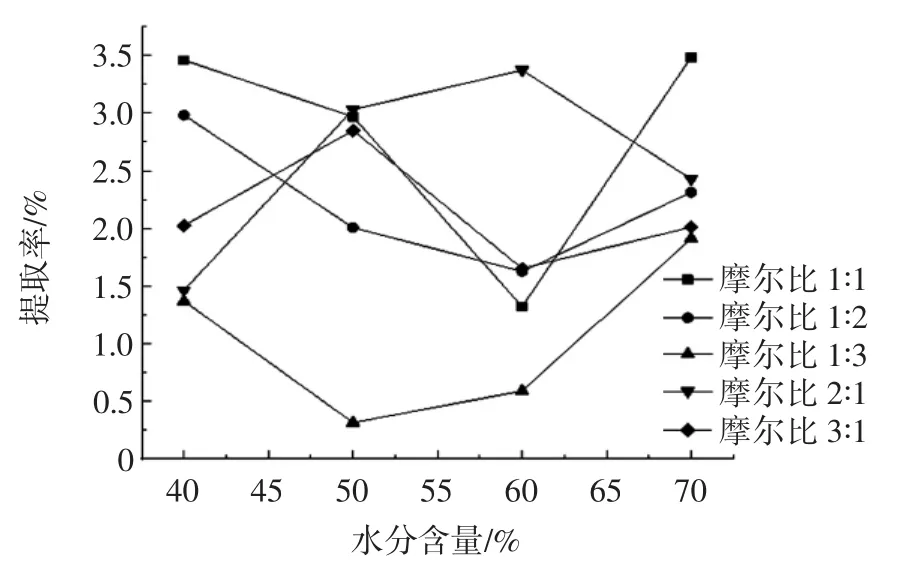
图1 氯化胆碱-丙三醇体系中不同摩尔比对多糖提取率的影响Fig.1 Effect of different mole ratio in choline chloride-glycerol system on polysaccharide extraction rate
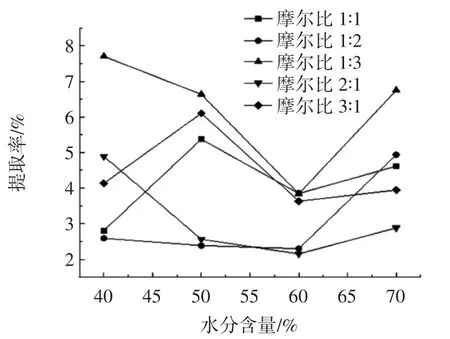
图2 氯化胆碱-异丙醇体系中不同摩尔比对多糖提取率的影响Fig.2 Effect of different mole ratio in choline chloride-isopropanol system on polysaccharide extraction rate
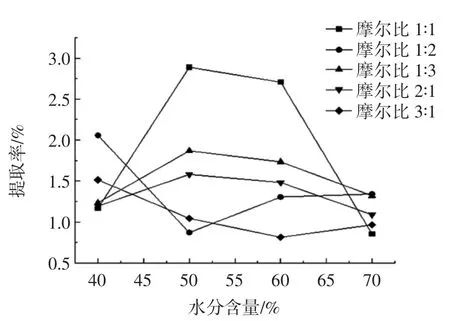
图3 氯化胆碱-尿素体系中不同摩尔比对多糖提取率的影响Fig.3 Effect of different mole ratio in choline chloride-urea system on polysaccharide extraction rate
从图1~图3可知,氢键供体为氯化胆碱,氢键受体为异丙醇,二者摩尔比为1∶3,含水量为40%时的低共熔溶剂体系的多糖提取率最高。这可能是因为多糖为极性大分子,低共熔溶剂极性也相对较大,根据相似相溶原理,可溶解的多糖相应较多;另一方面可能是因为醇类大量羟基的存在,也能加强与多糖的相互作用力,提高多糖提取率,然而,低共熔溶剂黏度会影响多糖的提取率,加入适量水使得溶剂体系黏度降低,溶液流动性增大,可高效快速溶解更多的多糖,提高多糖的提取率[26]。因此选用氢键供体为氯化胆碱,氢键受体为异丙醇,二者摩尔比为1∶3,含水量为40%时的低共熔溶剂体系最适宜。
2.2 甘草多糖提取单因素试验
选取料液比、提取温度、超声时间以及超声功率4个因素做单因素试验,考察各因素对甘草多糖提取效果的影响。
2.2.1 提取温度对多糖提取率的影响
提取温度对多糖提取率的影响见图4。
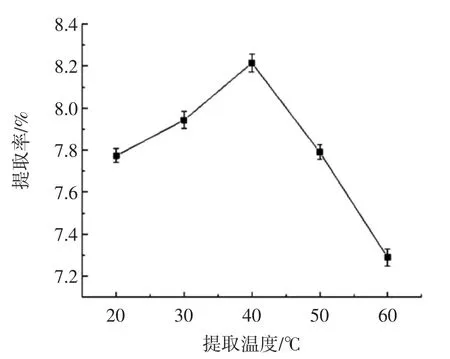
图4 提取温度对多糖提取率的影响Fig.4 Effect of extraction temperature on polysaccharide extraction rate
从图4可知,当提取温度较低时,甘草多糖的提取率随着温度的升高而增大;40℃时多糖提取率最高;之后随着温度的升高,多糖提取率降低。多糖提取率随着温度升高先增加后减少可能是因为随着温度的升高,整个反应体系的反应速度加快,利于多糖物质的溶出,温度进一步升高,使得多糖在低共熔溶剂中的稳定性不高,发生降解而减少。因此提取温度选择40℃。
2.2.2 料液比对多糖提取率的影响
料液比对多糖提取率的影响见图5。
从图5可知,当料液比为1∶50(g/mL)时,多糖提取率最大,之后趋于平稳。可能是因为低共熔溶剂本身为黏稠液体,在一定范围内,随着料液比降低,溶剂与甘草的接触面积增多,超声还起到一定的搅拌作用,多糖的溶出增多,使得多糖提取率增加;而当溶剂过高时,黏稠的低共熔溶剂阻碍了超声波的作用,使超声波不能充分作用于甘草,亦或是提取出的多糖受到过多溶剂的稀释,而使提取率降低。因而,从提取率及成本等方面考虑,料液比以1∶50(g/mL)为宜。
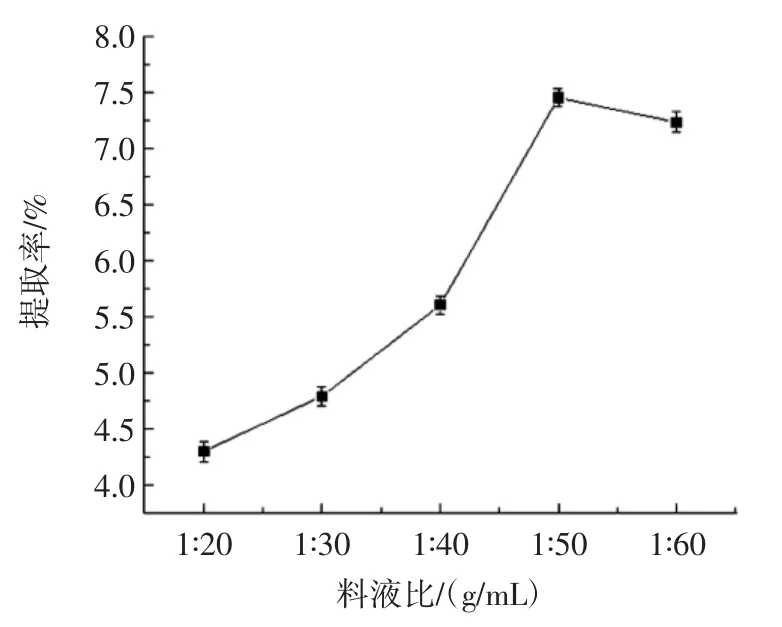
图5 料液比对多糖提取率的影响Fig.5 Effect of solid-liquid ratio on polysaccharide extraction rate
2.2.3 超声时间对多糖提取率的影响
超声时间对多糖提取率的影响见图6。
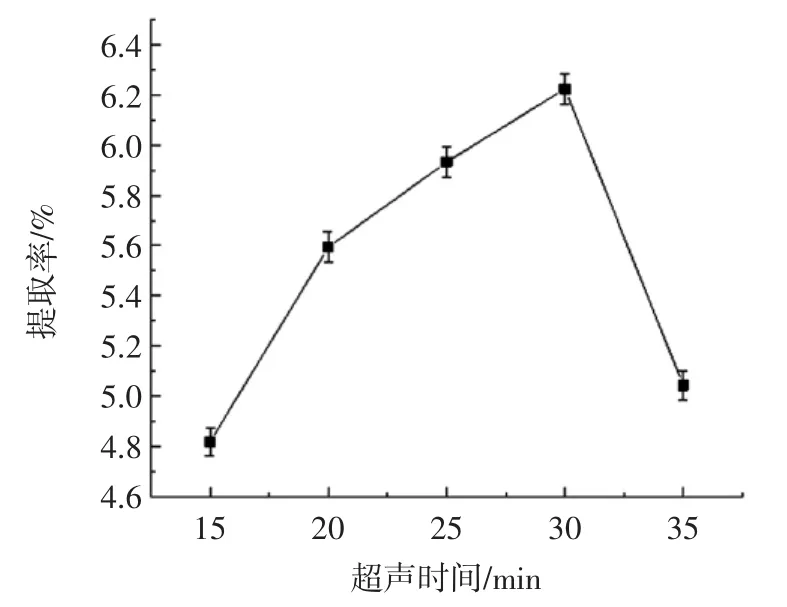
图6 超声时间对多糖提取率的影响Fig.6 Effect of ultrasonic time on polysaccharide extraction rate
从图6可以看出,提取率随着超声时间的增加先缓慢升高后下降,30 min时多糖提取率达到最高。这可能是因为在一定时间范围内,随着超声时间的增加,超声波能充分作用于甘草粉末,破坏其细胞壁,使多糖溶出;但是随着超声时间的进一步增加,超声波使得部分多糖水解,从而使提取率降低。因此,超声时间以30 min为宜。
2.2.4 超声功率对多糖提取率的影响
超声功率对多糖提取率的影响见图7。
由图7可知,多糖的提取率随着超声功率的增加呈现先上升后下降的趋势,功率250 W时的多糖提取率最高。这可能是因为随着功率增加,超声波的强度增加,使得甘草与溶剂充分反应,从而使多糖溶出增加,而功率过高时,可能对多糖类化合物具有破坏作用,使提取率下降。因此,超声功率选择250 W为宜。
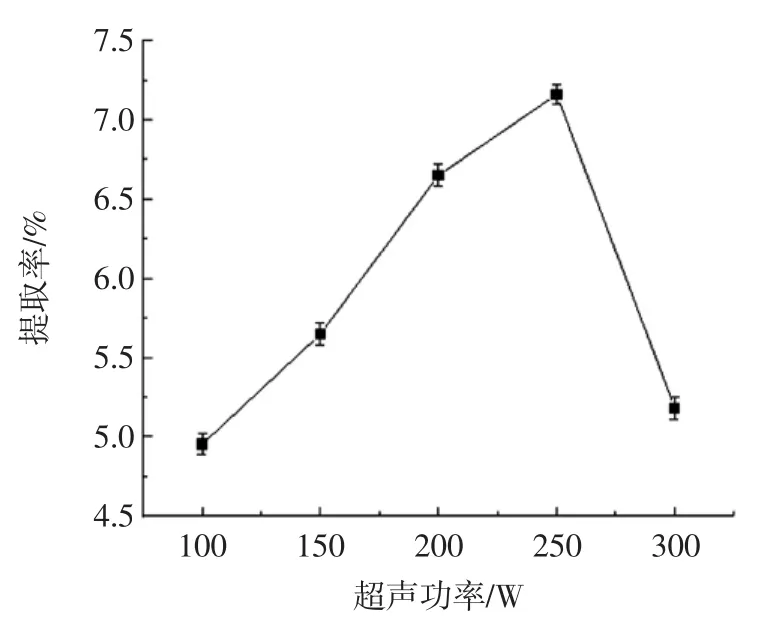
图7 超声功率对多糖提取率的影响Fig.7 Effect of ultrasonic power on extraction rate of polysaccharides
2.3 甘草多糖提取的响应面试验
2.3.1 Box-Behnken试验结果
在单因素试验基础上,选取料液比、提取温度、超声时间、超声功率进行响应面试验。以Box-Benhnken设计的组合变量为自变量,以多糖提取率为响应值,进行多糖提取条件的优化。响应面试验因素和水平设计见表2,响应面试验结果见表3。

表2 Box-Behnken试验因素与水平表Table 2 Box-Behnken experimental factors and level table

表3 响应面试验结果Table 3 Response surface experimental results

续表3 响应面试验结果Continue table 3 Response surface experimental results
利用Design-Expert8.06软件,对表3中的数据进行多元回归模型拟合,获得甘草多糖提取率(Y)对应编码自变量的二次多项式回归方程:Y=8.23-1.04A-0.15B-0.9C+0.14D+0.27AB-1.16AC-0.14AD-0.16BC-0.083BD-0.44CD-2.01A2-2.72B2-3.57C2-1.99D2
响应面二次模型方差分析见表4。
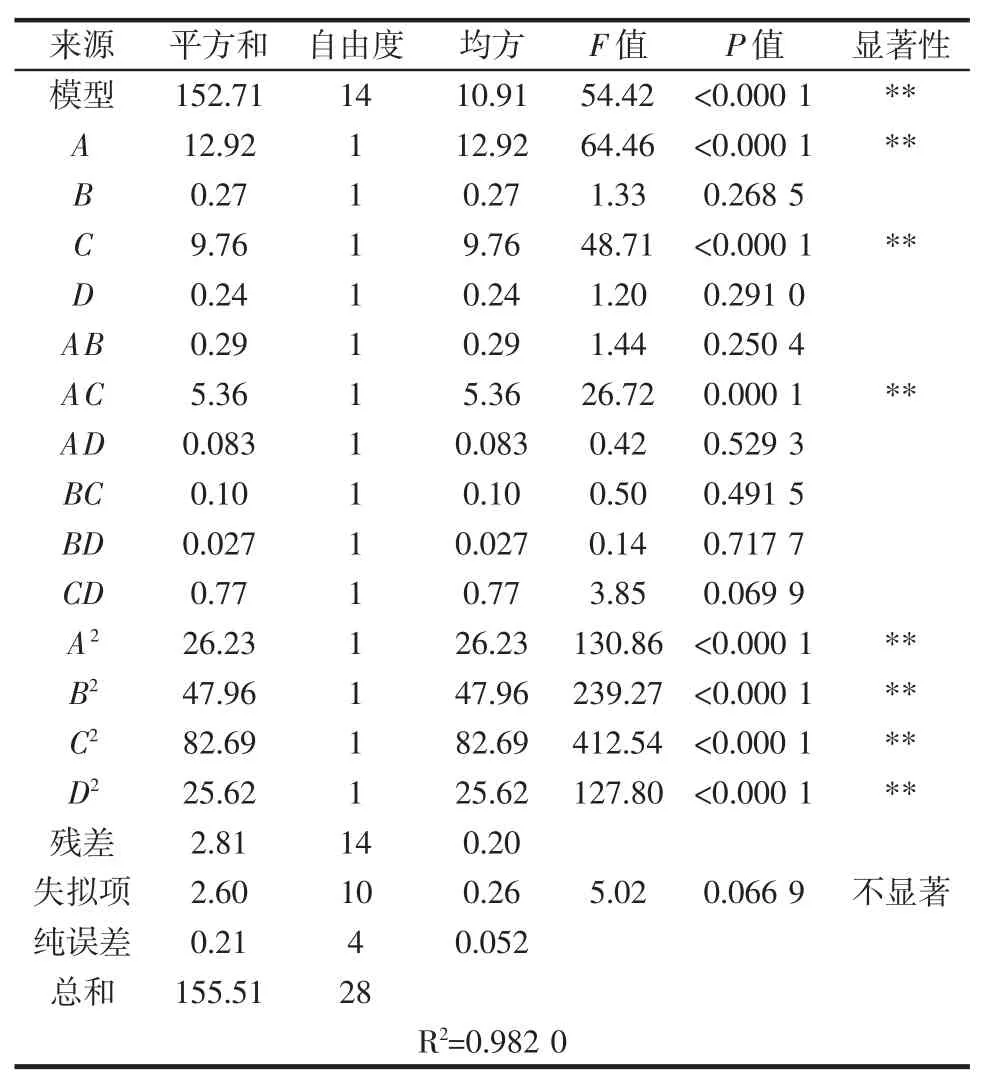
表4 响应面二次模型方差分析Table 4 Analysis of variance of response surface quadratic model
由表 4可知:一次项 A、C 影响极显著(P<0.01);二次项 AC 影响极显著(P<0.01);A2、B2、C2、D2影响极显著(P<0.01);失拟项不显著(P>0.05)。模型 R2=0.982 0,R2Adj=0.963 9,说明该方程与实际情况拟合良好,可以用该回归方程代替试验真实点对试验结果进行分析。根据F值可知各因素对多糖提取率影响程度大小顺序为:超声功率>提取温度>超声时间>料液比。
2.3.2 各个因素相互作用的响应曲面图
响应曲面图可直观地看出各因素交互作用对甘草多糖提取率的影响,若曲线越陡峭,则表明该因素对多糖提取率的影响越大,相应表现为响应值变化的大小。
2.3.2.1 超声功率与超声时间的交互作用
超声功率与超声时间的交互作用对甘草多糖的提取率影响见图8。
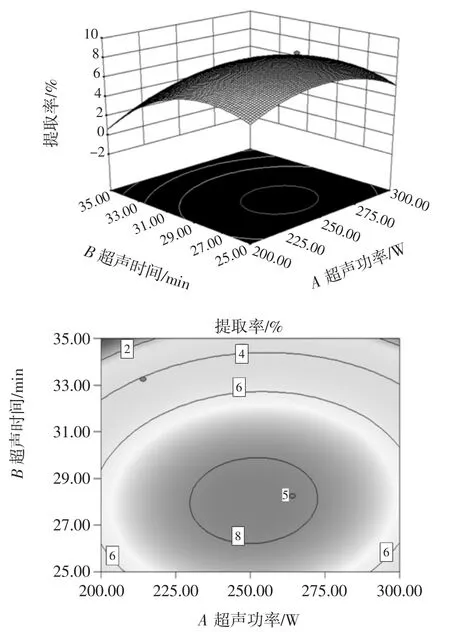
图8 超声功率与超声时间的交互作用Fig.8 Interaction between ultrasonic power and ultrasonic time
由图8可知,随着超声功率和超声时间的增加,多糖提取率呈现先增加后减少的趋势,等高线近似圆形。说明超声功率和超声时间的交互作用对甘草多糖的提取率影响不显著。这是因为随着超声功率与时间的增加,超声波的作用越明显,甘草粉末与溶剂混合的越均匀,接触越多,甘草多糖越快溶出。
2.3.2.2 超声功率与提取温度的交互作用
超声功率与提取温度的交互作用对甘草多糖的提取率影响见图9。

图9 超声功率与提取温度的交互作用Fig.9 Interaction between ultrasonic power and temperature
由图9可知随着超声功率和提取温度的增加,多糖提取率先增加后减少,等高线呈椭圆形,说明超声功率和温度的交互作用对甘草多糖的提取率影响极显著。
2.3.2.3 超声功率与料液比的交互作用
超声功率与料液比的交互作用对甘草多糖的提取率影响见图10。
由图10可知,随着超声功率和溶剂体积的增加,多糖提取率先增加后减少,等高线近似圆形,说明超声功率和料液比的交互作用对甘草多糖的提取率影响不显著。这是因为随着溶剂体积与超声功率的增加,甘草粉末与溶剂充分接触,使多糖溶出加快,提取率升高;当超声功率过高时,可能对多糖类化合物具有破坏作用,故导致了多糖得率下降。因此,选择超声功率为250 W为宜。
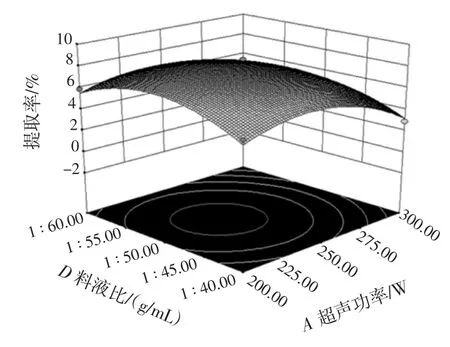
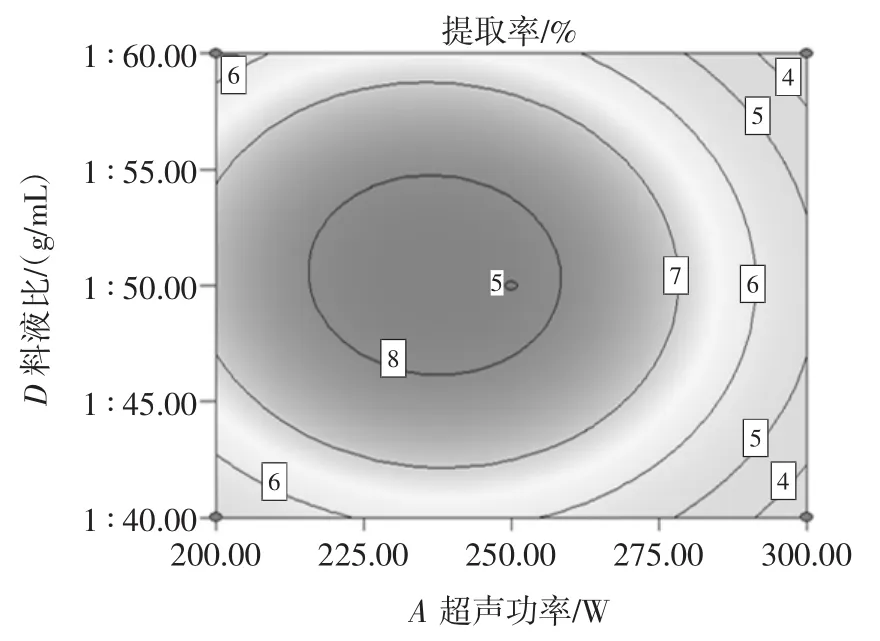
图10 超声功率与料液比的交互作用Fig.10 Interaction between ultrasonic power and material-liquid ratio
2.3.2.4 提取温度与超声时间的交互作用
提取温度与超声时间的交互作用对甘草多糖的提取率影响见图11。
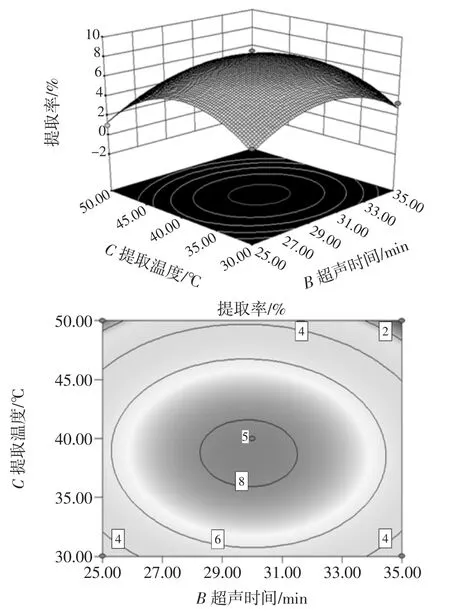
图11 超声时间与提取温度的交互作用Fig.11 Interaction between ultrasound time and extraction temperature
由图11可知,随着超声时间和提取温度的增加,多糖提取率先增加后减少。等高线近似圆形,说明超声时间和温度的交互作用对甘草多糖的提取率影响不显著。
2.3.2.5 超声时间和料液比的交互作用
超声时间和料液比的交互作用对甘草多糖的提取率影响见图12。

图12 超声时间与料液比的交互作用Fig.12 Interaction of ultrasonic time and material-liquid ratio
由图12可知,随着超声时间和溶剂体积的增加,多糖提取率先增加后减少,等高线近似圆形。说明超声时间和料液比的交互作用对甘草多糖的提取率影响不显著。
2.3.2.6 提取温度和料液比的交互作用
提取温度和料液比的交互作用对甘草多糖的提取率影响见图13。
由图13可知,随着温度和溶剂体积的增加,多糖提取率先增加后减少,等高线近似圆形。说明提取温度和料液比的交互作用对甘草多糖的提取率有影响但不显著。
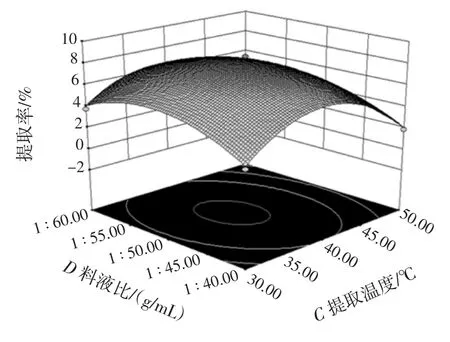

图13 提取温度与料液比的交互作用Fig.13 Interaction between extraction temperature and materialliquid ratio
2.4 验证试验
根据回归方程得出提取率最高的组合为超声功率249.36 W、时间29.81 min、温度39.10℃、料液比1∶50.55(g/mL)时,甘草多糖的理论最高提取率为8.40%。考虑到实际操作的可行性,将提取条件调整为超声功率250 W、时间30 min、温度39℃、料液比1∶50(g/mL)。此时的提取率为8.31%,该值与理论值接近,说明采用响应面法优化甘草多糖提取工艺可行。
3 结论
本研究以甘草为研究对象,以低共熔溶剂作为提取剂,低共熔溶剂体系氢键供体为氯化胆碱,氢键受体为异丙醇,二者摩尔比为1∶3,含水量为40%时,多糖提取率最高。采用超声辅助低共熔溶剂提取其中的多糖,料液比、提取温度、超声温度、超声功率和超声时间对甘草多糖的提取率均有影响。通过单因素试验和响应面试验得出甘草多糖提取的最优条件:超声功率250 W、时间 30 min、温度 39℃、料液比 1∶50(g/mL),此时的提取率为8.31%,此法工艺条件温和,不需要高温高压,多糖的提取率较高,水解和生物分解损失率低。此外,低共熔溶剂是绿色环保天然溶剂,无毒无污染,提取物可以应用于食品、医药等领域,体现了低共熔溶剂提取多糖的优势。
——以高中化学“氢键”的教学为例

