中国罕见病用药可负担性评价*
周盛明,李嘉瑶,周 静,胡 明
(四川大学华西药学院,四川 成都 610041)
罕见病在不同地区有不同定义,世界卫生组织(WHO)将患病率在0.65‰~1‰的单个疾病定义为罕见病[1],美国将患者总人数少于20万的单个疾病定义为罕见病[2],欧盟将发病率低于1/2 000的单个疾病定义为罕见病[3]。根据国际药物经济学与结果研究协会(ISPOR)罕见病特别利益小组(RDSIG)报告,罕见病的全球平均发病率为40/10万~50/10万[4]。现有罕见病已超过6 000种[4]。虽然罕见病发病率低,但全球患者总人数约4亿人[5]。我国目前尚无明确的官方罕见病定义,2018年发布的第一版《第一批罕见病目录》包含了121种罕见病。有研究指出,我国罕见病患者人数已有2 000多万[6]。罕见病发病率低,临床诊断治疗复杂[7],且治疗费用昂贵,给患者家庭及社会带来沉重的疾病负担[8]。我国罕见病患者长期以来面临着可用药品相对不足、药品价格较高的困境[9]。傅孟元等[10]研究了2014年我国982例罕见病患者,92.1%的患者接受了治疗并产生医疗费用支出,其中有98.7%的患者因就医而负债。罕见病用药在罕见病治疗中发挥着举足轻重的作用,且其可负担性问题已成为一个不可忽视的社会问题[11]。基于我国《第一批罕见病目录》目前在我国上市药品的价格和治疗费用,本研究中评价了其相关疾病的可负担性。现报道如下。
1 资料与方法
1.1 药品选择
根据《中国罕见病药品可及性报告2019》,统计时间截至2019年2月,在我国明确注册罕见病适应证的药品有55种,涉及31种罕见病[12];将药品上市信息更新至2019年12月31日,我国已上市且有罕见病适应证的药品60种,涉及罕见病34种。对这60种药品涉及的34种疾病,在中国罕见病信息网和《罕见病诊疗指南(2019年版)》检索疾病发病率,以及在药智网(https://www.yaozh.com/)检索药品中标价格信息,最终得到既有发病率数据又有药品价格信息的治疗16种罕见病的34种药品,均纳入研究药品范围。
1.2 药品价格确定
罕见病用药价格来自药智网发布的药品中标价格信息(统计日期截至2020年1月31日)。药品价格选择和确定原则:1)若某药仅有原研药或仿制药上市,选取单价最低的药品价格;若同时存在原研药和仿制药,则选取所有药品中单价最低的药品价格。2)对于不同剂型的药品,根据药品的用法用量,选取日均费用最低者作为参考价格。
1.3 研究方法与指标
1.3.1 WHO/国际健康行动组织(HAI)标准调查法
WHO/HAI标准调查法是通过计算某药品在标准剂量下为治疗某种疾病所需费用相当于国家政府部门非技术工作人员最低日薪天数[13]。目前,我国贫富差距明显,存在部分居民收入低于政府非技术工作人员的最低日薪[14],如果直接引用其数据会导致药品的可负担性被高估,故引用信枭雄等[15]的以人均收入代替我国政府部门非技术工作人员的最低日薪进行计算。本研究中采用我国2019年城镇居民年人均可支配收入和2019年农村居民年人均纯收入进行计算。另外,因样本罕见病多需要长期用药治疗,故本研究中统一以年为单位进行可负担性计算。年收入倍数(支付年度治疗费用所需工作年数)=年度药品支出/年人均收入。年度药品支出=药品中标单位价格×患者每年所需药品总单位数。
1.3.2 致贫作用评价法
致贫作用评价法可很好表明药品支出对家庭生活的影响水平。如果一个家庭在药品支出前未陷入贫困,产生药品支出后的家庭收入在贫困线以下,就表明该家庭因药品支出而“致贫”[16],即药品的可负担性较差。我国先后采用过3个农村贫困线,现行标准采用2010年的标准(每人每年2 300元)[17]。我国尚无明确的城镇贫困线官方标准。城镇贫困标准通常是根据各地城市最低生活保障线计算,故本研究中以2019年中华人民共和国民政部发布的4个季度的全国城市最低生活保障的均值(每人每年7 772元)作为城镇贫困线进行计算。
致贫率是衡量致贫作用的基本指标,本研究中致贫率采用因患病(考虑疾病发病率)导致贫困人口数量与患病前不贫困人口数量的比值来体现,疾病的致贫人口数量为原本年人均收入高于贫困线但扣除该疾病治疗费用后收入低于贫困线的人口数量。致贫率=患病(考虑疾病发病率)导致贫困人口数量/患病前不贫困人口数量。
1.3.3 灾难性支出评价法
在一定时间内某个家庭的可用资源是固定的,当药品支出超过家庭可用资源的特定百分比时,就会给家庭生活带来重大影响。WHO定义卫生保健支出占比超过家庭可支配收入的40% 为灾难性支出的阈值[18]。一个家庭可用资源的衡量可用家庭消费来体现[19]。由于城乡消费水平存在差距,为了评价药品费用对于不同消费水平人群是否造成灾难性卫生支出,将城镇居民和农村居民的收入分开模拟,且采用国家人口消费模拟曲线来替代家庭收入模拟曲线进行计算[20]。将2012年至2019年城市居民消费价格指数和农村居民消费价格指数分别调整后,再进行曲线模拟家庭可用资源[21]。
灾难性支出发生率为灾难性支出评价的基本指标,本研究中具体为由于药品支出导致发生灾难性支出人口占人口样本总数的比例(考虑疾病发病率)。灾难性支出发生率只能反映发生灾难性支出的密度,而无法体现药品支出对家庭造成影响的深度,通过计算灾难性支出的平均差距和相对差距可得出不同药品支出对家庭的影响深度。设定变量样本含量(N),以药品支出占家庭可支配收入的比例与标准阈值之差为变量(Oi),平均差距(G),相对差距(MPG),按灾难性支出的G,MPG计算公式:

不同国家的居民家庭资源使用规划不尽相同,在WHO建议的40%阈值基础上,通过调整药品支出占比(30%,40%,50%)的方式来进行敏感性分析。
2 结果
2.1 纳入研究的疾病和药品
共纳入16种罕见病,对应34种罕见病用药,并根据国际疾病分类第十一次修订本(ICD-11)对罕见病进行分类。详见表1。
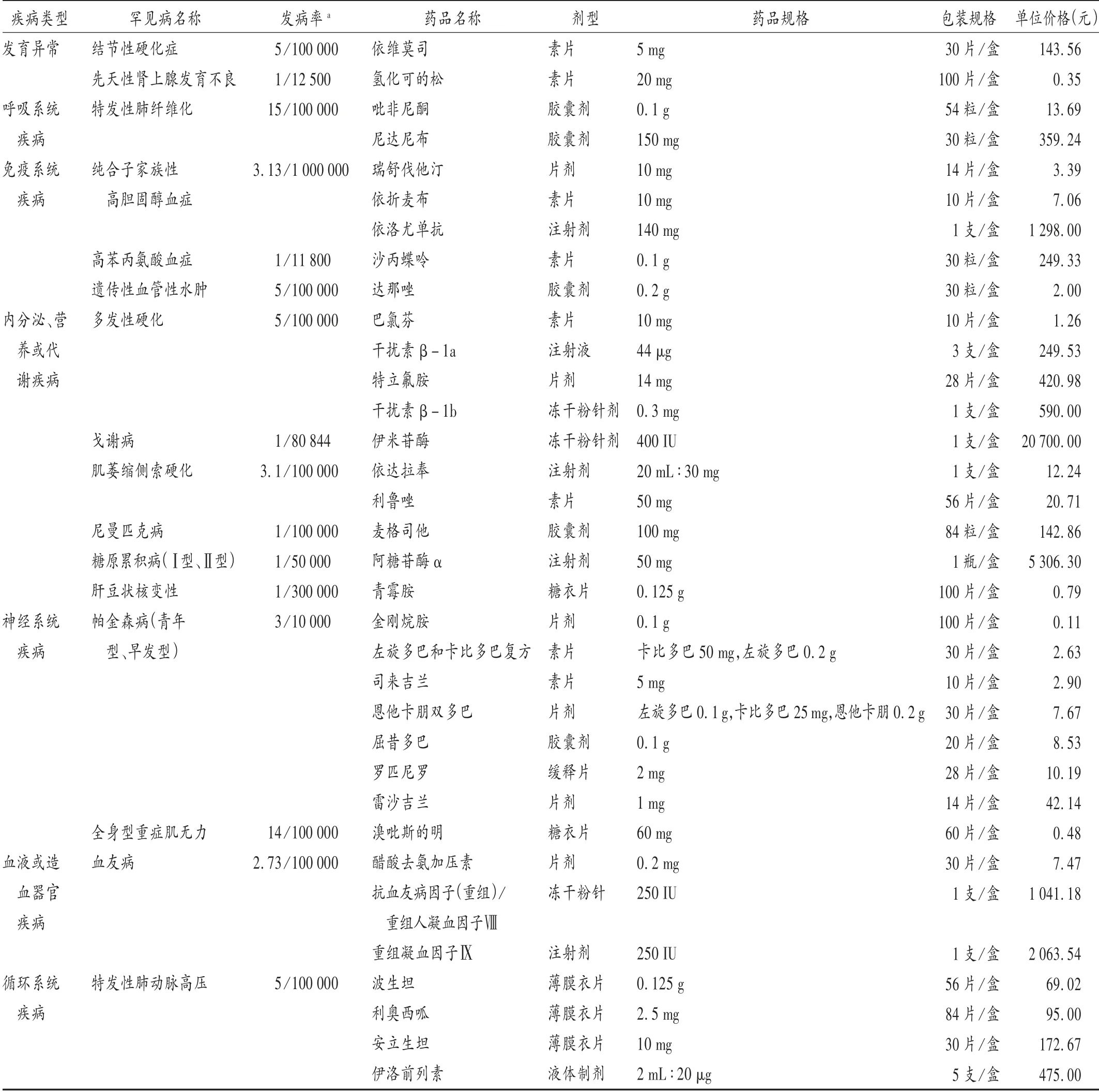
表1 16种罕见病对应的34种罕见病用药信息Tab.1 Information of 34 OMPs corresponding to 16 rare diseases
2.2 WHO/HAI标准调查法
参考WHO/HAI标准调查法,计算出罕见病患者年度药品支出及其相当于年收入的倍数,详见表2。结果显示,对于城镇居民,34种药品中共有16种药品的支出与年收入倍数大于1;农村居民,34种药品中共有19种药品的支出与年收入倍数大于1。在34种药品中,药品支出与年收入倍数最小的3种药品是金刚烷胺、氢化可的松和达那唑,分别用来治疗帕金森病(青年型、早发型)、先天性肾上腺发育不良和遗传性血管性水肿;药品支出与年收入倍数最大的3种药品是伊米苷酶、阿糖苷酶α和重组凝血因子Ⅸ,分别用来治疗戈谢病、糖原累积病(Ⅰ型、Ⅱ型)和血友病。其中,治疗戈谢病的伊米苷酶年度药品支出是城镇居民平均收入的114.67倍,农村居民平均收入的303.17倍。详见表2。

表2 34种罕见病用药的可负担性评价结果(WHO/HAI标准调查法)及致贫率与致贫人口情况Tab.2 Results of affordability evaluation of 34 OMPs according to WHO/HAI standard survey method and the poverty rate and population caused by 34 OMPS
2.3 致贫作用评价法
通过罕见病发病率等相关数据计算出16种罕见病对应的34种罕见病用药的药品支出会导致的贫困人口比例、贫困人口数量。结果显示,16种罕见病在农村和城镇居民中的致贫率皆未超过4/10 000,导致农村居民致贫率超过1/10 000的有3种疾病对应9种药品,城镇居民致贫率超过1/10 000的有2种疾病对应6种药品;致贫率最高的3种药品为治疗帕金森病(青年型、早发型)的屈昔多巴、恩他卡朋双多巴、雷沙吉兰,且屈昔多巴支出导致的贫困人口最多,为16.08万农村居民和15.11万城镇居民;致贫率最低的3种药品为瑞舒伐他汀、依折麦布和青霉胺,前2种用来治疗纯合子家族性高胆固醇血症,青霉胺用来治疗肝豆状核变性。无论是农村居民还是城镇居民,其导致的贫困人口均不超过1 000人。详见表2。

表3 34种罕见病用药的灾难性人口比例与数量及灾难性支出平均差异与相对差异(40%阈值)Tab.3 The proportion and number of catastrophic population,and the average and relative gap of catastrophic expenditure caused by 34 OMPs(40% threshold value)
2.4 灾难性支出评价法
根据WHO组织制订的40% 阈值的标准,计算出16种罕见病,对应34种罕见病用药的药品支出费用会导致的灾难性人口比例、灾难性人口数量、灾难性支出平均差距和相对差距。结果显示,16种罕见病在农村和城镇的灾难性人口比例均未超过4/10 000,导致农村居民灾难性人口比例超过1/10 000的有2种疾病,对应8种药品;城镇居民灾难性人口比例超过1/10 000的有2种疾病,对应6种药品。造成灾难性支出人口比例最高的3种药品为屈昔多巴、恩他卡朋双多巴、雷沙吉兰,均用于治疗帕金森病(青年型、早发型),这些支出会导致16.55万农村居民发生灾难性支出及22.82万、21.78万、21.01万城镇居民产生灾难性支出。造成灾难性人口比例最低的是瑞舒伐他汀、依折麦布、青霉胺,其中前2种用于治疗纯合子家族性高胆固醇血症,青霉胺用来治疗肝豆状核变性,其导致的灾难性人口数量皆不超过1000人,详见表3。灾难性支出平均差距最大的3种药品分别为阿糖苷酶α、伊米苷酶和重组凝血因子Ⅸ,分别用来治疗糖原累积病(Ⅰ型、Ⅱ型)、戈谢病和血友病,且相对差距也最大,详见表3。另外,调整阈值为30%和50%进行计算的结果与阈值为40%的结果基本无变化。
3 讨论
3.1 罕见病用药可负担性情况
WHO/HAI标准调查法结果显示,对于所有居民,34种药品中有近1/2的药物年药品支出高于年人均收入,如果无其他收入来源,罕见病用药的支出负担是相对沉重的,且因农村居民收入水平较低,负担较城镇居民更沉重。致贫作用评价法得出,虽然16种罕见病在农村和城镇的致贫率均未超过4/10 000,但如果计算致贫的人口总数,以上16种疾病会导致全国超过268万人口(包括农村居民和城镇居民)陷入贫困。灾难性支出评价法可得出在34种药物中,帕金森病(青年型、早发型)造成的灾难性支出人口比例最高,虽然治疗帕金森病(青年型、早发型)的药品单价并非最高,但因该病的发病率高,故人口比例也越高;灾难性支出平均差距和相对差距最大的3种药品(阿糖苷酶α、伊米苷酶和重组凝血因子Ⅸ)对应的单价也最高,表明药品价格高昂依旧是造成疾病负担沉重的因素之一。国际罕见病用药可负担性情况类似,欧洲现有的罕见病患者每年所需治疗费用为1251~407 631欧元[22],其中间值为每年32 242欧元。全球范围内罕见病用药的人均年度费用远高于非罕见病用药的治疗费用,为4.8倍[23]。
3.2 罕见病负担城乡居民差异和高负担药品分析
农村居民比城镇居民的疾病负担更重,但城镇居民的致贫人口和灾难性支出人口数量比农村居民多。这是因为农村居民的收入普遍比城镇居民低,疾病造成的负担影响更重;城镇居民人口数量多于农村居民,按2019年国家统计局统计,农村居民55 162万,城镇居民84 843万,故城镇的整体罕见病患病数量较多,致贫人口和灾难性支出人口数量更多。3种评价方法的结果都显示,治疗戈谢病的伊米甘酶、治疗糖原累积病(Ⅰ型、Ⅱ型)的阿糖甘酶α和治疗血友病的重组凝血因子Ⅸ这3种药品均会给患者带来沉重负担。其中,血友病是一组性联隐性遗传出血病,临床分为血友病A和血友病B 2种类型,替代疗法是目前唯一有效治疗血友病的方法[24]。治疗涉及的抗血友病因子(重组)/重组人凝血因子Ⅷ和重组凝血因子Ⅸ价格均较高,抗血友病因子(重组)/重组人凝血因子Ⅷ年度药品费用支出超过城镇居民年人均收入的25倍及农村居民年人均收入的70倍,重组凝血因子Ⅸ年度药品费用超过城镇居民年人均收入的45倍及农村居民年人均收入的125倍,反映了血友病患者承受的巨大经济压力。
3.3 可负担性评价方法在罕见病用药评价中的应用
3种评价方法的结果显示,16种疾病的可负担性相互差异较大,但同一罕见病用药对于不同居民的负担结果影响类似。致贫评价法和灾难性支出评价法得出的致贫率最高和最低与灾难性人口比例最高对应的疾病和药品相同,一方面表明这2种评价方法的相互一致性,另一方面也表明了帕金森病(青年型、早发型)对居民的影响较大。XIN等[25]在2016年对中国罕见病进行了可负担性评价,采用德尔菲法筛选出7种罕见病进行研究,得出特发性肺纤维化和肺动脉高压等7种罕见疾病导致我国近46万人陷入贫困。GONG等[2]对中国罕见病用药进行了可获得性和可负担性研究,以医院药房的价格为基准进行计算,发现中国多数居民都负担不起血友病等14种罕见疾病的22种孤儿药品费用。本研究中基于疾病发病率和药品最低价格信息对《第一批罕见病目录》中数据可得的所有罕见病和药品进行了全面分析,避免了疾病筛选不清晰和药品价格不确定的因素,且综合采用3种方法对我国罕见病用药疾病负担进行了系统性评价。
3.4 研究局限性
本研究中采用的评价方法有一定局限性。参考WHO/HAI标准调查法采用人均年收入来衡量罕见病用药的可负担性,虽已将城镇居民和农村居民进行了区分,但我国城镇居民和农村居民内部贫富差距仍较大,通过平均收入方式计算的结果在数值上不能真实反映客观情况,这样会导致结果不准确;致贫作用评价法中忽略了一些因为无法承担药品费用而放弃治疗的人群,这会导致高估罕见病用药的可负担性,且现实生活中有些家庭会向亲朋好友借钱,这样家庭的致贫情况会被低估,而罕见病用药的可负担性会被高估。灾难性支出评价法虽进行了分级计算,减小了差异化的误差,但在应用分级曲线时,假设各级别内收入分布呈线性增长,依据现实中财富分布的二八定律,低收入人群的人口比例相对较高,这会导致低估药品的可负担性。另外,本研究的计算基于患者患病后收入仍不变的假设,但实际上一些患者会因患病失去劳动能力,失去部分收入,这样会导致其负担能力被高估。最后,本研究中在使用这3种方法时,默认全部药品支出都由患者个人承担,未考虑多方共付机制。目前,部分罕见病用药已纳入全国及地方医保覆盖范围,其结果会低估这些患者的可负担性情况。
3.5 建议
现阶段,我国罕见病用药在不同疾病间、城乡居民间存在较大差异,但总体可获得性和可负担性情况较差。我国近年已采取一系列政策措施,如加快创新性罕见病用药注册审批等,激励罕见病用药的研发和注册上市;同时也在医保准入、药品招标采购使用等方面加大了罕见病用药保障力度。为进一步提高罕见病用药的可负担性,建议结合罕见病疾病和药品特点,参照国际经验,研究完善罕见病用药医保谈判/准入的卫生技术评估方法和标准,提高罕见病医疗保障的可及性。另一方面,建议及时总结目前我国青岛、广州、成都等地区试点的“多方共付[26]”,以及上海、湖南、长春等地区试点的“慈善救助[27]”等成功经验,探索统筹地区医疗救助、商业保险、医保门诊特病等多层次医疗保障机制。

