黄体酮联合地塞米松对胎膜早破孕妇分娩时间及母婴结局的影响*
陈惠娇,李 慧,冯少涓,吴冬琼
(1.海南省澄迈县人民医院妇产科,海南 澄迈 571900; 2.海南医学院第一附属医院产科,海南 海口 570100)
胎膜早破是指临产前胎膜自然破裂,临床表现为无征兆阴道排液,不仅可诱发早产,还易增加孕产妇宫内感染及产褥感染风险,严重影响预后[1]。糖皮质激素类药物地塞米松可有效促进胚胎成熟[2],可加强胎盘内促肾上腺皮质激素释放激素(CRH)的促宫缩作用,缩短分娩时间,增加了新生儿不良事件发生风险,存在使用限制[3]。黄体酮为孕激素,不仅可纠正内分泌紊乱,还可抑制地塞米松的促分娩发动作用,有利于延长孕周[4]。临床已有关于两药联用对分娩时间影响的报道,但未观察其母婴结局[5]。本研究中探讨了黄体酮联合地塞米松对胎膜早破孕妇分娩时间及母婴结局的影响。现报道如下。
1 资料与方法
1.1 一般资料
纳入标准:符合《妇产科学(第9版)》[6]有关胎膜早破诊断标准;对本研究拟用药物不过敏。本研究经医院医学伦理委员会批准,患者签署知情同意书。
排除标准:存在宫缩、宫颈管展平、宫口张开;严重肝、肾功能不全;多胎;合并血栓性静脉炎、肺栓塞疾病。
病例选择与分组:选取海南省澄迈县人民医院2019年3月至2020年3月收治的胎膜早破孕妇120例,按随机数字表法分为对照组和观察组,各60例。两组孕妇一般资料比较,差异无统计学意义(P>0.05),具有可比性。详见表1。

表1 两组孕妇一般资料比较(n=60)Tab.1 Com parison of the pregnant women′s general data between the two groups(n=60)
1.2 方法
两组孕妇均予抗感染、保胎等基础治疗,并予地塞米松磷酸钠注射液(辰欣药业股份有限公司,国药准字H 37021969,规格为每支1 mL∶5 mg)肌肉注射,每次6mg,每12 h 1次。观察组孕妇加用黄体酮注射液(天津金耀药业有限公司,国药准字H12020534,规格为每支1mL∶10mg)肌肉注射,每次20mg,每12 h 1次。
1.3 观察指标
分娩时间:观察自破膜至新生儿娩出的时间。
炎性因子:分别于治疗前、治疗后48 h,采集静脉血5mL,3 000 r/min离心10min,取上清液,采用双抗体夹心酶联免疫吸附法(试剂盒购自上海臻科生物科技有限公司)测定患者血清中肿瘤坏死因子-α(TNF-α)、白细胞介素2(IL-2)水平,采用增强化学发光法(试剂盒购自上海一研生物科技有限公司)测定降钙素原(PCT)水平,采用化学发光免疫分析法(试剂盒购自武汉明德生物科技股份有限公司)测定C反应蛋白(CRP)水平。严格按试剂盒说明书操作。
疾病相关指标:分别于治疗前、治疗后48 h,采集静脉血2mL,采用宝灵曼BM830型全自动血细胞分析仪(潍坊嘉松医疗器械有限公司)检测白细胞计数(WBC),采用放射免疫法(试剂盒购自上海将来实业股份有限公司)测定CRH水平。
母婴结局:记录孕妇妊娠终止方式(顺产、助产、剖宫产)及母婴结局[孕妇并发症(产褥感染、产后出血、羊膜腔感染)、新生儿不良事件(肺部感染、胎儿窘迫、死亡)、新生儿体质量、新生儿阿波卡(Apgar)评分]。胎儿宫内窘迫标准为新生儿心率≥160次/分,或≤110次/分。于胎儿娩出1min及5min后采用新生儿Apgar评分[7]评估,按胎儿出生后的皮肤颜色、心率、呼吸、肌张力及对外界的反射5项进行评分,得分8~10分为正常。
1.4 统计学处理
采用SPSS19.0统计学软件分析。计数资料以表示,行t检验;计数资料以率(%)表示,行χ2检验或Fisher精确概率检验。P<0.05为差异有统计学意义。
2 结果
结果见表2至表5。观察组孕妇分娩时间为(86.25±7.45)h,显著长于对照组的(56.25±4.25)h(P<0.05)。
表2 两组孕妇TNF-α,IL-2,PCT,CRP水平比较(±s,n=60)Tab.2 Comparison of TNF-α,IL-2,PCT and CRP levels between the two groups(±s,n=60)
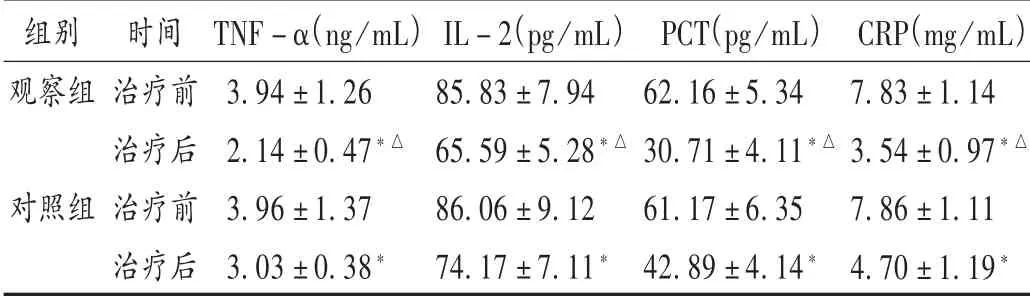
表2 两组孕妇TNF-α,IL-2,PCT,CRP水平比较(±s,n=60)Tab.2 Comparison of TNF-α,IL-2,PCT and CRP levels between the two groups(±s,n=60)
注:与治疗前比较,*P<0.05;与对照组治疗后比较,△P<0.05。表3同。Note:Compared with those before treatment,* P<0.05;Compared with that in the control group after treatment,△P<0.05.
组别观察组对照组时间治疗前治疗后治疗前治疗后TNF-α(ng/mL)3.94±1.26 2.14±0.47*△3.96±1.37 3.03±0.38*IL-2(pg/mL)85.83±7.94 65.59±5.28*△86.06±9.12 74.17±7.11*PCT(pg/mL)62.16±5.34 30.71±4.11*△61.17±6.35 42.89±4.14*CRP(mg/mL)7.83±1.14 3.54±0.97*△7.86±1.11 4.70±1.19*
表3 两组孕妇CRH和WBC水平比较(±s,n=60)Tab.3 Com parison of CRH and WBC levels between the two groups(±s,n=60)

表3 两组孕妇CRH和WBC水平比较(±s,n=60)Tab.3 Com parison of CRH and WBC levels between the two groups(±s,n=60)
组别观察组对照组时间治疗前治疗后治疗前治疗后CRH(ng/mL)23.75±3.25 24.15±6.51△23.36±3.48 52.36±5.26 WBC(×109/L)5.53±0.89 5.91±0.97 5.56±0.94 6.01±0.98
表4 两组孕妇顺产、助产、剖宫产情况比较[例(%),n=60]Tab.4 Com parison of spontaneous delivery,m idwifery and cesarean section between the two groups[case(%),n=60]
3 讨论
胎膜早破多发生于妊娠中晚期,国外发病率为5%~15%,国内发病率为2.7%~7.0%,其不仅可诱发早产,还可增加孕产妇各类并发症发生风险,尤其是未足月胎儿,考虑其胚胎发育不完全,一旦胎膜早破较易发生胎儿宫内窘迫等症状,从而死亡[8-9]。其发病机制尚未明确,考虑与创伤、宫颈口松弛、胎膜发育不良等有关。地塞米松作为糖皮质类激素,可有效促进胎肺成熟,利于降低新生儿不良事件发生率[10],还可调节妊娠分娩,促进宫缩及分娩,导致分娩时间缩短,增加早产风险[11]。
孕产妇子宫基层及胎盘等部位存在CRH相应受体,妊娠情况下CRH水平较低,分娩时呈高亲和状态,其水平显著升高,促进前列腺素释放,引发强烈宫缩,最终启动分娩[12-13]。童重新等[14]研究发现,地塞米松对早期未足月胎膜早破孕妇起到理想促胎肺成熟作用的同时,还易缩短分娩时间,治疗后的新生儿呼吸窘迫综合征发生率可达25.6%。徐漫飞等[15]的研究显示,胎膜早破者与非胎膜早破者相比,CRH浓度有显著差异,且该指标可作为早产的预测指标。本研究结果显示,观察组孕妇治疗后的分娩时间明显长于对照组,且CRH水平明显低于对照组,证实单用地塞米松确实可导致CRH水平的升高,与文献[16]报道一致。地塞米松单用时促使宫缩频率加快,胎盘滋养细胞及mRNA表达增加,导致外周血CRH水平显著上升,引起前列腺素物质的大量合成及释放,最终缩短了孕妇分娩时间。联合黄体酮后,孕妇的CRH水平升高趋势得到明显控制,可能是因为胎盘滋养细胞上存在糖皮质激素受体,而不存在黄体酮受体,使用黄体酮后抑制了胎盘滋养细胞上CRHmRNA的表达及多肽的分泌,且黄体酮与糖皮质激素类药物可竞争性结合,抑制CRH水平的上升,从而适当延长孕周。
随着研究的不断深入,越来越多的报道指出,外周血血清炎性细胞因子与新生儿围产期感染率及胎膜早破发生风险具有显著预测意义,考虑与炎性因子对绒毛膜-脱膜的破坏作用及分娩时机体的应激反应有关,尽早进行相关指标水平检测可辅助判断胎膜早破及新生儿围产期感染情况[17]。目前,炎性细胞因子的选择存在一定分歧,本研究中选取TNF-α,IL-2,PCT,CRP等常见炎性因子作为观察指标,其中TNF-α及IL-2水平过高将导致宫腔状态及局部组织受损,属临床常用检测指标,对于感染性疾病的早期预测具有重要意义[18]。本研究结果显示,观察组孕妇治疗后的炎性因子水平更低,表明两药联用更有利于抑制炎性反应,考虑可能与两药的协同作用有关。观察组新生儿1min及5min Apgar评分均明显高于对照组,可能是因为本研究中观察对象孕周均未满37周,新生儿胚胎未发育完全,较易因孕周等影响预后,联合用药更有利于新生儿发育。
综上所述,黄体酮联合地塞米松可有效抑制胎膜早破孕妇CRH的分泌,降低炎性因子水平,相对延长分娩时间,从而提高新生儿Apgar评分。

表5 两组孕妇并发症、新生儿不良事件、新生儿体质量、新生儿Apgar评分比较(n=60)Tab.5 Com parison ofmaternal comp lications,neonatal adverse events,neonatal body mass and neonatal apgar score between the two groups(n=60)

