血清颗粒蛋白前体作为潜在肝癌诊断标志物的临床价值研究
杨莹,郑芳芳,谢成勇,周钢桥
肝细胞癌(hepatocellular carcinoma, HCC)简称肝癌,是我国最常见的恶性肿瘤之一,其发病率位居我国恶性肿瘤第3位,致死率位居第2位,仅次于肺癌[1]。流行病学和实验研究均表明,病毒性肝炎与肝癌的发生发展密切相关[2]。肝癌具有发病隐匿、恶性程度高、预后较差的特点[3]。肝癌早期的临床症状一般并不明显,因此,诊断发现时绝大多数已经发展到晚期,治疗困难且预后差。血清肿瘤蛋白标志物的检测是临床诊断肝癌的重要方法之一,目前被人们熟知的HCC标志物包括甲胎蛋白(alpha-fetoprotein,AFP)、α-L-岩藻糖苷酶和γ-谷氨酰转移酶等[4]。其中,AFP作为肝癌早期诊断标记物已被广泛使用多年,是目前用于肝癌诊断的最佳血清蛋白标志物[5]。但是,部分肝癌患者中的AFP水平并不升高;此外,在其他类型的肝脏疾病中,如肝硬化(liver cirrhosis, LC)和慢性乙型肝炎(chronic hepatitis B, CHB)患者等,AFP的水平也可能升高[5]。因此,AFP用于肝癌诊断的敏感性和特异性欠佳,导致早期HCC的确诊率较低,易出现漏诊或误诊,临床应用价值受限[6-7]。因此,寻找新的肝癌诊断生物标志物,具有重要的医学意义。
颗粒蛋白前体(progranulin, PGRN),也称颗粒状上皮前体(granulin-epithelin precursor, GEP),是一种分泌性糖蛋白,也是肿瘤坏死因子受体的配体[8]。PGRN可作为生长因子,在早期胎儿发育、成人组织修复、炎症和肿瘤发生等多种病理生理过程中发挥重要作用[9-10]。在多种组织器官中,如皮肤组织、女性生殖器官以及胃肠道系统等,均有PGRN蛋白的表达[11]。有研究发现,PGRN蛋白在乳腺癌、卵巢癌、神经母细胞瘤及肾癌等侵袭性肿瘤细胞株[12-13],以及卵巢癌和乳腺癌等肿瘤组织中异常高表达[14-15],提示PGRN具有作为肿瘤标志物的临床应用潜力。既往研究还发现,在HCC患者肿瘤组织中,PGRN的mRNA表达显著高于正常肝组织[16]。此外,PGRN可促进肝癌细胞的生长和侵袭[17]。本研究旨在通过测定HCC患者及非HCC人群血清中PGRN的表达水平,探讨其与HCC的临床病理特征的关系,以及作为HCC诊断血清标志物的潜在临床应用价值。
1 对象与方法
1.1 研究对象
本项研究招募50例HCC患者(HCC组),以及性别、年龄与HCC组相匹配的30例正常对照个体(NC组)、20例肝硬化(liver cirrhosis, LC)患者(LC组)和20例慢性乙型肝炎(chronic hepatitis B, CHB)患者(CHB组)。上述个体于2017年12月至2018年1月招募自江苏省南京市的中国人民解放军第八一医院。HCC患者术前未接受过放疗、化疗以及其他治疗,临床诊断符合中国抗癌协会肝癌专业委员会制定的《原发性肝癌的临床诊断与分期标准》[18],并经术后病理学检查证实;CHB的诊断标准是:血清乙型肝炎病毒DNA阳性、丙氨酸转氨酶(alanine transaminase,ALT)或天冬氨酸转氨酶(aspartate transaminase,AST)显著升高、乙型肝炎病毒表面抗原(HBsAg)和核心抗体(HBcAb)阳性持续6个月以上。LC的诊断由临床、组织学、生化或放射学的结果确定[19]。每例HCC患者均进行了跟踪随访。所有研究对象均签署了知情同意书,本研究经过北京放射医学研究所医学伦理委员会批准。
1.2 主要仪器
包括纯水仪(Thermo Fisher)、无菌超净台(北京哈东联)、离心机(Eppendorf 5810R)、酶联免疫监测仪(TECAN)、-80 ℃超低温冰箱(海尔)、微量移液器(Eppendorf)和EP无菌管(Thermo)等。
1.3 方法
1.3.1 血清样本的采集 采集研究对象的外周静脉血5 ml,置于抗凝采血管中,4 ℃条件下3 000×g离心10 min(若上层液混浊,需要再次离心),取上层的血清分装入EP无菌管中,编号后置入-80 ℃超低温冰箱保存。检测前避免反复冻融,直至实验开始前解冻并调整至室温。
1.3.2 血清中PGRN和AFP蛋白含量的测定 采用酶联免疫吸附法检测。使用酶联免疫监测仪(瑞士TECAN公司),采用人血清PGRN(美国R&D公司,批号DPGRN0)以及AFP(台湾Abnova公司,批号KA0202)的ELISA检测试剂盒,按其操作步骤进行。在450 nm波长处测量各样品孔的光密度(Optical density,OD)值,绘出标准曲线,根据各样品的OD值查出相应样品的浓度。
1.3.3 基因表达谱数据的下载和分析 为探索PGRN的表达在肝癌组织和癌旁组织中是否存在显著差异,本研究从基因表达综合数据库(gene expression omnibus, GEO)(http://www.ncbi.nlm.nih.gov/GEO/)中下载了2个HCC的基因表达谱数据集(GSE55092和GSE121248)。上述2个数据集的样本均使用Affymetrix Human Genome U133 Plus 2.0 Array芯片检测mRNA表达。获取肝癌组织和癌旁组织中PGRN的mRNA表达数值后,使用Mann-Whitney U检验分析2组间PGRN的表达是否存在显著差异。
1.4 统计学处理
绘制受试者工作特征曲线(receiver operating characteristic curve,ROC),计算最佳含量截断点、敏感度、特异度和曲线下面积(area under the curve,AUC)并伴随95%置信区间(confidence interval,CI),诊断的最佳含量截断点通过将敏感性和特异性之和最大化,并将最佳含量截断点与ROC曲线左上角的距离最小化来确定。灵敏度=[真阳性例数/(真阳性+假阴性)例数]×100%,特异度=[真阴性例数/(真阴性+假阳性)例数]×100%。采用SPSS 20.0软件对数据进行统计学分析。当数据符合正态分布时,采用均值±标准差(x±s)表示;不符合正态分布则采用中位数(下四分位数~上四分位数)表示。2组独立样本间均数的比较采用Mann-Whitney U检验,可视化采用GraphPad(v7)完成。采用卡方检验分析PGRN水平与临床病理特征间的相关性。计数资料以例数或率(%)表示。P<0.05表示差异具有统计学意义。
2 结果
2.1 PGRN在肝癌组织中的表达
从GEO数据库中下载2个HCC组织和癌旁肝组织的基因表达谱数据集(GSE55092和GSE121248)。GSE55092中包含了49例HCC组织和91例癌旁肝组织,GSE121248包含了70例HCC组织和37例癌旁肝组织。Mann-Whitney U检验分析显示,这2个数据集的HCC组织中PGRN的mRNA表达水平均显著高于癌旁肝组织(P<0.05)见图1。这提示PGRN有可能是HCC的候选诊断标志物。
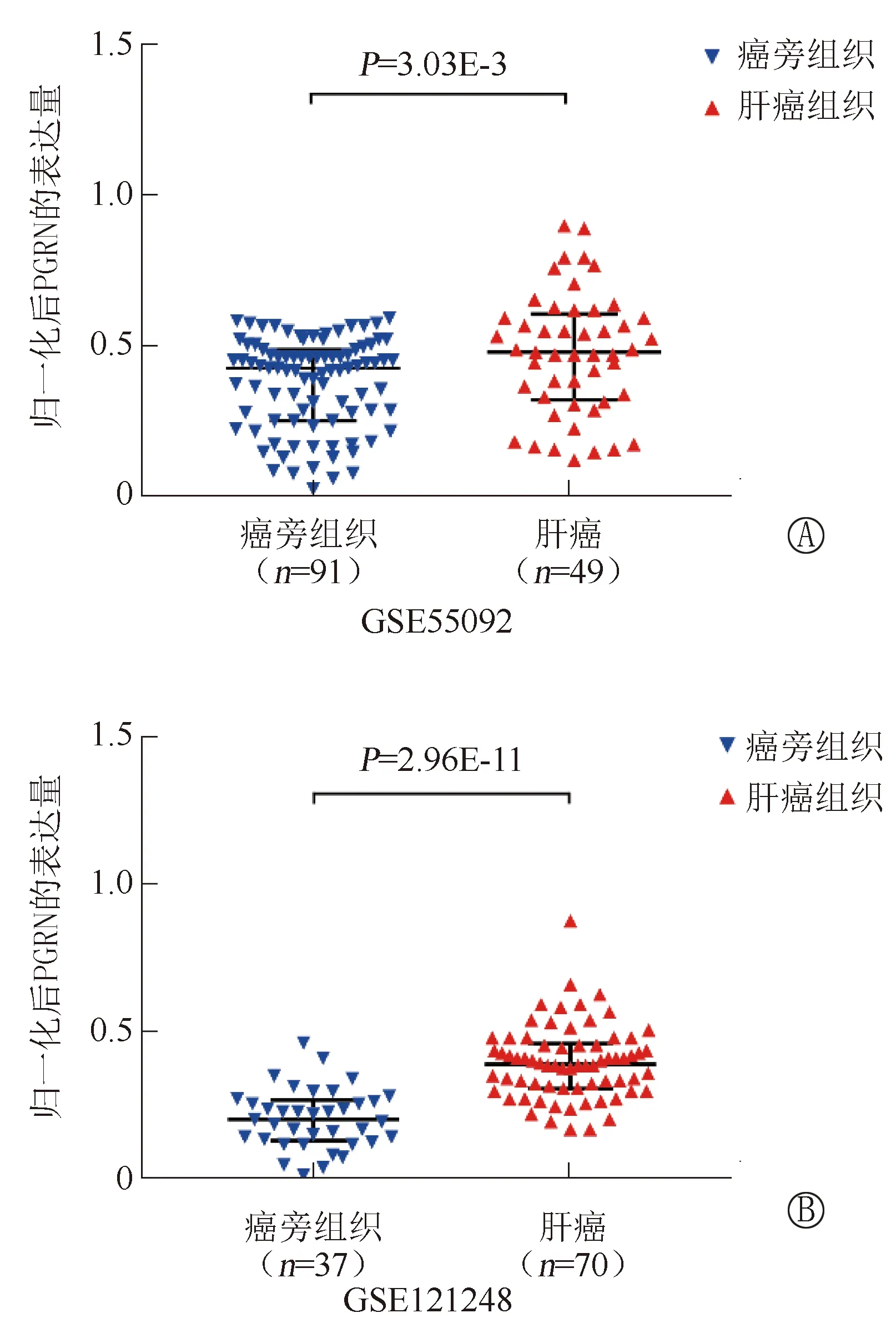
注:A为GSE55092中PGRN表达的差异分析,B为GSE121248中PGRN表达的差异分析。黑色的水平线表示中位数或四分位数间距;P值为Mann-Whitney U检验结果,P<0.05被认为差异有统计学意义。采用min-max法对PGRN的表达量进行了归一化。GEO为基因综合表达数据库,PGRN为颗粒蛋白前体图1 GEO数据集中PGRN在肝癌组织和癌旁组织中的表达差异分析
2.2 招募的研究对象及其基本特征
各组年龄比较差异无统计学意义(P>0.05);以年龄中位数53岁分层,并进行卡方检验,各组相比差异无统计学意义(P>0.05)。HCC组的性别分布比例与NC组、CHB组和LC组相比差异无统计学意义(P>0.05)。见表1。

表1 招募的研究对象基本特征(例)
2.3 各组样本中PGRN和AFP的血清浓度水平
正态性检验结果显示,AFP和PGRN浓度水平不符合正态分布,使用M(P25~P75)描述数据。结果发现,HCC组的血清AFP水平显著高于NC组和LC组,差异均有统计学意义(均P<0.05);HCC组的血清PGRN水平显著高于NC组、LC组和CHB组44.94 (34.03~70.17) ng/ml,差异均有统计学意义(均P<0.05)。见表2和图2。上述结果进一步提示,PGRN可能是候选的HCC诊断血清标志物。
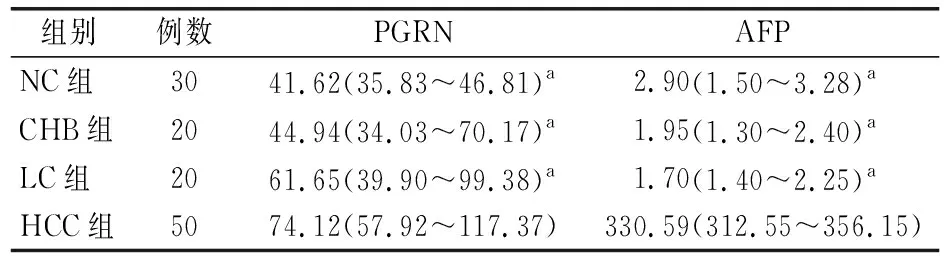
表2 各组样本中血清PGRN和AFP的水平[ng/ml, M(P25~P75)]
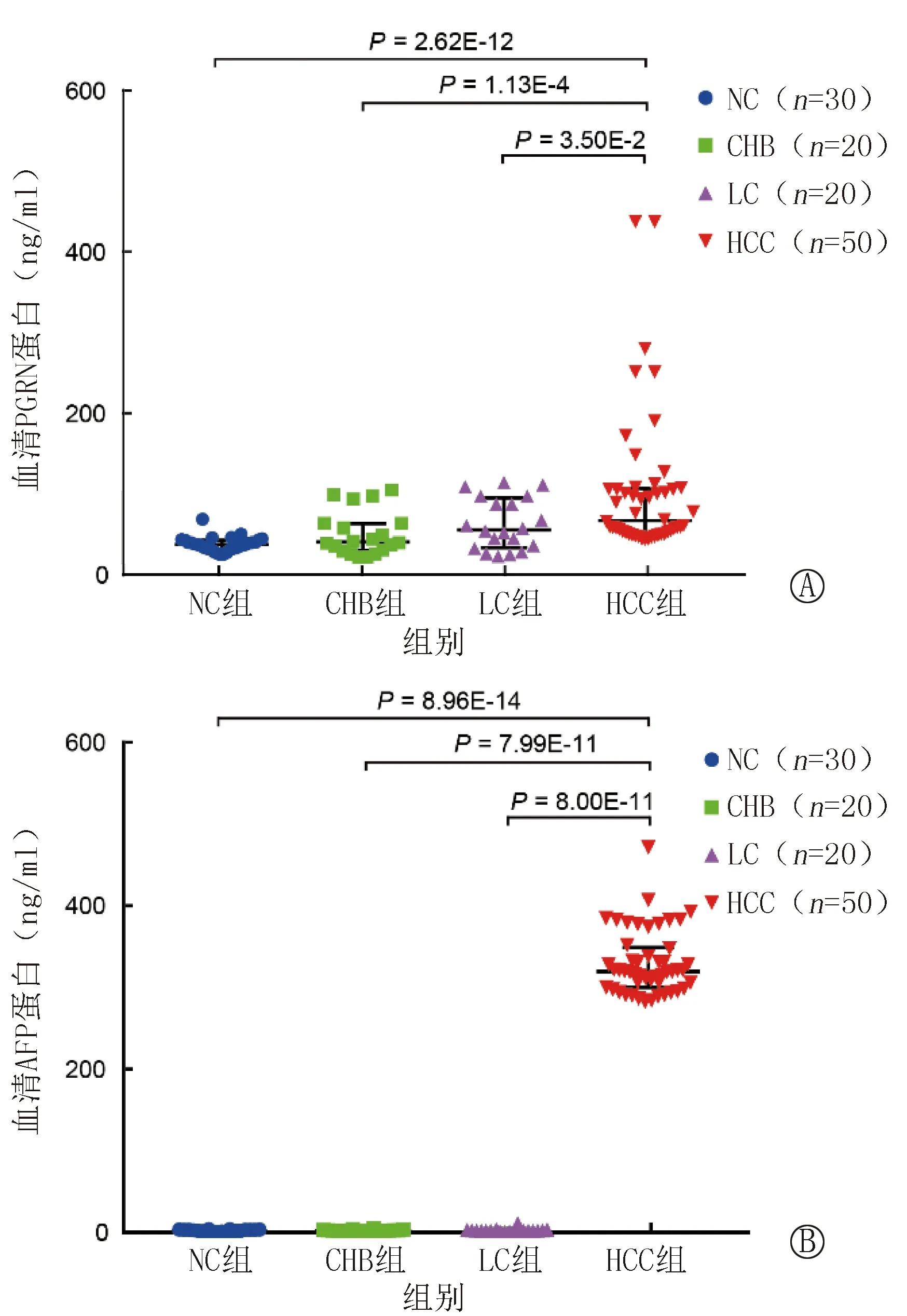
注:A为各组样本中PGRN水平差异情况,B为各组样本中AFP水平差异情况。黑色的水平线表示中位数或四分位数间距。AFP为甲胎蛋白,PGRN为颗粒蛋白前体,CHB为慢性乙型肝炎,HCC为肝癌,LC为肝硬化,NC为正常对照图2 各组样本中血清PGRN和AFP水平的差异
2.4 PGRN和AFP单独检测及联合检测HCC的ROC曲线
通过构建ROC曲线,本研究进一步评估了AFP、PGRN单独及联合检测对HCC的诊断价值。根据ROC曲线,AFP或PGRN单独检测(P值均<0.05),HCC诊断的最佳截断点分别为287.84 ng/ml和51.93 ng/ml。AFP和PGRN联合检测,HCC诊断的灵敏度为92.0%,高于AFP和PGRN单独检测;AFP和PGRN联合检测的特异度为96.9%,高于AFP和PGRN单独检测;AFP和PGRN联合检测的AUC为0.97,高于AFP和PGRN单独检测。见表3和图3。上述结果提示,PGRN可能是早期诊断HCC的候选血清标志物,且AFP和PGRN联合检测可能具有更高的诊断价值。

表3 血清AFP、PGRN单独检测及联合检测对HCC诊断价值的比较

注:蓝色为AFP单独检测诊断HCC的ROC曲线,绿色为PGRN单独检测HCC的ROC曲线,红色为AFP和PGRN联合检测诊断HCC的ROC曲线。AFP为甲胎蛋白,PGRN为颗粒蛋白前体,ROC为受试者工作特征曲线,HCC为肝癌图3 AFP和PGRN单独及联合检测诊断HCC的ROC曲线
2.5 HCC患者血清PGRN水平与临床病理参数间的相关性分析
根据HCC患者血清PGRN浓度中位数(74.12 ng/ml),本研究将HCC患者分为PGRN高表达组(n=25)和PGRN低表达组(n=25),并分析了HCC患者血清PGRN水平与临床病理参数的相关性。卡方检验结果显示,HCC患者血清PGRN蛋白水平与患者的年龄、性别、是否HBV感染、是否伴有肝硬化以及血清中AFP蛋白水平均无显著的相关性(P>0.05)。见表4。
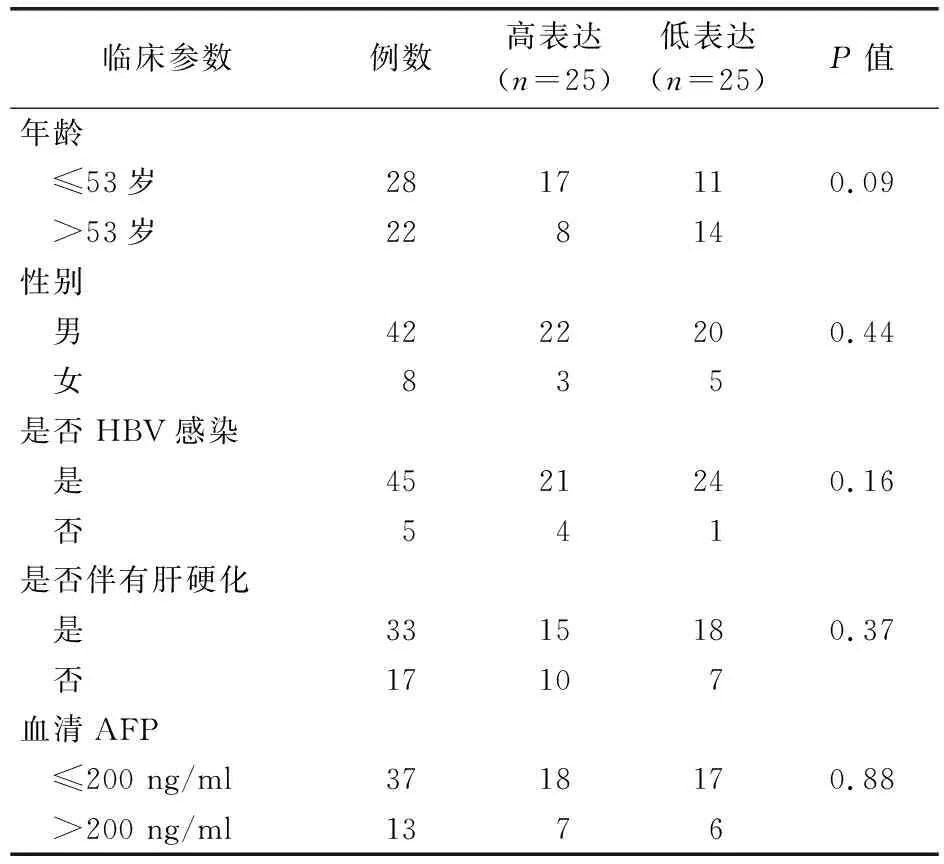
表4 HCC患者血清PGRN水平与临床病理参数的相关性分析(例)
3 讨论
本研究检测了NC组、CHB组、LC组和HCC组血清中PGRN水平,并评估了其诊断性能。结果显示,HCC组的血清PGRN水平均显著高于NC组、CHB组、LC组,表明PGRN在HCC的诊断中具有潜在的临床应用价值。此外,标志物PGRN和AFP联合检测时的AUC、灵敏度和特异度,较AFP或PGRN单独检测时更加显著,提示PGRN和AFP联合检测,可能有助于早期诊断HCC,减少漏诊,增强筛查效果,对HCC高危人群的筛查具有重要意义。
PGRN基因定位于染色体17q21.32,全长约4 kb,含12个外显子[20]。该基因编码的PGRN蛋白由593个氨基酸组成,相对分子质量为68 500 Da,经糖基化修饰后相对分子质量为90 000 Da。PGRN蛋白在人体各类组织或细胞中广泛表达,尤其是在快速分裂的细胞中,如皮肤成纤维细胞、免疫细胞等[11]。该蛋白能够调控上述细胞的生长、分裂和存活[11]。在肿瘤相关研究中,绝大部分上皮组织来源的肿瘤细胞(如卵巢癌细胞、乳腺癌细胞、肾上腺皮质瘤细胞和前列腺癌细胞等)中,PGRN蛋白均显著上调[11]。在肝癌研究中,肝癌组织与邻近的癌旁非HCC组织相比,PGRN的转录水平也显著上升[21]。这提示PGRN蛋白有望成为HCC的临床诊断候选标志物。
目前,HCC的临床诊断主要依靠血清中肿瘤标志物的检测[22]。肿瘤标志物检测的结果将有助于指导医生进行早期的发现、干预和治疗,以及改善患者的预后生存状态[23]。在过去十年里,虽然多种类型的血清检测标志物被发现可能能够用于肿瘤检测,如血清游离DNA突变,血清游离DNA甲基化等[24-25]。然而,血清蛋白标志物,因其血清需要量少、对操作人员的专业知识依赖性低、成本低、重复性高、样品不需要预处理等优势,仍是最适用于临床常规检测的标志物[25-27]。因此,积极探寻新的HCC蛋白标志物,成为临床研究的重点[28]。除AFP外,高尔基体蛋白73和γ-谷氨酰转肽酶在肝癌的临床检测和诊断中也有一定的应用[29]。但上述标志物均不能100%检测出早期HCC,临床诊断价值具有一定的局限性,迄今为止也尚未发现一种血清肿瘤标志物能够100%检测出早期HCC[30]。标志物联合诊断研究发现,采用多种标志物对肿瘤患者进行诊断,能够显著提高临床诊断的正确率[31]。AFP与其他肿瘤标志物联合检测可提高肝癌的检测效率,对于提高HCC患者的预后和生存率具有重要意义[32]。本项研究中也证实了PGRN与AFP联合检测HCC的效果要优于AFP或PGRN单独检测,这一结果提示可采用PGRN和AFP联合检测,以提升早期HCC患者的检出率。
综上所述,本研究发现PGRN和AFP联合检测下的AUC、灵敏度和特异度均高于单独检测,提示PGRN有望成为HCC早期诊断的血清标志物,与AFP联合检测增强早期HCC筛查能力。今后仍需进一步的多中心、大人群的验证工作,以确证PGRN作为HCC早期诊断血清标志物的潜力。

